硫酸亞鐵電位法滴定金化合物中金含量
何治鴻
(江西省漢氏貴金屬有限公司,江西 上饒 335500)
硫酸亞鐵電位法滴定金化合物中金含量
何治鴻
(江西省漢氏貴金屬有限公司,江西 上饒 335500)
本文提出了金化合物(KAu(CN)2、KAu(CN)4、KAuCl4、NaAuCl4、HAuCl4、AuCl3、[(C6H5)3P]AuCl)中金含量的測定方法,經過預處理后,在硫酸與磷酸介質中,在試液中插入鉑指示電極和飽和氯化鉀甘汞參比電極,調節酸度計至電位檔,在電磁攪拌下,用硫酸亞鐵標準滴定溶液滴定Au(III)至Au(0),至近終點時,再用微量滴定管滴定至電位值突躍最大為終點。方法加標回收率和精密度分別為99.51%~100.45%;RSD≤0.15%。金的質量分數:30.00%~55.00%,允許差:0.20%;金的質量分數:55.00%~70.00%,允許差:0.25%。通過試驗結果可知,該方法準確性好,精密度高,準確快速,操作簡單。
金化合物;硫酸亞鐵;電位滴定法
金 化 合 物(KAu(CN)2、KAu(CN)4、KAuCl4、NaAuCl4、HAuCl4、AuCl3、[(C6H5)3P]AuCl)作為重要的貴金屬材料,主要應用于飾品鍍金、儀器儀表精飾、防腐、紅外反射裝置、電子線路等方面。隨著電子、飾品等行業的快速發展,對金化合物的需求越來越大,更多的金化合物已逐漸被認識和應用,如AuCl3、[(C6H5)3P]AuCl。然而這些金化合物還沒有相應的檢測標準[1-5],為了對產品質量進行更好的監控,建立相應金化合物中金量的測定方法顯得很有必要。本文采用硫酸亞鐵電位滴定法測定AuCl3、[(C6H5)3P]AuCl中金量,研究了試料的處理、測定條件的選擇、不同方法間的比對、進行了試料的加標回收及方法精密度試驗。通過分析相關數據,筆者發現該方法準確性好,精密度高,準確快速,操作簡單。
1 方法提要
KAu(CN)2、KAu(CN)4試料用鹽酸與過氧化氫微波密閉溶解;NaAuCl4、AuCl3試料用少許水溶解,再加鹽酸與過氧化氫;[(C6H5)3P]AuCl試料用硝酸與高氯酸溶解。在硫酸與磷酸介質中,在試液中插入鉑指示電極和飽和氯化鉀甘汞參比電極,調節酸度計至電位檔,在電磁攪拌下,用硫酸亞鐵標準滴定溶液滴定Au(III)至Au(0),至近終點時,再用微量滴定管滴定至電位值突躍最大為終點。
2 試劑和材料
除非另有說明,在分析中僅使用確認為分析純的試劑和二級水。
2.1 鹽酸
鹽酸(ρl.19 g/mL)。
2.2 硝酸
硝酸(ρl.42 g/mL)。
2.3 硫酸
硫酸(ρl.84 g/mL)。
2.4 磷酸
磷酸(ρl.70 g/mL)。
2.5 高氯酸
高氯酸(70.0 %~72.0 %)。
2.6 過氧化氫
過氧化氫(30%,v/v)。
2.7 硫酸溶液
硫酸溶液(4+96)。
2.8 鹽酸與硝酸混合酸
3單位體積的鹽酸與1單位體積的硝酸相混合,用時現配。
2.9 硫酸與磷酸混合酸
量取200 mL硫酸(3.3)于瓷蒸發皿中,加熱至冒白濃煙,邊攪拌邊滴加高錳酸鉀溶液(3.10)至紅色不褪,取下,冷卻。加入200 mL磷酸(3.4),混勻。轉入500 mL玻璃瓶。
2.10 高錳酸鉀溶液
高錳酸鉀溶液(20 g/L)。
2.11 氯化鈉溶液
氯化鈉溶液(250 g/L)。
2.12 硫酸亞鐵標準滴定溶液
2.12.1 配制
稱取10.5 g硫酸亞鐵(FeSO4·7H2O)固體,溶于盛有5 000 mL硫酸溶液(3.7)的玻璃瓶中,混勻,放置七天以上標定。
2.12.2 標定
標定與試料的測定平行進行。移取10.00 mL金標準溶液(3.13)置于100 mL燒杯中,加入0.5 mL氯化鈉溶液(3.11),水浴上蒸至濕鹽狀,取下。加5 mL硫酸與磷酸混合酸(3.9),加水至40 mL體積。在溶液中插入鉑指示電極和飽和氯化鉀甘汞參比電極,調節酸度計至電位檔,在電磁攪拌下,用硫酸亞鐵標準溶液滴定至近終點時,再用微量滴定管滴定至電位值突躍最大為終點。平行標定三份,所消耗硫酸亞鐵標準滴定溶液體積的極差不應超過0.02 mL,取其平均值。
按式(1)計算硫酸亞鐵標準滴定溶液的實際濃度:

式中:
c——硫酸亞鐵標準滴定溶液的實際濃度,單位為mol/L;
c0——移取金標準溶液的濃度,單位為mg/mL;
V1——移取金標準溶液的體積,單位為mL;
V2——標定中所消耗的硫酸亞鐵標準滴定溶液的體積,單位為mL;
196.966——金的摩爾質量,單位為g/mol。
2.13 金標準溶液
稱取0.50 g金屬金(質量分數不小于99.99%),精確至0.000 1 g。置于400 mL燒杯中,加10 mL鹽酸與硝酸混合酸(3.8),蓋上表面皿,水浴加熱至完全溶解,取下。用少量水沖洗表面皿及燒杯壁,加5.0 mL氯化鈉溶液(3.11),水浴蒸至濕鹽狀,取下。加4 mL鹽酸,用少量水沖洗燒杯壁,水浴蒸至濕鹽狀。如此反復3~4次,取下。加200 mL鹽酸(3.1),轉入500 mL容量瓶中,用水稀釋至刻度,混勻。此溶液1 mL含1 mg金。
3 分析步驟
3.1 試料
按表1稱取試樣,精確至0.000 1 g。

表1 試驗取樣表
3.2 測定次數
獨立的進行兩次測定,取其平均值。
3.3 空白試驗
隨同試料做空白試驗。
3.4 測定
3.4.1 分解試料
(1)將試料KAu(CN)2、KAu(CN)4置于微波溶樣罐中,在通風櫥中,加15 mL鹽酸(3.1)、5 mL過氧化氫(3.6),密閉。置于微波溶樣儀中,設置分解條件為溫度200 ℃、升溫時間15 min、恒溫時間5 min進行分解。待分解結束,冷卻,取出微波溶樣罐,將試液轉入250 mL燒杯中。
(2) 用 少 量 水 將 試 料 KAuCl4、NaAuCl4、HAuCl4、AuCl3轉入250 mL燒杯中,加5 mL鹽酸(3.1)、0.2 mL過氧化氫(3.6)。
(3)將試料[(C6H5)3P]AuCl置于250 mL燒杯中,加10 mL硝酸(3.2)、5 mL高氯酸(3.5),蓋上表皿,加熱至冒白煙,待白煙消失。加入5 mL鹽酸(3.1)、1 mL過氧化氫(3.6),如此反復3~4次,直至殘渣完全溶解。
3.4.2 試液的處理
在4.4.1的三種試液中加5 mL氯化鈉溶液(3.11),置于水浴上蒸至濕鹽狀,取下。用水溶解殘渣,轉入100 mL容量瓶中,用水稀釋至刻度,混勻。
3.4.3 滴定
移取10.00 mL試液于100 mL燒杯中,加5 mL硫酸與磷酸混合酸(3.9),加水至40 mL體積。在試液中插入鉑指示電極和飽和氯化鉀甘汞參比電極,調節酸度計至電位檔,在電磁攪拌下,用硫酸亞鐵標準滴定溶液(3.12)滴定至近終點時,再用微量滴定管滴定至電位值突躍最大為終點。
4 結果與討論
4.1 氯化金中鹽酸及過氧化氫的加入量
由于氯化金易溶解,采用不同比例的鹽酸、過氧化氫對氯化金進行溶解,試驗結果如表2所示。
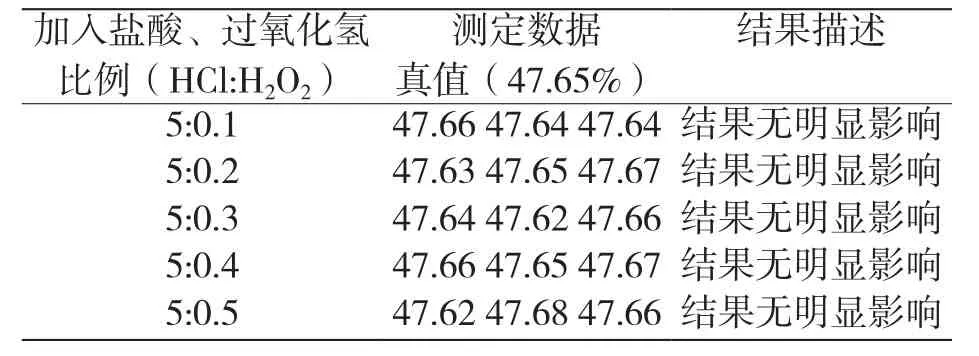
表2 氯化金中鹽酸及過氧化氫的加入量的選擇
考慮到原標準中氯金酸鉀、氯金酸鈉、氯金酸的溶解方法,加5 mL鹽酸、0.2 mL過氧化氫,滿足測定要求。所以,氯化金中鹽酸及過氧化氫的加入量分別為5 mL、0.2 mL。
4.2 三苯基膦氯化金中硝酸的加入量
由于硝酸在試驗中具有破壞試料中有機基團的功能,所以試選了硝酸加入量為5 mL、10 mL、15 mL、20 mL,分別進行實驗,試驗結果如表3所示。結果表明,所測數據沒有明顯差異,加入硝酸過少則試料不能完全分解,本次試驗選擇加入量為10 mL。
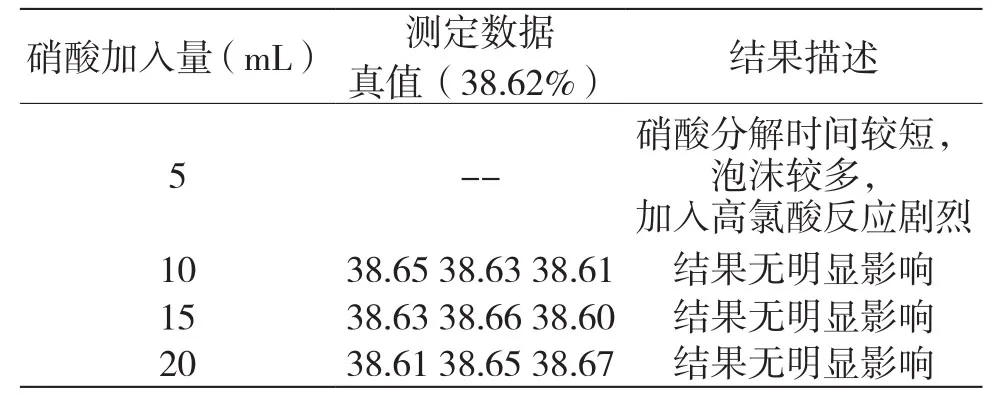
表3 三苯基膦氯化金中硝酸加入量的選擇
4.3 三苯基膦氯化金中高氯酸的加入量
高氯酸加入量為1 mL、3 mL、5 mL、7 mL、10 mL分別進行實驗,試驗結果如表4所示。結果表明,1 mL高氯酸不能使試料完全分解,3 mL、5 mL、7 mL、10 mL的試驗數據沒有明顯差異,本次試驗選擇加入量為5 mL。
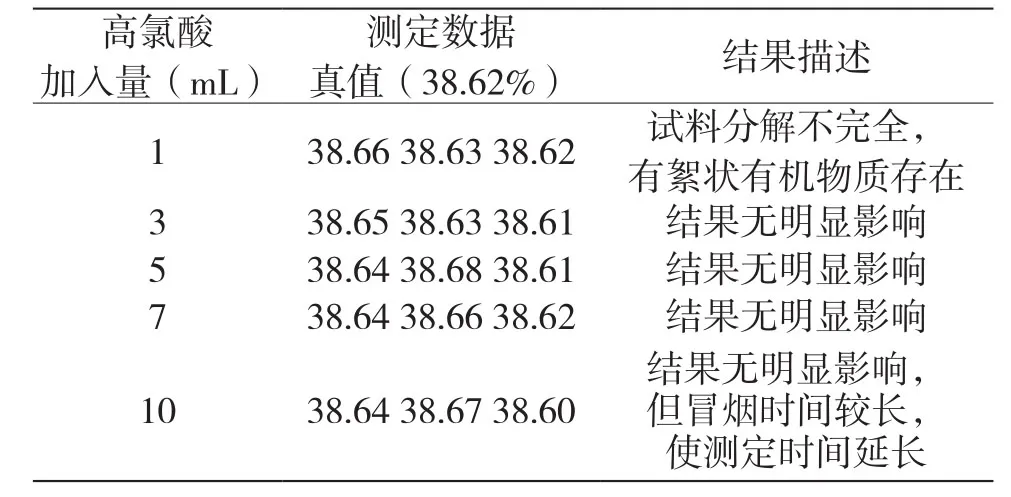
表4 三苯基膦氯化金中高氯酸的加入量的選擇
4.4 關于測定酸度的確定
硫酸與磷酸混合酸加入量為1 mL、3 mL、5 mL、7 mL、10 mL,試驗結果表5所示。結果表明,測數據沒有明顯差異,與原標準一致,本次試驗選擇加入量為5 mL。

表5 測定酸度的選擇
4.5 方法精密度
對 [(C6H5)3P]AuCl、AuCl3、NaAuCl4、KAu(CN)2、KAu(CN)4,按上述最佳條件進行測定,試驗結果如表6所示。
4.6 方法的對照試驗
將本方法與火試金進行對比,由表7可知,火試金重量法測定金化合物中的金量稱樣量大,分析成本高,分析周期長。
4.7 樣品加標回收率
由于AuCl3前處理較為簡單,僅對試料用鹽酸、雙氧水進行處理,所以本實驗加入一定金溶液進行加標回收,[(C6H5)3P]AuCl由于較難分解,所以加入金屬金(≥99.99%)進行加標回收。標準回收試驗結果如表8所示。

表6 試樣分析結果(%)
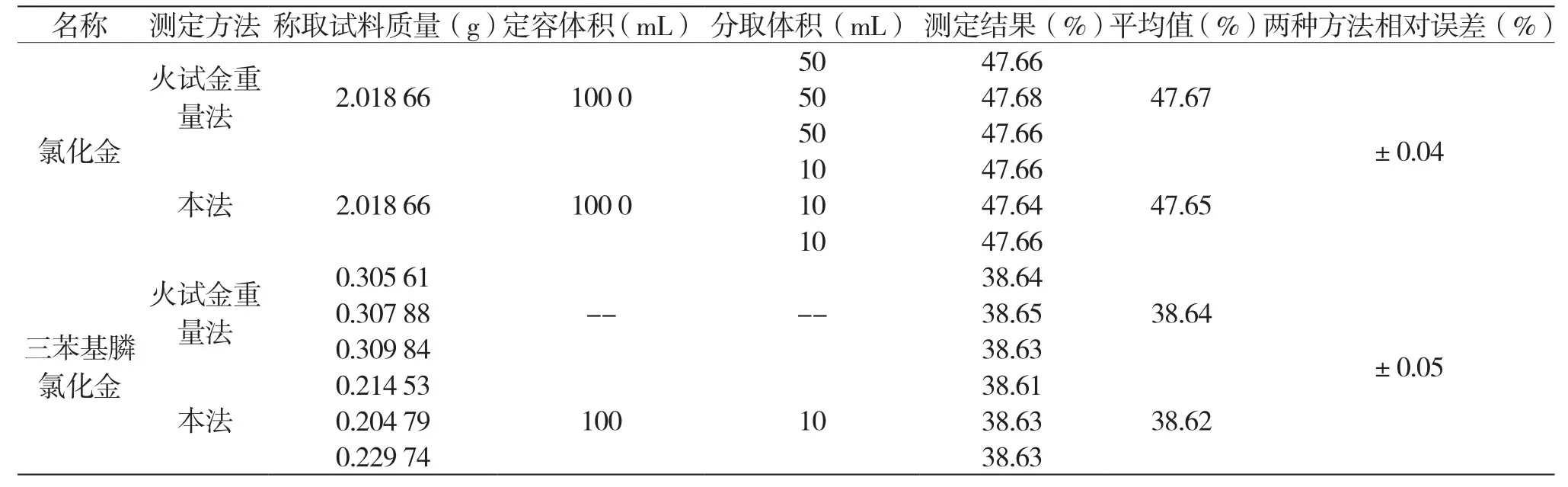
表7 方法對照試驗結果

表8 試樣加標回收試驗
5 結論
硫酸亞鐵電位滴定法測定氯化金、三苯基膦氯化金等金化合物操作簡便、快捷,方法準確可靠,方法加標回收率和精密度分別為99.51%~100.45%;RSD≤0.15%。金的質量分數:30.00%~55.00%,允許差:0.20%;金的質量分數:55.00%~70.00%,允許差:0.25%。
1 中華人民共和國國家質量監督檢驗檢疫總局,中國國家標準化管理委員會.GB/T 15072.1-2008 貴金屬合金化學分析方法金、鉑、鈀合金中金量的測定硫酸亞鐵電位滴定法[S].北京:中國標準出版社,2008.
2 中華人民共和國國家發展和改革委員會.YS/T 645-2007 貴金屬化合物分析方法金量的測定硫酸亞鐵電位滴定法[S].北京:中國標準出版社,2007.
3 中華人民共和國國家發展和改革委員會.HG/T 3446-2003 化學試劑氯金酸(氯化金)[S].北京:化學工業出版社,2003.
4 中華人民共和國國家發展和改革委員會.GB/T 15249.1-2009 合質金化學分析方法金量的測定火試金重量法[S].北京:中國標準出版社,2009.
5 中華人民共和國國家質量監督檢驗檢疫總局.GB/T 11066.1-2008 金化學分析方法金量的測定火試金法[S].北京:中國標準出版社,2008.
Determination of Gold Content in Gold Compound by Ferrous Sulfate Potentiometry Method
He Zhihong
(Jiangxi Province Han's Chancellor Precious Metals Limited, Shangrao 335500, China)
In this paper, gold compounds (KAu (CN)2, KAu (CN)4, KAuCl4, NaAuCl4, HAuCl4, AuCl3, [(C6H5)3P]AuCl)method for the determination of gold content, after pretreatment, in sulfuric acid and phosphoric acid medium is inserted into the platinum indicator electrode and saturated calomel reference potassium chloride than the electrode in solution,regulating pH meter to potential grade in electromagnetic stirring, using ferrous sulfate titrated with the standard solution of Au(III) to Au(0), to the near end point, and then the Microburette titration to jump to the maximum potential value of end point. The method recoveries and precision is 99.51%~100.45% respectively; RSD≤0.15%. The mass fraction of gold:30%~55%; allowable difference: 0.20%; gold mass fraction: 55%~70%; allowable difference: 0.25%. The test results show that the method is accurate, accurate, accurate, fast and easy to operate.
gold compounds; ferrous sulfate; Potentiometric titration
TG115.3;O657.1
A
1008-9500(2017)06-0019-05
2017-04-12
本文系江西省科技型中小企業創新基金項目(項目編號:201040)的階段性研究成果。
何治鴻(1970-),男,安徽馬鞍人, 工程師,從事貴金屬分析和貴金屬催化劑的研發及回收工作。

