硨蠔(Hippopus hippopus)的人工繁育*
張躍環 肖 述 李 軍 馬海濤 張 揚 向志明 喻子牛
(中國科學院南海海洋研究所 熱帶海洋生物資源與生態重點實驗室 廣東省應用海洋生物學重點實驗室 廣州 510301)
硨蠔(Hippopus hippopus)的人工繁育*
張躍環 肖 述 李 軍 馬海濤 張 揚 向志明 喻子牛①
(中國科學院南海海洋研究所 熱帶海洋生物資源與生態重點實驗室 廣東省應用海洋生物學重點實驗室 廣州 510301)
于2016年4—9月開展了硨蠔(Hippopus hippopus)人工繁育技術研究。采用五羥色胺進行催產、促使配子排放;精卵分別收集,進行異體間受精以避免自交;受精卵經過30h孵化,選出600萬D形幼蟲進行培育。硨蠔的早期生活史與硨磲(Tridacnaspp.)相似,經歷前期面盤幼蟲、中期面盤幼蟲、后期面盤幼蟲、足面盤幼蟲、單水管稚貝、雙水管稚貝、外套膜觸手稚貝、幼貝等階段。與硨磲不同的是,硨蠔懷卵量較少,但卵徑較大,D型幼蟲也較大,幼蟲趨光性更強,殼長2.0mm以后外套膜不伸出殼緣外,幼貝貝殼形態也不同于硨磲。同硨磲幼蟲一樣,硨蠔幼蟲需要構建蟲黃藻系統之后,才能出現鰓、次生殼等,從而完成變態成為稚貝。硨蠔幼蟲變態率較低,僅為1.4%。中間育成期間,絲狀藻和錐形螺是稚貝培育的主要敵害,需及時清理才能確保稚幼貝正常生長發育。經過120d的精心飼育,培養出平均殼長6.3mm幼貝500余個。本研究為進一步開展硨蠔人工繁育、中間育成、增殖放流、資源修復及移植保育提供了參考。
硨蠔;人工繁育;幼蟲培育;附著變態;蟲黃藻;中間育成
硨蠔(Hippopus hippopus)隸屬硨磲科(Tridacnidae)硨蠔屬(Hippopus),分布于印度洋東部和太平洋西部及我國南海海域,主要棲息在珊瑚礁砂質底中,是珊瑚礁生態系統的主要關鍵框架生物之一(董楊等,2015)。從全球范圍內來看,硨蠔有兩種,一種是硨蠔,另一種叫作瓷口硨蠔(H.porcellanus)。在我國分布最多的是硨蠔,瓷口硨蠔只有零星分布(周勤等,2014)。硨蠔雖與硨磲(Tridacna)同為硨磲科,但二者外觀上仍有一些差別:首先二者貝殼形態明顯不同(楊文等,2013),其次硨蠔外套膜不翻出殼緣,而硨磲外套膜可以翻出殼緣;另外硨蠔外套膜顏色比較單一,而硨磲外套膜顏色多種多樣,五彩繽紛。
迄今為止,硨蠔的人工繁育報道較少。關島大學海洋實驗室描述了硨蠔幼蟲及稚貝的早期生活史(Jameson,1976);菲律賓席麗曼大學海洋生物研究室報道了硨蠔產卵、幼蟲培育及早期生長情況(Alcalaet al,1986)和瓷口硨蠔配子排放及幼蟲培育狀況(Alcazaret al,1987);以上報道均獲得了少量殼長為600—800μm 的稚貝,但尚未見培育至幼貝的相關報道。本研究在突破了硨磲人工繁育技術的基礎上(張躍環等,2016),在我國首次成功進行了硨蠔人工繁育,為進一步開展南海硨蠔資源修復及珊瑚礁生態系統多樣性保護提供了技術保障。
1 材料與方法
1.1 親本促熟
2016年4月上旬在南海采集活力強、健康無損,殼長 36—40cm,鮮重為平均 5kg/indi.的親本 12個,共重約60kg。按照15kg/m3的密度放置于中國科學院南海海洋研究所海南熱帶海洋生物實驗站的2個2m3玻璃鋼水槽中。采用“微充氣+微流水”形式進行人工促熟,流水量為每缸 12m3/d,經過2周促熟,硨蠔性腺發育成熟。促熟期間,海水均經兩次砂濾,海水水溫27.5—29.3°C,鹽度32—33,采用半遮光的方式控制光照強度。
1.2 受精產卵
選取 5個性成熟的硨蠔,注射濃度為0.8mg/mL的五羥色胺催產劑至外套膜中,之后置于盛有20L新鮮海水的塑料桶中,幾分鐘后親本開始排放精子,再過幾分鐘,開始排放卵子,單獨收集每個個體的精、卵,用20L塑料桶收集精子,50L塑料桶收集卵子。一共獲得5桶精子和5桶卵子。顯微鏡鏡檢發現,其中 2個個體的卵子很圓,為黑色,發育整齊,故選用這2個個體的卵子作為母本;檢查精子發現5個個體精子均較好。采用異體間配對原則,利用另外3個個體精子與這組卵子受精(平均分為3份),精卵比例(體積比)為1︰60左右。受精后,每隔3—5min輕輕攪動受精卵一次;受精 1h以后,將受精卵液倒入玻璃鋼池中微充氣孵化,其密度為15indi./mL。
1.3 幼蟲培養
受精卵經過30h孵化發育至D形幼蟲,利用對角線70μm篩絹網選優,共獲得600萬個D形幼蟲。將幼蟲放置于3個1m3盛有清新海水的玻璃鋼桶中采用微充氣法進行培育,密度控制在2indi./mL以內;至受精后第6天,幼蟲密度調整為0.5indi./mL。幼蟲培育期間,每天換水一次,換水量控制在60%,餌料為金藻,投喂量在0.5×104—1.0×104cell/mL·d。在此期間,水溫為28.0—29.6°C,鹽度為32—33,pH在8.2—8.3之間,半遮光控制光照。
幼蟲經 6d發育至足面盤幼蟲后,將其放置于4×105—5×105cell/mL 的蟲黃藻溶液中浸泡 2h,幼蟲密度控制在30—40indi./mL。采用“微充氣+不換水”方式處理,7—10d幼蟲完成變態。在此期間,水溫為28—30°C,鹽度為32—33,pH 為8.2—8.3,半遮光控制光照。
1.4 中間育成
當幼蟲完成變態后,建立了完整的蟲黃藻系統。經過 1個月的培育,稚貝殼長達 400—500μm,形成雙水管,運動方式仍為爬行;經過 2個月左右培育,殼長達1—2mm,成為幼貝,與成體硨蠔外觀上非常相似,可站立起來,利用足絲附著在容器底壁或者附著基上,完全依賴蟲黃藻營養。在此期間,采用“微充氣+微流水”方式飼育,定期清理培育容器上附著生物及各種藻類等,半遮光控制光照,切忌光線過強。
1.5 測定指標
受精率為卵裂受精卵數量與全部卵子數量之比;孵化率為D形幼蟲數量與發生卵裂卵子數量之比;幼蟲存活率為足面盤幼蟲數量與 D形幼蟲數量的比值;變態率為完成變態稚貝數量與足面盤幼蟲數量比值;稚貝存活率為稚貝數量與剛剛完成變態稚貝數量比值;幼貝存活率為幼貝數量與剛形成幼貝時數量比值。
卵徑、幼蟲和稚貝殼長、殼高在顯微鏡下用目微尺測量;幼貝殼長、殼高用電子游標卡尺測量(精確值0.01mm);每個階段測量90個子代樣品。
2 結果
2.1 配子排放
注射五羥色胺催產劑后,硨蠔在5—7min后開始排放精子,持續時間為6—8min;間隔9—10min后開始排放卵子,持續時間為27—33min(表1)。為了避免自體受精,精卵嚴格分開收集。
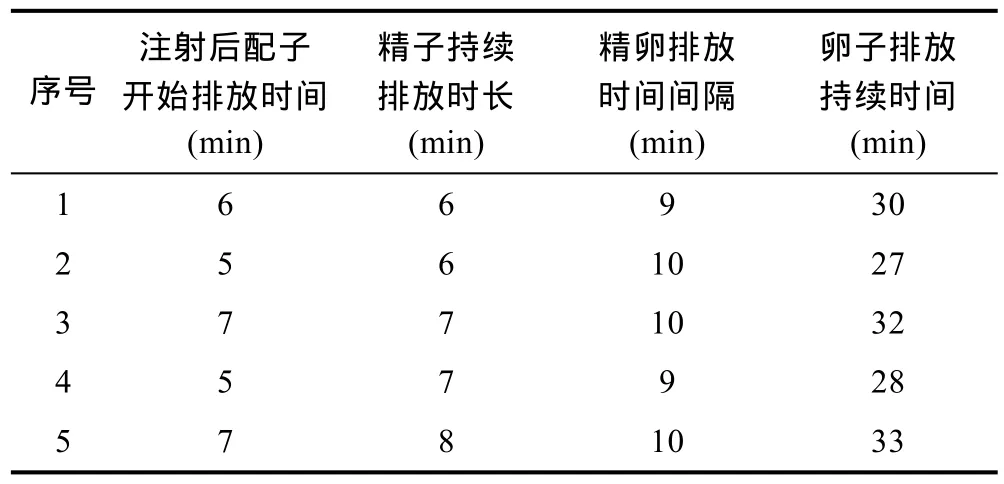
表1 注射催產劑后硨蠔親本排放配子情況Tab.1 Duration of gamete release after serotonin injection for horse’s hoof clam,Hippopus hippopus
2.2 受精孵化
硨蠔卵徑為120.08±0.30μm。按照1︰60的精卵比例進行異體間配對受精,受精率(72.4±1.2)%。受精卵經過第一極體、第二極體、2細胞、4細胞、8細胞、多細胞、囊胚期、原腸期、擔輪幼蟲發育至 D形幼蟲(表2,圖1),孵化率為93.4%±4.5%(表3)。在硨蠔受精卵中,發現了明顯的三級卵膜。
2.3 幼蟲發育
經過30h胚胎發育,獲得了D形幼蟲,殼長×殼高為(170.13±0.95)×(140.25±0.72)μm,采用 260 目篩絹網進行幼蟲選育,放置于1000L玻璃鋼桶中,采用微充氣方式進行幼蟲培育,幼蟲密度為2indi./mL。經過 7d的幼蟲培育,發育至足面盤幼蟲,幼蟲足外伸,匍 匐 運 動 , 殼 長 × 殼 高 為(200.05±1.05)×(170.49±0.57)μm(表2,圖1)。在整個浮游期,幼蟲殼長一直大于殼高,幼蟲累計存活率為10.6%±1.9%(表3)。
2.4 附著變態
濃縮足面盤幼蟲,利用蟲黃藻懸液浸泡 2h,促進足面盤幼蟲攝食蟲黃藻,經過反復比較,發現每次浸泡幼蟲攝食比例在20%—30%。多次浸泡可以提高蟲黃藻植入幼蟲體內的比率,促進幼蟲變態。經過 7—14d培育,足面盤幼蟲生活方式由浮游轉為底棲,完成變態,出現鰓、次生殼,建立了蟲黃藻系統。但是,變態率較低,變態率僅為1.4%±0.2%(表3)。
2.5 稚貝培育
采用“微充氣+微流水”的方式進行稚貝培養,不投喂任何單胞藻,保持水質清新。受精后第25天,發育至單水管稚貝階段,殼長×殼高=(331.75±18.66)×(270.69±13.52)μm;受精后第30天,發育至雙水管稚貝階段,殼長×殼高=(450.19±32.47)×(361.42±24.16)μm;受精后第45天,發育至多觸手稚貝階段,殼長×殼 高 =(920.46±75.22)×(901.55±62.58)μm, 即 將 進 入幼貝階段(表2,圖1)。在此期間,稚貝存活率為14.8%± 2.7%(表3)。

表2 硨蠔早期生活史各階段的發育時間及其規格Tab.2 Early development stages and larval sizes of horse’s hoof clam Hippopus hippopus
2.6 幼貝培養
受精后第50天,當稚貝殼長≥1.20mm,進入幼貝階段。與稚貝相比,貝殼加厚,變得不透明,外套膜外伸,可以站立起來,進行光合作用為機體提供營養。受精后第120 天,殼長×殼高=(6.32±0.60)×(3.95±0.45)mm,出現了貝殼形態轉換,有放射嵴,貝殼形態扭曲同成體硨蠔比較相似(表2,圖1)。在此期間,幼貝存活率為37.5%±5.4%(表3)。

圖1 硨蠔早期生活史Fig.1 Early life history of the horse’s hoof clam Hippopus hippopus
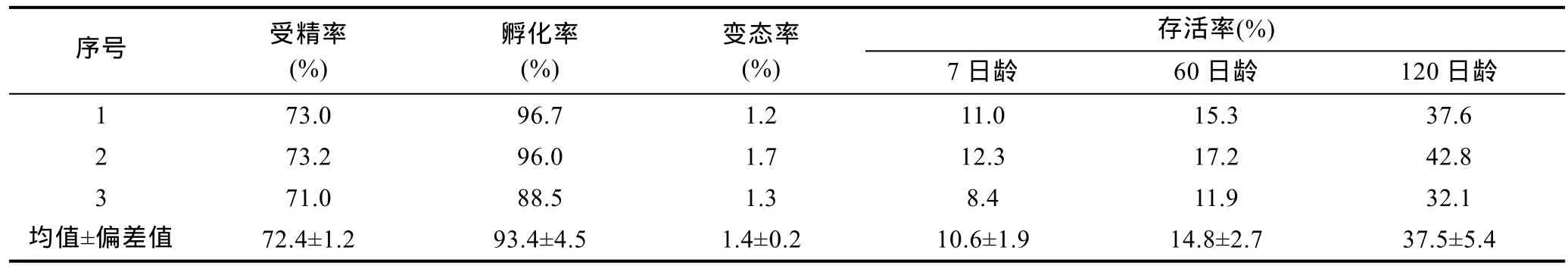
表3 受精率、受精卵孵化率和幼蟲變態不同日齡存活率Tab.3 Fertilized rate,hatching rate,metamorphosis and survivals at different stages for horse’s hoof clam Hippopus hippopus
3 討論
3.1 繁殖特點
硨蠔與硨磲同為硨磲科,二者存在較多相似之處,但也存在部分差異。相似之處在于:(1)卵子中包含三級卵膜,三級卵膜多是腹足類所特有的,具有提供營養以及保護受精卵功能;(2)早期發育均經歷了胚胎發育、幼蟲、蟲黃藻系統構建、稚貝、幼貝等階段(張躍環等,2016)。不同點在于:(1)懷卵量不同(同樣大小的硨蠔懷卵量僅為硨磲的一半左右);(2)卵徑大小不同(硨蠔卵徑為120μm,而硨磲的卵徑為95—100μm),差異顯著;(3)幼蟲浮游趨光性不同(硨蠔幼蟲具有較強的趨光性,經常聚集在水面上,形成白色面粉狀小塊,需要較強的充氣或者水流將其驅散開來,而硨磲幼蟲不具有這么強的趨光性);(4)對基質要求不同(硨蠔幼蟲在珊瑚砂底質中容易完成變態,而硨磲幼蟲在珊瑚石底質中具有較好的變態率);(5)稚幼貝外套膜伸展程度不同(在稚幼貝早期階段,二者均有外套膜觸手可以伸出殼外緣,當硨蠔幼貝殼長≥2mm后外套膜無法翻出殼外緣,而硨磲幼貝外套膜一直可以翻出殼外緣)(Jameson,1976)。
3.2 附著變態
大多數海洋無脊椎動物均存在浮游幼蟲階段,能否變態成功被看作是海洋軟體動物生命周期中的里程碑,也是從浮游生活到底棲生活的一個橋梁(Yanet al,2006)。目前為止,僅有兩篇關于硨蠔幼蟲發育的報道,其變態水平均極其低下,不足1%。本研究中,硨蠔幼蟲的變態率僅為1.4%,這可能與硨蠔變態過程中需要構建蟲黃藻系統有關。此前,學者們在開展大硨磲(T.gigas)、無鱗硨磲(T.derasa)、鱗硨磲(T.squamosa)、長硨磲(T.maxima)、諾瓦硨磲(T.nova)、番紅硨磲(T.crocea)的人工繁育時,都發現幼蟲變態率均≤1%,說明硨磲幼蟲變態水平偏低,這是限制硨磲苗種規模化繁育的最大瓶頸。硨蠔、硨磲幼蟲變態均需要建立蟲黃藻系統,沒有蟲黃藻系統幼蟲一定無法變態(Fittet al,1984)。在這個過程中,大部分幼蟲由于蟲黃藻系統構建失敗被直接淘汰,死亡之后招來諸多原生動物清理尸肉,這些原生動物清理完死亡個體后,又會侵蝕健康的處于變態中或者剛剛完成變態的個體,從而造成變態水平極其低下。因此,在苗種繁育中,提高硨蠔幼蟲變態率至關重要。
3.3 中間育成
中間育成包括稚貝培養和幼貝培養,是生產貝類大規格苗種的必要手段(張國范等,2010)。在硨蠔中間育成的過程中,發現兩種敵害是其能否成功的關鍵所在。
一是絲狀藻。在流水培養過程中,經常會出現大量絲狀藻粘在硨蠔稚貝或者幼貝殼面上,之后將整個個體包圍,導致無法開殼進行光合作用,因為營養匱乏或者窒息死亡(Fatherree,2006)。目前發現兩種主要的絲狀藻,一種為綠色,毒害作用不強,稚、幼貝死亡率不高,一般在30%以下;還有一種為黑色,毒害作用很強,一旦暴發,稚幼貝死亡率在90%以上,甚至全軍覆沒。為了有效防止絲狀藻對稚、幼貝的危害,在其繁育過程中一定要以防為主,從源頭上消滅絲狀藻的孢子來源,這樣就可以有效防止絲狀藻滋生。
二是一種小型錐形螺(Turbonillasp.)。這種錐形螺會從稚、幼貝足絲孔部位吮吸軟體部組織,從而引起個體死亡(Fatherree,2006)。錐形螺是小塔螺科(Pyramidellidae)下的一個屬,這類螺通常個體較小,最大在10mm左右,具吻,多營體外寄生生活,通過口針刺進寄主軟體組織中,然后吸食寄主體液及軟體組織,大多寄生在多毛類、棘皮類、貝類或者甲殼類等無脊椎動物體外。由于錐形螺與硨蠔繁殖期比較一致,在自然界中,硨蠔稚、幼貝經常與錐形螺生活在一起,故對硨蠔存活造成一定程度的危害(陳志云等,2011)。在中間育成過程中,如果出現這種小規格錐形螺,一定要及時清理,否則會造成稚幼貝不斷死亡,直到全部死光。為了防止這種小規格釘螺造成傷害,需要勤觀察,發現后及時清理即可。
4 結論
本文通過親貝促熟、催產孵化、幼蟲培育、稚貝培養及中間育成等技術環節,在我國首次培育出硨蠔幼貝,同時比較了硨蠔與硨磲的表型差異,填補了國內相關研究空白,為南海硨蠔資源恢復及珊瑚礁生態系統修復奠定了良好的基礎。
楊 文,蔡英亞,鄺雪梅,2013.中國南海經濟貝類原色圖譜.北京:中國農業出版社,194—196
陳志云,張素萍,2011.小塔螺科系統分類學研究現狀與展望.海洋科學,35(10):123—127
張國范,閆喜武,2010.蛤仔養殖學.北京:科學出版社,64—70
張躍環,肖 述,李 軍等,2016.鱗硨磲的人工繁育和早期發生.水產學報,40(11):1713—1723
周 勤,王玉芬,姜秀鳳,2014.硨磲研究現狀及在我國南海開展養殖的前景.熱帶海洋學報,33(2):87—93
董 楊,李向民,2015.硨磲資源保護、開發及其產業化發展前景.水產科學,34(3):195—200
Alcala A C,Solis E P,Alcazar S N,1986.Spawning,larval rearing and early growth inHippopus hippopus(Linn.)(Bivalvia:Tridacnidae).Silliman Journal,33:45—53
Alcazar S N,Solis E P,Alcala A C,1987.Serotonin-induced spawning and larval rearing of the China clam,Hippopus porcellanusRosewater (Bivalvia:Tridacnidae).Aquaculture,66(3—4):359—368
Fatherree J,2006.Giant clams in the sea and the aquarium.Liquid Medium.Florida:Tampa Press,197—198
Fitt W K,Fisher C R,Trench R K,1984.Larval biology of tridacnid clams.Aquaculture,39(1—4):181—195
Jameson S C,1976.Early life history of the giant clamsTridacna croceaLamarck,Tridacna maxima(R?ding),andHippopus hippopus(Linnaeus).Pacific Science,30(3):219—233
Yan X W,Zhang G F,Yang F,2006.Effects of diet,stocking density,and environmental factors on growth,survival,and metamorphosis of Manila clamRuditapes philippinarumlarvae.Aquaculture,253(1—4):350—358
致謝 感謝中國科學院海南熱帶海洋生物實驗站對本文的大力幫助。
ARTIFICIAL BREEDING OF HORSE’S HOOF CLAMHIPPOPUS HIPPOPUSIN SOUTH CHINA SEA
ZHANG Yue-Huan, XIAO Shu , LI Jun, MA Hai-Tao, ZHANG Yang, XIANG Zhi-Ming, YU Zi-Niu
(Key Laboratory of Tropical Marine Bio-resources and Ecology,Guangdong Provincial Key Laboratory of Applied Marine Biology,South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou510301,China)
Artificial breeding of horse’s hoof clamHippopus hippopuswas conducted at the Tropical Marine Biological Research Station in Hainan in April—September,2016.The results show that serotonin can effectively promote gamete release.Six million D-shaped larvae were obtained after 30-h incubation by cross-fertilization to avoid self-fertilization.The horse progeny underwent early veliger,middle veliger,late veliger and pedi-veliger larvae,single-siphon and double-siphon spat,mantle tentacles spat,and youth during the early history life stage,which is same to that of fluted giant clams excepted that the fecundity of horse’s hoof clam is less than that of fluted giant clam,while egg size and D larvae are larger than those of fluted giant clam.Light phototaxis of horse’s hoof clam larvae was stronger than that of fluted giant clam,and shell shape is different from each other.Larvae can complete metamorphosis forming spat after establishing the zooxanthellae tubular system,growing out gill,second shell,etc.Metamphosis of larvae was only 1.4% during the settling stage.Filamentous algae and Oncomelania are offspring of cultivating key predators during the grow-out stage.Hence,the predators should be cleaned out regularly to ensure normal growth and development for progeny.Some 500 youth progeny in shell length of 6.3 mm were obtained after 120-day rearing.This study on the artificial breeding for horse’s hoof clam may provide theoretical basis and reliable techniques for conducting giant clam aquaculture and transplantation work.
Hippopus hippopus;artificial breeding;larval rearing;metamorphosis;zooxanthellae;grow-out stage
S961.6
10.11693/hyhz20170300069
* 中國科學院戰略先導A專項,XDA13020200號;中國科學院STS項目,KFJ-EW-STS-123號;中國科學院重點部署項目,KGZD-EW-609號;國家貝類現代產業技術體系建設項目,CARS-47號。張躍環,博士,副研究員,Email:yhzhang@scsio.ac.cn
① 通訊作者:喻子牛,研究員,博士生導師,Email:carlzyu@scsio.ac.cn
2017-03-24,收修改稿日期:2017-05-18

