慢性腎臟病患者發生血管內皮功能障礙的危險因素分析
黃華星,沈良蘭,張芬,王曉華,房星星,陳冬梅,沈燕
(南通大學第二附屬醫院,江蘇南通226001)
慢性腎臟病患者發生血管內皮功能障礙的危險因素分析
黃華星,沈良蘭,張芬,王曉華,房星星,陳冬梅,沈燕
(南通大學第二附屬醫院,江蘇南通226001)
目的探討慢性腎臟病患者發生血管內皮功能障礙的影響因素。方法選取慢性腎臟病3~5期患者125例,均通過血管超聲檢測血流介導的舒張功能(FMD),以FMD中位數為界點,將患者分為FMD≥6.4%組和FMD<6.4%組,收集兩組臨床病理資料。采用單因素及多因素Logistic回歸分析法分析慢性腎臟病患者發生血管內皮功能障礙的影響因素。結果兩組年齡、性別、BMI、24 h尿蛋白、LDL比較差異均無統計學意義(P均>0.05);FMD<6.4%組收縮壓、舒張壓、高敏C反應蛋白、肌酐、尿酸水平均高于FMD≥6.4%組,腎小球濾過率(GFR)低于FMD≥6.4%組(P均<0.05)。多因素分析結果顯示,尿酸、GFR是慢性腎臟病患者發生內皮功能障礙的獨立影響因素(P均<0.05)。結論尿酸、GFR是慢性腎臟病患者發生血管內皮功能障礙的獨立影響因素。
慢性腎臟病;尿酸;腎小球濾過率;血管內皮功能障礙
近年來,慢性腎臟病發病率逐年上升,已經成為全球性公共健康問題。大多數慢性腎臟病難以根治,治療的目標為控制并發癥、延緩疾病進展,避免進入尿毒癥期發展為終末期腎病(ESRD)[1]。慢性腎臟病患者常合并血管內皮功能障礙,內皮一氧化氮(NO)生物利用度缺陷;血管內皮功能障礙已被認為是慢性腎臟病進展和惡化的危險因素之一[2]。早期發現慢性腎臟病患者內皮功能障礙的危險因素,并及時干預,可延緩或阻止病情進展,改善患者預后。本研究探討慢性腎臟病患者內皮功能障礙的影響因素。
1 臨床資料
1.1 基本資料 選取2014年1月~2016年12月南通大學第二附屬醫院收治的慢性腎臟病3~5期患者125例,其中男68例、女57例,年齡(52.5±14)歲,BMI 24.2±2.0,收縮壓(134±11)mmHg,舒張壓(84±6)mmHg,腎小球濾過率(GFR)為(26.7±6.0)mL/(min·1.73 m2),血肌酐(213±50.1)μmol/L,血尿酸(7.3±0.8)mg/dL,24 h尿蛋白定量(1 904±171)mg,高敏C反應蛋白(hs-CRP)(19.5±6.3)mg/dL,LDL(125.5±12)mg/dL。慢性腎臟病診斷標準:腎臟損傷或GFR<60 mL/(min·1.73 m2)持續3個月。國際腎臟病KDOQI指南[3]分期為3期[GFR 30~59 mL/(min·1.73 m2)]55例,4期[GFR>15~<30 mL/(min·1.73 m2)]45例,5期[GFR為≤15 mL/(min·1.73 m2)]25例。排除標準:年齡<20歲或>85歲;明確存在動脈粥樣硬化(如冠心病、充血性心力衰竭、外周血管疾病等)患者;腎病綜合征患者;透析患者;使用血管緊張素轉換酶抑制劑、血管緊張素受體阻滯劑、他汀類、葉酸、維生素B12、降糖、降尿酸等藥物治療患者;痛風和糖尿病患者;合并惡性腫瘤、急性感染等患者。患者入院后均行血管超聲檢查,血流介導的舒張功能(FMD)為4.2~8.3(6.4±0.9)%。以FMD中位數為界點,將患者分為FMD≥6.4%組和FMD<6.4%組。FMD≥6.4%組63例,男34例、女29例,年齡(50.6±16)歲,BMI 24.3±1.9,收縮壓(131±11)mmHg、舒張壓(82±5)mmHg;FMD<6.4%組62例,男34例、女28例,年齡(54.3±13)歲,BMI 24.1±2.1。
1.2 慢性腎臟病患者血管內皮功能障礙的影響因素分析 收集兩組臨床病理資料。統計學處理采用SPSS15.0統計軟件,計量資料以t檢驗、計數資料以χ2檢驗進行單因素分析,對有意義的指標進行多因素Logistic回歸分析。P<0.05為差異有統計學意義。
1.2.1 單因素分析 兩組年齡、性別、BMI、24 h尿蛋白、LDL比較差異均無統計學意義(P均>0.05);FMD<6.4%組收縮壓、舒張壓、hs-CRP、肌酐、尿酸水平均高于FMD≥6.4%組,GFR低于FMD≥6.4%組(P均<0.05)。見表1。

表1 兩組生化指標檢測結果
1.2.2 多因素分析 多因素Logistic回歸分析結果顯示,尿酸、GFR是慢性腎臟病患者發生內皮功能障礙的獨立影響因素(P均<0.05)。見表2。
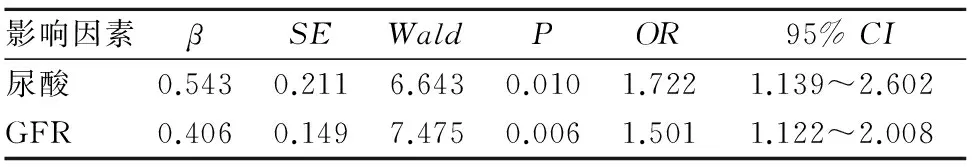
表2 影響FMD的多因素Logistic 回歸分析結果
2 討論
血管內皮功能障礙是動脈粥樣硬化、高血壓和心血管疾病發病過程中的早期觸發因素[4]。因氧化應激、炎癥反應、胰島素抵抗等均參與慢性腎臟病的發生、發展,亦是內皮功能障礙的主要原因;因此慢性腎臟病患者常合并血管內皮功能障礙。血管內皮功能檢測包括有創和無創方法,FMD是目前臨床評價內皮功能的最常用的無創方法。通過超聲測量肱動脈FMD,如內皮功能障礙則內皮倚賴的血管舒張功能下降,即FMD降低[5]。測量FMD過程中由于反應性血管充血,可引起剪切力刺激內皮細胞釋放血管擴張物質NO,因此,FMD亦可直接反映NO介導的血管舒張功能[6]。
本研究采用FMD反映血管內皮功能,單因素及多因素Logistic分析結果均顯示,尿酸、GFR是慢性腎臟病患者發生血管內皮功能障礙的影響因素。GFR是反映腎臟功能的作主要指標,GFR下降導致尿酸、非對稱二甲基精氨酸等物質殘留。非對稱二精氨酸被認為是一種循環尿毒癥毒素,可與精氨酸競爭內皮一氧化氮合酶[7];該酶缺乏可導致NO生成減少,血管內皮功能受損。
尿酸是機體嘌呤代謝的產物,可以反映黃嘌呤氧化酶活性。Weiner等[8]報道,尿酸可能在慢性腎臟病發展過程中發揮一定作用,尿酸水平升高可以預測慢性腎臟病,亦是1型糖尿病患者發生糖尿病腎病的預測因素之一[9]。降低尿酸水平可以延緩糖尿病和非糖尿病患者慢性腎臟病的發生、發展[10]。黃嘌呤氧化酶抑制劑降低尿酸可以改善非慢性腎臟病患者的腎功能,亦可延緩其腎功能惡化。有報道,別嘌呤醇可延緩慢性腎臟病 3期患者腎功能惡化并且減少心血管事件的發生[11];黃嘌呤抑制劑可降低充血性心力衰竭患者尿酸水平可改善血管內皮功能[12]。糖尿病患者適當降尿酸治療可以改善其血管內皮功能障礙,降低心血管并發癥的發生率[13]。黃嘌呤氧化酶可氧化黃嘌呤生成尿酸,亦可促進氧化劑生成。血尿酸水平升高提示黃嘌呤氧化酶活性增加,其促進氧化劑生成的作用增強,促發機體氧化應激反應,最終導致內皮功能障礙[12]。氧化應激導致NO生物利用度和活性下降,L-精氨酸缺乏和非對稱二甲基精氨酸(ADMA)介導的NO合成抑制均可導致內皮功能障礙。尿酸在細胞外環境中可以發揮抗氧化劑作用,其進入細胞后亦可通過促進內皮氧化直接誘導細胞功能障礙,導致內皮受損[14]。與促尿酸排泄藥物相比,別嘌呤醇對減少細胞內尿酸水平更有效,對細胞功能的改善也更加明顯。此外,尿酸水平升高亦可通過誘導細胞發生炎癥反應、胰島素抵抗等,造成內皮功能障礙,導致腎臟功能惡化[3,15]。尿酸增多可導致機體IL-1β產生和分泌增多,血中IL-1水平增高,觸發局部或全身炎癥反應。炎癥反應可損傷內皮細胞。高尿酸血癥可導致NO合成下降。NO是輔助胰島素促進細胞攝取葡萄糖的重要分子,因此,高尿酸狀態下可導致胰島素抵抗。尿酸引起的氧化應激亦可降低胰島素敏感性。胰島素抵抗通過影響脂肪代謝,導致游離脂肪酸增多,降低一氧化氮合酶活性,NO生產減少,且高胰島素水平亦可直接損傷血管內皮細胞。
綜上所述,尿酸、GFR是慢性腎臟病患者發生血管內皮功能障礙的獨立影響因素,臨床可通過提高GFR、降低尿酸等措施,抑制血管內皮功能障礙的發生、發展,進而改善患者預后。
[1] Mallat SG, Itani HS, Tanios BY. Current perspectives on combination therapy in the management of hypertension[J]. Integr Blood Press Control, 2013,17(6):69-78.
[2] Reddy YS, Kiranmayi VS, Bitla AR, et al. Nitric oxide status in patients with chronic kidney disease[J]. Indian J Nephrol, 2015,25(5):287-291
[3] National Kidney Foundation. KDOQI clinical practice guideline for diabetes and CKD: 2012 update[J]. Am J Kidney Dis, 2012,60(5):850-86.
[4] Verma S, Anderson TJ. Fundamentals of endothelial function for the clinical cardiologist[J]. Circulation, 2002,105(5):546-549.
[5] Ras RT, Streppel MT, Draijer R, et al. Flow-mediated dilation and cardiovascular risk prediction: a systematic review with metaanalysis[J]. Int J Cardiol, 2013,168(1):344-351.
[6] Pastori D, Loffredo L, Perri L, et al. Relation of nonalcoholic fatty liver disease and framingham risk score to flow-mediated dilation in patients with cardiometabolic risk factors[J]. Am J Cardiol, 2015,115(10):1402-1406.
[7] Baylis C. Arginine, arginine analogs and nitric oxide production in chronic kidney disease[J]. Nat Clin Pract Nephrol, 2006,2(4):209-220.
[8] Weiner DE, Tighiouart H, Elsayed EF, et al.Uric acid and incident kidney disease in the community[J]. J Am Soc Nephrol, 2008,19(6):1204-1211.
[9] Jalal DI, Rivard CJ, Johnson RJ, et al. Serum uric acid levels predict the development of albuminuria over 6 years in patients with type 1 diabetes: findings from the coronary artery calcification in type 1 diabetes study[J]. Nephrol Dial Transplant, 2010,25(6):1865-1869.
[10] Kosugi T, Nakayama T, Heinig M, et al. Effect of lowering uric acid on renal disease in the type 2 diabetic db/db mice[J]. Am J Physiol, 2009,297(2):F481-F488.
[11] Goicoechea M, de Vinuesa SG, Verdalles U, et al. Effect of allopurinol in chronic kidney disease progression and cardiovascular risk[J]. Clin J Am Soc Nephrol, 2010,5(8):1388-1393.
[12] Rajendra NS, Ireland S, George J, et al. Mechanistic insights into the therapeutic use of high-dose allopurinol in angina pectoris[J]. J Am Coll Cardiol, 2011,58(8):820-828.
[13] Waring WS, McKnight JA, Webb DJ, et al. Uric acid restores endothelial function in patients with type 1 diabetes and regular smokers[J]. Diabetes, 2006,55(11):3127-3132.
[14] Sanchez-Lozada LG, Soto V, Tapia E, et al.Role of oxidative stress in the renal abnormalities induced by experimental hyperuricemia[J]. Am J Physiol, 2008,295(4):F1134-F1141.
[15] Sanchez-Lozada LG, Lanaspa MA, Cristobal-Garca M, et al. Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J]. Nephron Exp Nephrol, 2012,121(3-4):e71-78.
南通市衛生和計劃生育委員會科研項目(WQ2016024)。
10.3969/j.issn.1002-266X.2017.40.025
R692
B
1002-266X(2017)40-0077-03
2017-06-02)

