不同養殖場家蠅成蟲體表攜帶細菌的分離與鑒定
,,,, , ,,2, ,2
·論著·
不同養殖場家蠅成蟲體表攜帶細菌的分離與鑒定
陳丹1,莊桂芬1,黃振東1,薛志靜1,劉婧1,李妍1,張瑞玲1,2,張忠1,2
目的研究不同養殖場內家蠅成蟲體表攜帶細菌數量和類別。方法采用網捕法對不同養殖場的家蠅進行采樣,利用振蕩洗脫法分離其體表細菌,對獲得細菌的16S rDNA基因擴增后進行分離分子鑒定。結果不同養殖場內家蠅密度、體表攜帶細菌數量和種類有統計學差異,且家蠅密度與體表攜帶細菌數量和攜帶的細菌屬數呈線性相關關系。在養殖場內分離到的家蠅體表攜帶細菌中,葡萄球菌屬、克雷伯氏菌屬、埃希菌屬、沙雷氏菌屬分布較廣,同時分離的細菌中多為條件致病菌,存在疾病傳播風險。結論養殖場家蠅密度反映出養殖場的整體管理水平;養殖場孳生的家蠅可機械性攜帶條件致病菌,存在將細菌傳播給人類的風險,需要進一步加強對養殖場蠅類防控及攜帶細菌的監控。
家蠅;養殖場;體表細菌;機會致病細菌;蠅傳疾病
家蠅是重要的醫學媒介生物,為世界性分布的昆蟲,且食性廣泛,活動能力強,特別喜歡孳生于居民區、養殖場、食品加工廠、垃圾處理場等場所,不僅會對人產生視覺污染,而且可以傳播疾病,影響畜牧業健康生產,可將病原菌從重度污染的區域帶向居民區,造成疾病的發生與流行。
蠅類傳播疾病通常分為機械傳播和生物傳播,其中以機械性傳播為主,可傳播包括細菌、原生動物、病毒、寄生蟲卵囊和卵等30多種病原體[1-8]。蠅類對病原體的機械性傳播主要通過糞口傳播途徑和體表攜帶兩種途徑,這主要與蠅類體表布滿鬃毛,爪墊上有纖毛等結構有關;同時,蠅類在取食時邊吃、邊吐、邊排便的攝食習性,增加了其攜帶的病原體污染水、食物、用具等物體表面的機會,從而造成人類的感染[9-10]。
目前,家蠅是養殖場重點防控的媒介生物,特別是在一些養殖條件較差的小型養殖場和散戶型養殖場,家蠅孳生非常嚴重,并影響周邊居民的正常生活。由于家蠅在養殖場、周邊住戶、養殖戶等生態環境之間不斷竄擾,有將體表攜帶病原體傳給人類的風險。因此,需要加強對蠅類體表攜帶病原體的檢測研究,為蠅類傳播的疾病提供風險評估,并制定合理的防控預案。
1 材料與方法
1.1采樣地點 采樣地點位于山東省泰安市岱岳區和濟南市平陰縣,共包括9個養殖場的10個采樣點。分別為:泰安市岱岳區朱康村豬舍(東經116.9°,北緯36.2°)、泰安市岱岳區高莊村豬舍(東經116.9°,北緯36.2°)、濟南市平陰縣綠環托佩克種豬場(東經116.4°,北緯36.3°)、泰安市岱岳區魚東村奶牛場(東經116.9°,北緯36.2°)、泰安市岱岳區同和奶牛養殖專業合作社糧倉和犢牛舍(東經117.4°,北緯36.2°)、泰安市岱岳區西孫村奶牛場(東經116.9°,北緯36.2°)、泰安市岱岳區西孫村養雞場(東經116.9°,北緯36.2°)、泰安市岱岳區西孫村養鴨場(東經116.9°,北緯36.2°)和泰安市岱岳區魚池村鴨場(東經116.9°,北緯36.2°)。
1.2蠅類的采集方法 蠅類的采集采用網捕法,在養殖場蠅類成蟲聚集處隨機掃3網,將網捕到的蒼蠅經乙醚麻醉后分裝到10 mL離心管中,采集所用器材均經無菌處理。回實驗室后,將各種蠅類進行分類鑒定,將鑒定出的家蠅進行體表細菌的分離與鑒定。
1.3蠅類體表細菌的分離方法 家蠅體表攜帶細菌的分離方法采用振蕩洗脫法。將家蠅樣品按采集地點各取10頭家蠅分別置于50 mL離心管中,再加入20 mL無菌水和10 μL吐溫80,震蕩洗脫3~5 min。取體表洗脫液稀釋50倍后,各取100 μL,涂板,24 h后,計數各平板中菌落數量。培養2 d后,挑取形態不同的菌落三區劃線法接種到新的牛肉膏蛋白胨固體培養基上進行分離純化,直至分離到單一的菌落。
1.4蠅類體表攜帶細菌的鑒定 將分離到的單菌落置于LB液體培養基內搖菌過夜,然后采用CTAB法提取各細菌DNA,并對16S rDNA的V3高變區進行PCR擴增,取陽性PCR產物送北京華大基因公司進行序列測定。將測序結果所測序列提交到GenBank中進行序列對比,從GenBank數據庫中獲得有關種的公認標準序列數據,取相似度最高的為鑒定結果,相似率gt; 99% 視為同種,95%~99%則為同一屬,lt;95% 則認為同一科。一般均可鑒定到屬。
2 結 果
2.1不同養殖場家蠅的密度 不同養殖場采集到的家蠅數量有統計學差異(F=56.41,P=0.0001),其中,以開放式奶牛養殖場采集到的家蠅最多,泰安市岱岳區魚東村奶牛場和西孫村奶牛場家蠅密度平均為88.3頭/網和89.3頭/網,其次是養雞場和養鴨場,平均約為75頭/網,而管理水平較高的同和奶牛養殖合作社內,在糧倉和犢牛舍內家蠅密度分別為33頭/網和41頭/網。對于3家養豬場來說,由于管理水平不同,家蠅數量也有較大差異,其中做到了糞便當日清理的泰安市岱岳區高莊村豬舍,家蠅密度較低,平均為24頭/網;而在濟南綠環托佩克種豬場,僅養殖種豬用于品種改良和配種,養殖數量較少,管理水平較高,因此家蠅密度最低,約為18.7頭/網;相反管理比較粗放的泰安市岱岳區朱康村豬舍中,家蠅密度較高,約為44.7頭/網(圖1)。
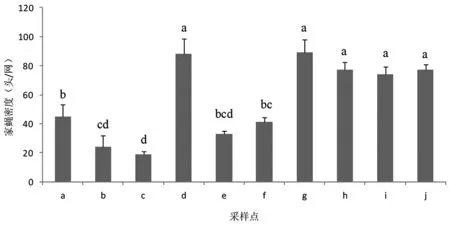
注:各字母代表的養殖場如下所示,下同。a:泰安市岱岳區朱康村豬舍f:泰安市岱岳區同和奶牛養殖專業合作社犢牛舍b:泰安市岱岳區高莊村豬舍g:泰安市岱岳區西孫村奶牛場c:濟南綠環托佩克種豬場h:泰安市岱岳區西孫村養雞場d:泰安市岱岳區魚東村奶牛場i:泰安市岱岳區西孫村養鴨場e:泰安市岱岳區同和奶牛養殖專業合作社糧倉j:泰安市岱岳區魚池村鴨場圖1 不同養殖場家蠅的密度(頭/網)Fig.1 Population density of Musca domestica in different livestock farms
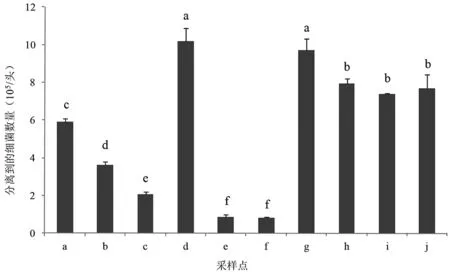
圖2 不同養殖場家蠅體表分離到的細菌數量(105/頭)Fig.2 Number of bacteria isolated from body surface of Musca domestica in different livestock farms
2.2不同養殖場家蠅體表攜帶細菌數量 不同養殖場家蠅體表攜帶細菌數量有統計學差異(F=248.95,P=0.0001),其中以開放式奶牛養殖場家蠅體表攜帶細菌數量最高(泰安市岱岳區魚東村奶牛場和泰安市岱岳區西孫村奶牛場),捕獲的家蠅體表攜帶細菌數量平均約為1×106個/頭,而管理水平較高的同和奶牛養殖合作社內,在糧倉和犢牛舍內捕獲的家蠅體表攜帶細菌數量平均約為8×104個/頭。對養豬場來說,濟南綠環托佩克種豬場內家蠅體表攜帶細菌數量最低,平均約為2×105個/頭,而管理水平較低的高莊村豬舍中家蠅體表攜帶細菌量最高,平均約為6×105個/頭。3個禽類養殖場家蠅體表攜帶細菌數量相近,平均約為7×105個/頭(圖2)。
2.3不同養殖場家蠅體表攜帶細菌的種類 不同養殖場家蠅體表攜帶細菌的種類也有區別。其中在3個養豬場分離到細菌13屬,在4個奶牛場分離到細菌27屬,1個養雞場分離到8屬,2個養鴨場分離到15屬。
就分離到的細菌來說,葡萄球菌屬、克雷伯氏菌屬、埃希菌屬、沙雷氏菌屬為養殖場家蠅體表廣泛存在細菌,在本研究的5-7個養殖場內的家蠅體表均分離到。芽孢桿菌屬、變形桿菌屬、香味菌屬分布也比較廣,在調查的4個養殖場內的家蠅體表分離到。而不動桿菌屬、鏈霉菌屬、拉烏爾菌屬、檸檬酸桿菌屬、產堿桿菌屬、鞘氨醇桿菌屬、果膠桿菌屬、泛菌屬、短狀桿菌屬、志賀氏菌屬、固氮螺菌屬、寡養單胞菌屬和微桿菌屬等13屬細菌分布較窄,僅在1個養殖場蠅類體表分離到。其它細菌可在2-3個養殖場內的家蠅體表分離到(表1)。
在分離到的細菌中,革蘭氏染色陰性菌有19屬,占73%;革蘭氏染色陽性細菌7屬,占27%,分別為葡萄球菌屬、芽孢桿菌屬、魏斯氏菌屬、腸球菌屬、鏈霉菌屬、短狀桿菌屬和微桿菌屬。養殖場家蠅體表分離到的細菌中,多數為條件致病菌,對從業人員和周圍人群存在一定的威脅。
2.4不同養殖場家蠅數量與其體表攜帶細菌數量和細菌屬數的關系 養殖場家蠅數量與其體表攜帶細菌數量及細菌屬數均成線性相關關系(圖3)。說明養殖場管理水平越高,家蠅的密度越低,家蠅體表攜帶細菌的數量和種類越少,因此可以由養殖場孳生家蠅的數量反映出養殖場的整體管理水平。
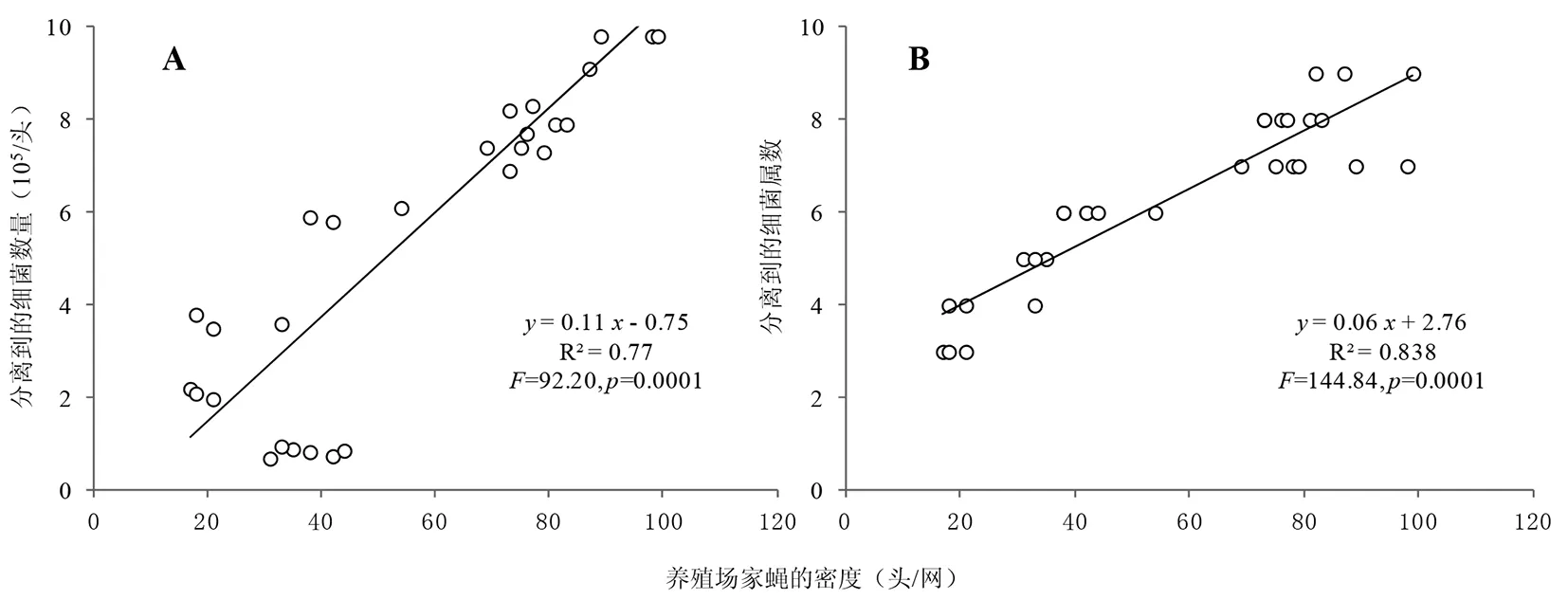
圖3 不同養殖場家蠅密度與家蠅體表分離到細菌數量(A)和菌屬數(B)的相關性Fig.3 Correlations of Musca domestica adults’ population density with the isolated bacteria numbers (A) and the number of isolated bacteria genus (B)
表1 不同養殖場家蠅體表攜帶細菌種類
Tab.1 Genus of bacteria isolated from body surface of Musca domestica in different livestock farms
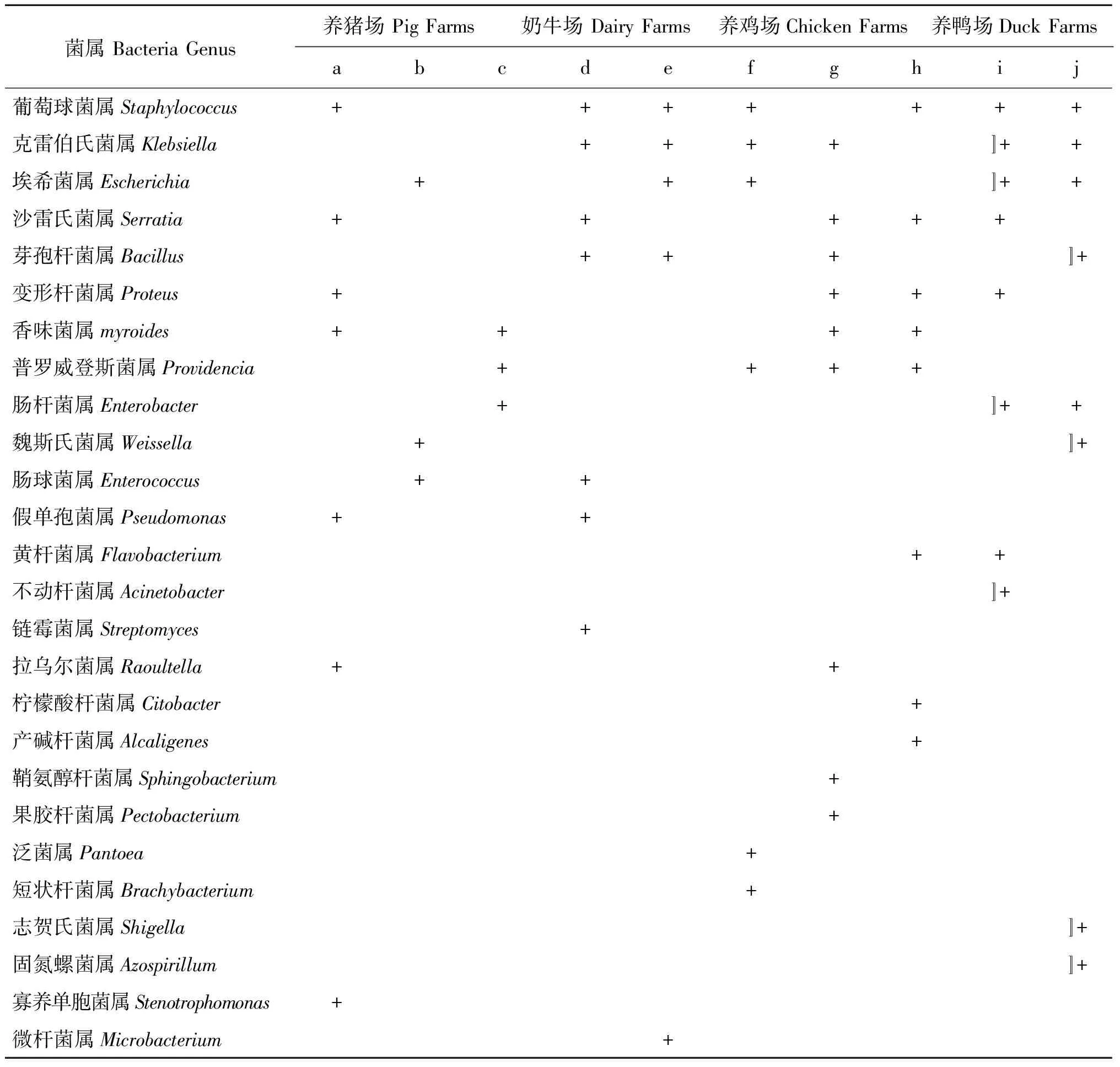
菌屬BacteriaGenus養豬場PigFarms奶牛場DairyFarms養雞場ChickenFarms養鴨場DuckFarmsabcdefghij葡萄球菌屬Staphylococcus+++++++克雷伯氏菌屬Klebsiella++++?++埃希菌屬Escherichia+++?++沙雷氏菌屬Serratia+++++芽孢桿菌屬Bacillus+++?+變形桿菌屬Proteus++++香味菌屬myroides++++普羅威登斯菌屬Providencia++++腸桿菌屬Enterobacter+?++魏斯氏菌屬Weissella+?+腸球菌屬Enterococcus++假單孢菌屬Pseudomonas++黃桿菌屬Flavobacterium++不動桿菌屬Acinetobacter?+鏈霉菌屬Streptomyces+拉烏爾菌屬Raoultella++檸檬酸桿菌屬Citobacter+產堿桿菌屬Alcaligenes+鞘氨醇桿菌屬Sphingobacterium+果膠桿菌屬Pectobacterium+泛菌屬Pantoea+短狀桿菌屬Brachybacterium+志賀氏菌屬Shigella?+固氮螺菌屬Azospirillum?+寡養單胞菌屬Stenotrophomonas+微桿菌屬Microbacterium+
3 討 論
家蠅是養殖場孳生的最常見蠅類,國內外對養殖場家蠅的研究,多集中于對蠅類的控制,而對不同養殖場家蠅體表攜帶病原體的研究尚少[11]。
由于家蠅主要孳生于養殖場的禽畜糞便、飼料殘渣、動物尸體等養殖廢棄物上。養殖場家蠅的密度受到廢棄物處理狀況的影響,在廢棄物處理較好的養殖場內,家蠅的密度顯著低于管理粗放的養殖場。如在本研究中魚東村奶牛場和西孫村奶牛場為完全開放式養殖,養殖場內存在多個養殖戶,養殖廢棄物亂堆亂棄現象嚴重,家蠅密度較高;而在養殖規范程度較高的同和奶牛養殖合作社,養殖環境為封閉式,養殖廢棄物嚴格日清,成年奶牛舍、犢牛舍、糧草倉、廢棄物處理區等均進行嚴格隔離,且定期進行蠅類防治,家蠅密度則較低。在養豬場,家蠅的密度也受到養殖場管理水平的影響,在養殖粗放的朱康村養殖場,養殖環境較差,廢棄物、污水較多,孳生的家蠅也較多;而在附近的高莊村養殖場,管理水平較高,廢棄物處理較好,養豬場內比較整潔,因此家蠅孳生數量較少;在濟南綠環托佩克種豬場,由于養殖數量較少,與周邊存在樹林等隔離帶,且經常進行防治,因此家蠅的數量相對較低。在禽類養殖場,雖然均為封閉式養殖,但由于養殖廢棄物處理不及時,飼料存在堆放現象,且產生糞便中的蛋白等營養物質含量相對豐富,更適合家蠅等蠅類的孳生。
本研究結果表明,養殖場家蠅的密度與其體表攜帶細菌數量和種類呈線性相關關系,因此養殖場家蠅的密度在一定程度上反映出養殖場的整體管理水平。養殖場內家蠅主要孳生于養殖廢棄物(包括糞便、飼料殘渣等),其中存在的大量細菌及其它病原體,家蠅在孳生過程中,粘附于體表,通過家蠅飛行攜帶到其它區域,造成病原體的傳播。
家蠅體表攜帶的細菌多為機會性致病細菌,如Butler等[12]在野生家蠅體表分離到了鮑曼不動桿菌(Acinetobacterbaumanni)、蠟樣芽孢桿菌(Bacilluscereus)、短小芽孢桿菌(Bacilluspumilus)、蘇云金桿菌(Bacillusthuringiensis)、阪崎腸桿菌(Cronobactersakazakii)、大腸埃希菌(EscherichiacoliO157:H7)、甲基桿菌(Methylobacteriumpersicinum)、痢疾志賀菌(Shigelladysenteriae)、腐生葡萄球菌(Staphylococcussaprophyticus)和木糖葡萄球菌(Staphylococcusxylosus)等細菌。當蠅類得到有效控制的時候,腹瀉病和志賀氏菌病發生率可下降42%和85%[13],兒童的腹瀉比例可下降23%[14]。Shane[15]等研究表明,家蠅還可傳播引起急性腸道傳染病的空腸彎曲菌。在英國,空腸彎曲菌引起腹瀉的發生與蠅類的密度密切相關,靠近養殖場或動物活動區居民感染彎曲桿菌的比例較高,而在衛生條件較好的城市,感染率則較低[11]。
本研究中,在養殖場家蠅體表分離到的細菌中存在條件致病菌,多數來自養殖廢棄物,而通過家蠅傳播有污染鮮牛奶、禽蛋等食品中的風險,影響食品安全。另外,養殖場的從業人員以婦女和老年人為主,在散戶型養殖場內,養殖區與居住區的分隔不明顯,因此,家蠅體表攜帶的條件致病菌傳播給從業人員和居住區的老人、兒童的風險更高,需要引起足夠的重視。在國家倡導健康養殖的主題下,養殖場內醫學媒介生物的無害化控制也應作為重要課題,以減少養殖場內病原細菌通過蠅類在內部傳播或擴散到周邊,引起疾病的發生和流行。
[1] Tan SW, Yap KL, Lee HL. Mechanical transport of rotavirus by the legs and wings ofMuscadomestica(Diptera: Muscidae) [J]. J Med Entomol, 1997, 34(5): 527-531. DOI:10.1093/jmedent/34.5.527
[2] Greenberg B. Flies and disease: Vol. II[M]. Princeton: Princeton University Press, 1973.
[3] Bidawid SP, Edeson JF, Ibrahim J, et al. The role of non-biting flies in the transmission of enteric pathogens (Salmonellaspecies andShigellaspecies) in Beirut, Lebanon[J]. Ann Trop Med Parasitol, 1978, 72(2): 117-121.DOI:10.1080/0034983.1978.11719291
[4] Fotedar R, Banerjee U, Singh S, et al. The housefly (Muscadomestica) as a carrier of pathogenic microorganisms in a hospital environment [J]. J Hosp Infect, 1992, 20(3): 209-215.DOI:10.1016/0195-6701(84)90015-x
[5] Iwasa M, Makino S, Asakura H, et al. Detection ofEscherichiacoliO157:H7 fromMuscadomestica(Diptera: Muscidae) at a cattle farm in Japan [J]. J Med Entomol, 1999, 36(1): 108-112. DOI:10.1093/jmedent/36.1.108
[6] Kobayashi M, Sasaki T, Saito N, et al. Houseflies: not simple mechanical vectors of enterohemorrhagicEscherichiacoliO157:H7 [J]. Am J Trop Med Hyg, 1999, 61(4): 625-629.DOI:10.4269/ajtmh.1999.61.625
[7] Wales AD, Carrique-Mas JJ, Rankin M, et al. Review of the carriage of zoonotic bacteria by arthropods, with special reference to Salmonella in mites, flies and litter beetles [J]. Zoonoses Pub Health, 2010, 57(5): 299-314. DOI:10.1111/j.1863-2378.2008.01222.x
[8] Chen JM, Li YL, Gao SW, et al. Research to biological diversity and carries the pathogenic microorganisms of flies at Mawei Port[J]. J Inspect and Quarant, 2009, 19 (6): 21-27. (in Chinese)
陳佳木, 李亞倫, 高思維, 等. 馬尾口岸蠅類生物多樣性和攜帶病原微生物情況的研究[J]. 檢驗檢疫學刊, 2009, 19(6): 21-27.
[9] Olsen AR. Regulatory action criteria for filth and other extraneous materials III. Review of flies and foodborne enteric disease [J]. Regul Toxicol Pharmacol, 1998, 28(3): 199-211.DOI:10.1006/rtph.1998.1271
[10] De Jesus AJ, Olsen AR, Bryce JR, et al. Quantitative contamination and transfer ofEscherichiacolifrom foods by houseflies,MuscadomesticaL. (Diptera: Muscidae) [J]. Int J Food Microbiol, 2004, 93(2): 259-262. DOI:10.1016/j.ijfoudmicro.2003.12.003
[11] Nichols GL. Fly transmission ofCampylobacter[J]. Emerg Infect Dis, 2005, 11(3): 361-364. DOI:10.3201/eid.1103.040460
[12] Butler JF, Garcia-Maruniak A, Meek F, et al. Wild Florida house flies (Muscadomestica) as carriers of pathogenic bacteria [J]. Florida Entomol, 2010, 93(2): 218-223. DOI:10.1653/024.093.0211
[13] Cohen D, Green M, Block C, et al. Reduction of transmission of shigellosis by control of houseflies (Muscadomestica) [J]. Lancet, 1991, 337(8748): 993-997.DOI:10.1016/0140-6736(91)92657-N
[14] Chavasse DC, Shier RP, Murphy OA, et al. Impact of fly control on childhood diarrhoea in Pakistan: community randomised trial [J]. Lancet, 1999, 353(9146): 22-25.DOI:10.1016/S0140-6736(98)03366-2
[15] Shane SM, Montrose MS, Harrington KS. Transmission ofCampylobacterjejuniby the house fly (Muscadomestica) [J]. Avian Dis, 1985, 29(2): 384-391.DOI:10.2307/1590499
BacteriaonbodysurfaceofMuscadomesticaadultsfromdifferentlivestockfarms
CHEN Dan1, ZHUANG Gui-fen1, HUANG Zhen-dong1, XUE Zhi-jing1, LIU Jing1, LI Yan1, ZHANG Rui-ling1,2, ZHANG Zhong1,2
(1.CollaborativeInnovationCenterfortheOriginandControlofEmergingInfectiousDiseases,TaishanMedicalUniversity,Tai’an271016,China; 2.DepartmentofPathogenicBiology,TaishanMedicalUniversity,Tai’an271016,China)
This study aims to isolate and identify the bacteria from the surface ofMuscadomesticaadults in different livestock farms. The adults ofMuscadomesticawere collected with sweep nets, then the surface of adult flies were washed with sterile water,and the eluted bacteria cultured with LB culture medium. The DNA of the bacteria isolated was extracted, 16SrDNA fragment was amplified through general PCR, and the 16SrDNA sequence was blasted with bacteria sequence in NCBI. Results showed that the number ofMuscadomesticaadults and the bacteria from their surface had significant different in different livestock farms. The population density ofMuscadomesticaadults had linear correlation with the number of bacteria fromMuscadomesticaadults and the number of bacteria genus. Among the bacteria isolated fromMuscadomesticaadults,Staphylococcus,Klebsiella,EscherichiaandSerratiawere the most common genus in the livestock farms. Most of the bacteria isolated from livestock farm house flies were opportunistic human bacterial pathogen, and the risk of bacterial pathogens spread to people was existed. The population density of house flies reflected the management level of different livestock farms. The house flies could mechanical transmit opportunistic human bacterial pathogen from livestock residue to human. So the house flies control and the monitoring of bacteria on body surface of house flies carried should be strengthened.
Muscadomestica; livestock farms; bacteria on the body surface of house flies; opportunistic bacteria; fly borne diseases
Zhang Zhong, Email: nasonia@163.com
10.3969/j.issn.1002-2694.2017.11.001
國家自然科學基金(Nos.81401693,81572028,81271874)和山東省科技發展計劃項目(No.2014GSF121007)聯合資助
張 忠,Email: nasonia@163.com
1.泰山醫學院新發傳染病溯源及防控協同創新中心,泰安 271016; 2.泰山醫學院基礎醫學院,泰安 271016
R384
A
1002-2694(2017)11-0951-05
Supported by the National Natural Science Foundation of China (Nos. 81401693, 81572028 and 81271874), the Science and Technology Development Projects of Shandong Province (No. 2014GSF121007)
2016-09-08編輯王曉歡

