高考電化學解題方法突破
北京 李宏華
高考電化學解題方法突破

電化學知識是歷年高考命題必考的考點,這部分知識比較獨立,與其他知識的關聯比較少,因此希望考生對這部分知識要熟練掌握。高考命題主要以原電池的工作原理、化學電源、電解原理以及應用、電解計算和化學腐蝕等角度進行命題。
一、原電池的工作原理
原電池工作原理中四個常見失分點的規避
(1)只有放熱的氧化還原反應才能通過設計成原電池將化學能轉化為電能。
(2)電解質溶液中陰、陽離子的定向移動,與導線中電子的定向移動共同組成了一個完整的閉合回路。
(3)無論在原電池中還是在電解池中,電子均不能通過電解質溶液。
(4)原電池的負極失去電子的總數等于正極得到電子的總數。
【例1】下圖是某校實驗小組設計的一套原電池裝置,下列有關描述不正確的是
( )
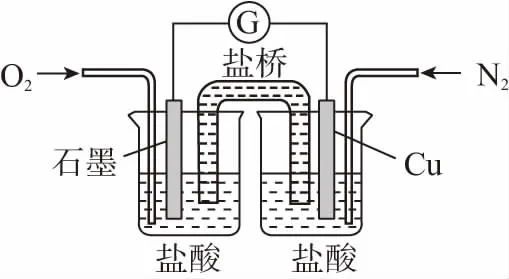

B.此裝置能將化學能轉變為電能
C.電子由Cu電極經導線流向石墨電極


【答案】A
二、原電池原理的應用——化學電源
1.易錯探究
(1)原電池反應中,電極材料本身一定發生反應嗎?
【提示】不一定。如燃料電池,電極是鉑電極,本身不參與反應,參與反應的是H2和O2。
(2)可充電電池充電時電極與外接電源的正負極如何連接?
【提示】應將可充電電池的負極接外電源的負極,正極接外電源的正極。
(3)依據鉛蓄電池充、放電原理,說明在放電時電解液中H2SO4的濃度將如何改變?

(4)氫氧燃料電池以KOH溶液作電解質溶液時,工作一段時間后,電解質溶液的濃度如何變化?溶液的pH如何變化?當氫氧燃料電池以H2SO4溶液作電解質溶液時,又會如何變化?

2.“加減法”書寫電極反應式
(1)先確定原電池的正負極,列出正負極上的反應物質,并標出相同數目電子的得失。
(2)根據氧化還原反應原理寫出電極反應式。
①負極反應
負極失去電子發生氧化反應。注意負極反應生成的陽離子與電解質溶液中的陰離子是否共存。若不共存,則該電解質溶液中的陰離子應寫入負極反應式。
②正極反應

(3)寫出電池總反應方程式。
結合電子守恒將正負極電極反應式相加即得到電池總反應方程式。
(4)若已知電池反應的總反應式,可先寫出較易書寫的一極的電極反應式,然后在電子守恒的基礎上,總反應式減去較易寫出的一極的電極反應式,即得到較難寫出的另一極的電極反應式。
3.“3步”突破燃料電池電極反應式的書寫
第一步:寫出電池的總反應式。
燃料電池的總反應與燃料的燃燒反應一致,若產物能和電解質反應則總反應為加和后的反應。
如甲烷燃料電池(電解質為NaOH溶液)的反應式為



第二步:寫出電池的正極反應式。
根據燃料電池的特點,一般在正極上發生還原反應的物質是O2,隨著電解質溶液的不同,其電極反應式有所不同,大致有以下四種情況:
(1)酸性電解質溶液環境下電極反應式:



(4)熔融碳酸鹽(如熔融K2CO3)環境下電極反應式:

第三步:根據電池總反應式和正極反應式,寫出負極反應式。
電池反應的總反應式-電池正極反應式=電池負極反應式。因為O2不是負極反應物,因此兩個反應式相減時要徹底消除O2。
【例2】交通運輸部在南海華陽礁舉行華陽燈塔和赤燈塔竣工發光儀式,宣布兩座大型多功能燈塔正式發光并投入使用。燈塔可用鎂海水電池提供能源,其裝置如圖所示。下列有關海水電池的說法正確的是
( )
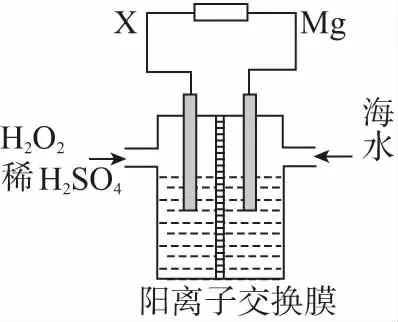
A.X可為鐵、銅、石墨等電極
11月2日,在第七屆綠色農藥博覽會開幕式上,農業農村部農藥檢定所黨委書記吳國強在致辭中說:“落實中央綠色發展的總體部署和發展綠色農業的要求,農藥行業責任重大,必須順應時代潮流,積極研發、生產、宣傳、推廣高效、低毒、低殘留的環境友好型農藥和施藥機械,大力發展綠色農藥。”
B.每轉移2 mol電子,2 mol H+由交換膜左側向右側遷移

D.該電池能將化學能全部轉化成電能

【答案】C
【方法點撥】電極類型的判斷要在明確屬于電解池還是原電池基礎上來分析的,原電池對應的是正、負兩極,電解池對應的是陰、陽兩極,根據元素價態變化找出氧化劑與還原產物即可解答。該海水電池的負極材料是金屬鎂,發生失電子的氧化反應,正極材料的金屬活潑性比金屬鎂差,該電極上發生得電子的還原反應,原電池是將化學能轉化為電能的裝置。
三、電解原理
1.易錯探究
(1)電解時電子通過電解質溶液嗎?
【提示】電解質溶液通電電解時,在外電路中有電流(電子)通過,而溶液中是依靠離子定向移動,形成了閉合電路。
(2)電解過程中放H2生堿型和放O2生酸型的實質是什么?
【提示】放H2生堿型的實質是水電離出的H+放電,破壞了水的電離平衡,使OH-濃度增大,放O2生酸型的實質是水電離出的OH-放電,破壞了水的電離平衡,使H+濃度增大。
(3)①要使用惰性電極電解后的NaCl溶液復原,滴加鹽酸可以嗎?
②要使用惰性電極電解后的CuSO4溶液復原,加入Cu(OH)2固體可以嗎?
【提示】電解質溶液的復原應遵循“從溶液中析出什么補什么”的原則,即從溶液中析出哪種元素的原子,則應按比例補入哪些原子。
①電解NaCl溶液時析出的是等物質的量的Cl2和H2,所以應通入氯化氫氣體,加入鹽酸會引入過多的水。
②同理,使CuSO4溶液復原應加入CuO或CuCO3,而加入Cu(OH)2會使溶液的濃度降低。
2.電解池中方程式書寫四個常見失分點的規避
(1)書寫電解池中電極反應式時,要以實際放電的離子表示,但書寫總電解反應方程式時,弱電解質要寫成分子式。
(2)陰極不管是什么材料,電極本身都不反應,一定是溶液(或熔融電解質)中的陽離子放電。
(3)要確保兩極電子轉移數目相同,且注明條件“電解”。
(4)電解物質的水溶液時,應注意放電順序中H+、OH-之后的離子一般不參與放電。
【例3】利用如圖所示裝置(電極均為惰性電極)可吸收SO2,并用陰極排出的溶液吸收NO2,下列說法正確的是
( )
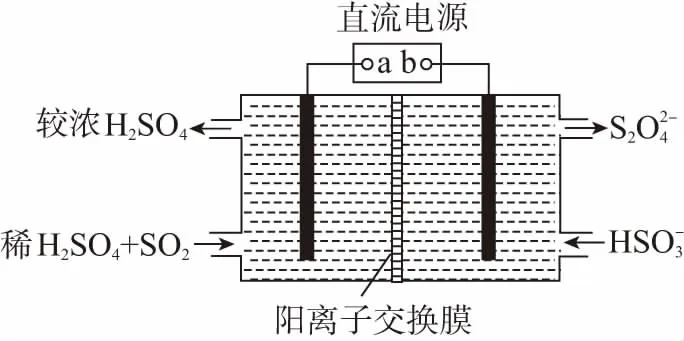
A.a為直流電源的負極

D.電解時,H+由陰極室通過陽離子交換膜進入陽極室
【答案】C
四、電解原理的應用
1.電解精煉銅時,陽極泥是怎樣形成的?
【提示】粗銅中往往含有鋅、鐵、鎳、銀、金等多種金屬雜質,當含雜質的銅在陽極不斷溶解時,金屬活動性位于銅之前的金屬雜質,如Zn、Fe、Ni等也會同時失去電子。金屬活動性位于銅之后的銀、金等雜質,因為失去電子的能力比銅弱,難以在陽極失去電子變成陽離子而溶解,所以當陽極的銅等失去電子變成陽離子溶解之后,銀、金等雜質以金屬單質的形式沉積在電解槽底部,形成陽極泥。
2.比較下列兩種裝置有哪些不同?
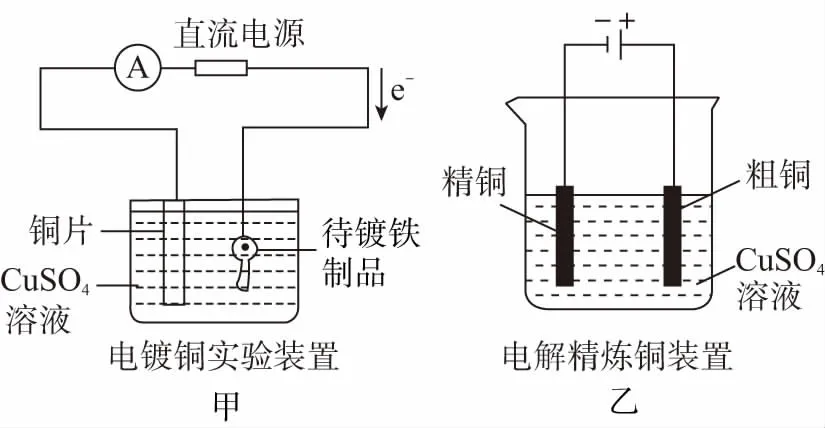
(1)請分析兩裝置中各電極的質量變化。
(2)請分析兩裝置中電解質溶液濃度的變化。
【提示】(1)甲圖中銅片質量減小,鐵制品質量增加;乙圖中粗銅質量減小,精銅質量增加。
(2)甲圖中CuSO4溶液濃度幾乎未變化,因為陽極溶解多少銅,陰極增加多少銅;乙圖中CuSO4溶液濃度逐漸變小,因為粗銅中混有Zn、Fe等雜質,放電后轉化成Zn2+、Fe2+等離子,此時Cu2+會轉化為Cu,造成CuSO4溶液濃度減小。
【例4】水銀法電解食鹽水是氯堿工業發展進程中的重要里程碑,以制得堿液純度高、質量好而著稱,其生產原理示意圖如下。下列說法不正確的是
( )
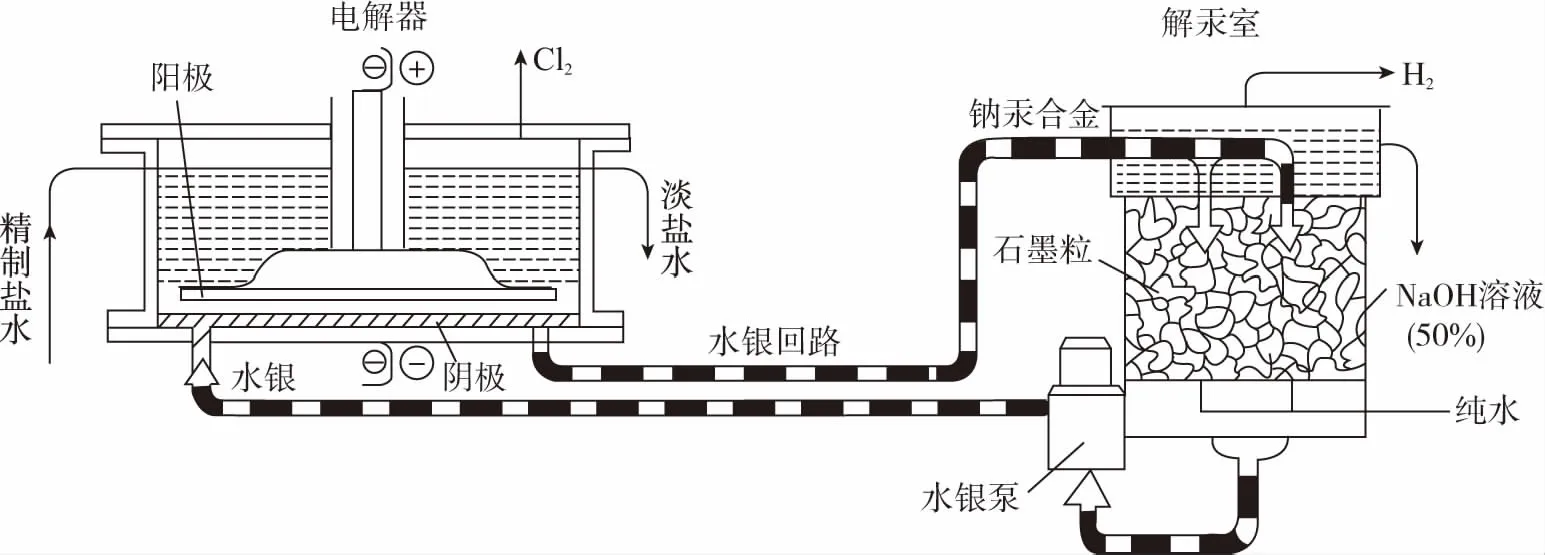

B.解汞室中產生氫氣的電極為陰極
C.當陽極產生3.36L(標準狀況)氣體時,解汞室中生成NaOH的質量為12g
D.在直流電作用下,電解器中的Na+變成金屬鈉,與水銀形成鈉汞合金,從而與Cl2分開

【答案】D
五、電解的計算
電化學的綜合計算包括:兩極產物的定量計算、溶液pH的計算、相對原子質量和阿伏加德羅常數測定的計算、根據電荷量求產物的量、根據產物的量求電荷量等。
【例5】如圖裝置中X和Y均為石墨電極,電解液為500 mL某藍色溶液,電解一段時間,觀察到X電極表面有紅色的固態物質生成,Y電極有無色氣體生成;溶液中原有溶質完全電解后,停止電解,取出X電極,洗滌、干燥、稱量,電極增重1.6 g。下列有關說法中錯誤的是
( )
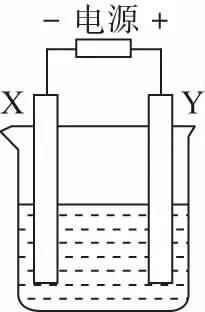
A.X電極是陰極
B.Y電極產生氣體的體積為0.224 L
C.電解后溶液的pH=1
D.要使電解后溶液恢復到電解前的狀態,需加入一定量的CuO或CuCO3

北京市順義區第八中學)

