“特色”試題分析研究
浙江 應化德
“特色”試題分析研究

浙江省2009年實施新高考以來,出現(xiàn)了一類極具浙江特色的試題,如2010年第25題,可以說是一個標桿題,它的思想一直影響至今的選考,研究它非常有意義。該試題的情景體現(xiàn)化學學科的社會價值,汽車安全氣囊工作原理知識,考查的內容體現(xiàn)化學的學科思想,利用定性定量相結合的物質推斷與實驗方案設計的思想、從不同角度分析問題的小綜合思想,考查元素化合物知識的氧化還原反應方程式的規(guī)范書寫及其他化學表示方法等。此題能力要求高、區(qū)分度好,考查學生的自主學習能力、信息運用能力、遷移對比能力、計量能力和化學語言表達能力等。當試題命題者命出好題時,出題的思想,出題的意圖,就會傳承下來,形成浙江特色,高考試題的改編及編寫思路就有一條脈絡可尋。那么教師、學生該怎么做呢?下面就該試題分析、解讀,將解題方法、核心思維和應對策略作一闡述。
高考真題【2010年第25題】(14分)汽車安全氣囊是行車安全的重要保障。當車輛發(fā)生碰撞的瞬間,安全裝置通電點火使其中的固體粉末分解釋放出大量的氮氣形成氣囊,從而保護司機及乘客免受傷害。為研究安全氣囊工作的化學原理,取安全裝置中的粉末進行實驗。經(jīng)組成分析,確定該粉末僅含Na、Fe、N、O四種元素。水溶性試驗表明,固體粉末部分溶解。經(jīng)檢測,可溶物為化合物甲;不溶物為紅棕色固體,可溶于鹽酸。
取13.0 g化合物甲,加熱使其完全分解,生成氮氣和單質乙,生成的氮氣折合成標準狀況下的體積為6.72 L。單質乙在高溫隔絕空氣的條件下與不溶物紅棕色粉末反應生成化合物丙和另一種單質。化合物丙與空氣接觸可轉化為可溶性鹽。
請回答下列問題:
(1)甲的化學式為__________,丙的電子式為__________。
(2)若丙在空氣中轉化為碳酸氫鹽,則反應的化學方程式為______________________________。
(3)單質乙與紅棕色粉末發(fā)生反應的化學方程式為_______________,安全氣囊中紅棕色粉末的作用是__________。
(4)以下物質中,有可能作為安全氣囊中紅棕色粉末替代品的是________。
A.KCl B.KNO3C.Na2S D.CuO
(5)設計一個實驗方案,探究化合物丙與空氣接觸后生成可溶性鹽的成分:________(不考慮結晶水合物)。
1.試題解析
(1)根據(jù)題意,紅棕色固體為Fe2O3,而甲是由Na與N組成的化合物,但不能想當然認為是Na3N,有定量數(shù)據(jù)必須定量分析:

甲的化學式為NaN3,而非Na3N。
(2)考查非氧化還原反應

(3)考查氧化還原反應

從氧化還原反應角度,F(xiàn)e2O3只能把Na氧化為Na2O,因為Na2O2氧化性比Fe2O3強。
NaN3分解產(chǎn)生的鈉,具有熔點低、易燃、易與水反應生成強堿極不安全因素,而鐵熔點高,相對安全,避免分解產(chǎn)生的金屬鈉可能產(chǎn)生的危害。
(4)Fe2O3是作為Na的氧化劑,可以用CuO代替(對比模仿即可),還可以用KNO3代替,KNO3在酸性或高溫下表現(xiàn)出氧化性(理解、遷移、創(chuàng)新),也是設置這小題的真正意義。
(5)考查探究化合物成分的實驗方案設計,Na2O在空氣中可能生成Na2CO3或NaHCO3或兩者混合物,設計方案時首先要考慮選擇定性判斷還是定量分析,本小題顯然定量比較合適,用“三步曲”回答:①可溶性鹽的成分可能是Na2CO3、NaHCO3或Na2CO3與NaHCO3的混合物。②準確稱取一定量的生成物,加熱至恒重后,③如試樣無失重,則為Na2CO3;如加熱后失重,根據(jù)失重的量在試樣總質量中的比例,即可推斷出試樣為NaHCO3,或Na2CO3與NaHCO3的混合物。
2.試題解讀
(1)背景與考點
2009年第一次新高考,命題人壓力大,思想觀點、內容、形式如何體現(xiàn)“新”呢?第一次新高考試題褒貶不一,但作者認為是很好的,像27題就是經(jīng)典題。試題命制人,在不斷探索、不斷創(chuàng)新,像2010年第25題就是一道出題人很得意的試題,可以說是一個“杰作”。浙江省從2006年9月新課程的改革與實施,2009年6月第一次新高考到2016年6月結束共8次高考;從2014年9月,深化高校招生考試制度綜合改革試點方案的實施,到2015年10月第一次的化學學考與選考至今共4次高考。這個試題的思想意圖一直影響這12次的高考,如2017年4月的第27題無機物推導、28題的實驗驗證等分散到各題中,這就是浙江特色。
考查內容:無機化學式的推導、電子式的書寫、氧化還原反應方程式和非氧化還原反應方程式的書寫、物質的性質與用途、實驗方案的設計等。
(2)考查能力
試題材料情景創(chuàng)新,考查學生提取信息和運用信息能力、化學計算能力、知識原理的運用能力、遷移能力、分析能力、實驗設計能力、語言表達和規(guī)范用語能力。
對這類試題的解答,必須通過閱讀、理解、分析、比較、演繹、推理、原理遷移等學科方法來解決問題。所以面對這樣的試題,依靠“題海”來復習應考,顯然是不行的,要有學科思想、要有針對性訓練。
(3)滲透化學學科思想
①定性定量相結合的思想,試題要求考生經(jīng)過定性判斷、定量分析。Na、N組成的物質不一定就是Na3N,也可以是NaN3。

③小綜合、小歸納的思想(從不同角度),CuO與Fe2O3物質組成類似,而KNO3是不同類型的物質,高溫下也可作氧化劑與Na反應。
④理論聯(lián)系實際的思想,情景來自生活,學有所用,安全氣囊的設計,體現(xiàn)學科的社會價值。
⑤實驗探究的思想(定量分析思想)
Na2O放在空氣中可能生成的物質成分,從定量的角度探究分析。
(4)亮點、特色
元素化合物的考查,落在利用定性、定量相結合的方法推斷化學式;體現(xiàn)小綜合、小歸納的思想;突出氧化還原反應原理的運用;強化小實驗操作的設計;顯現(xiàn)化學學科的社會價值。
3.解題思維方式
要快速正確完美地解答這類試題,學生要適當了解該類試題的思想靈魂、出題目的,學生也要有一定理論水平,一定的思維程序。
(1)膽大心細的心態(tài)解決定性定量的問題

定量要心細,具體是指要根據(jù)數(shù)據(jù)仔細計算,不能想當然。例如:知道Na、N組成的化合物組成不一定是Na3N,可能是NaN3;知道組成元素是N、H,化合物不一定是NH3,也可能是N2H4、HN3、NH4N3、NH4H(其實不能穩(wěn)定存在);化合物熱分解產(chǎn)生CuO、CO2、H2O,該化合物不一定是Cu2(OH)2CO3,可能是xCu(OH)2、yCuCO3;化合物由Fe、C、O組成,該化合物不一定是FeCO3,也可能是Fe(CO)5、FeC2O4等。
關注一些特殊物質,如Cu2O、Fe3S4、Fe3I4、Al2O、SiO、CaCl、N2H4、CuS、Cu2S、CuOH、CuCl、CuI、CuCO3、Fe2Cl6、Fe(CO)5、FeC2O4、FeO(OH)、Na2FeO4、Fe(C5H5)2、K4[Fe(CN)6]、K3[Fe(CN)6]。
(2)充分認識試題的價值
大題中的選擇題,從不同角度思考問題,認識出題的價值。例如:
2011年26題第3小題:為了提高加碘鹽(添加KI)的穩(wěn)定性,可加穩(wěn)定劑減少碘的損失。下列物質中有可能作為穩(wěn)定劑的是________。
A.Na2S2O3B.AlCl3
C.Na2CO3D.NaNO2

2013年27題第4小題:下列物質中也可能作為CO2捕獲劑的是_____________。
A.NH4Cl B.Na2CO3
C.HOCH2CH2OH D.HOCH2CH2NH2

(3)復雜氧化還原反應方程式的書寫方法,思維程序
①認識反應物性質(氧化性、還原性)
②判斷氧化產(chǎn)物和還原產(chǎn)物(已知或需推斷)
③電子得失總數(shù)相等
④根據(jù)化學環(huán)境添加物質(不要希望一步到位)
⑤驗證
例如:寫出用過量的NaClO溶液除去NO2的離子方程式




第五步:驗證
(4)實驗方案設計思路
主要考查反應產(chǎn)物的種類的判斷與鑒別,如“Na2O在空氣中可能生成的產(chǎn)物”,2017年4月選考“用化學方法驗證FeSO4受熱后固體的成分”等。解題思路如下:
①首先根據(jù)物質性質確定采用定性還是定量的角度驗證成分,如Na2O在空氣中可能生成的產(chǎn)物,若用定性方法很難回答。
②注意語言表達的規(guī)范性,且要用肯定的語言表達,如根據(jù)什么現(xiàn)象,確定是什么,而不是是否出現(xiàn)什么來描述。一般可以通過“三步曲”回答問題。
③不能出現(xiàn)科學性的錯誤。
④現(xiàn)象描述要準確,如未知液中加入K3[Fe(CN)6],沒有明顯現(xiàn)象,應該描述沒有藍色沉淀,因為赤血鹽是有顏色的。
例如2017年4月高考題:回答如下:
①FeSO4加熱后的固體可能是Fe2O3或Fe2O3和未分解的FeSO4;②取少量固體樣品,加入稀硫酸溶解后分兩份;③一份加入KSCN溶液,若出現(xiàn)血紅色溶液即固體有Fe2O3,另一份滴加酸性KMnO4溶液,若褪色,即有未分解的FeSO4。
看似簡單,很多考生也不能答滿分,主要扣分點有:
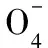

浙江省金華市外國語學校)

