乳酸菌胞外多糖研究進展
索超,曲曉軍,崔艷華
(1.哈爾濱工業大學化工與化學學院,哈爾濱 150090;2.黑龍江省科學院微生物研究所,哈爾濱 150010)
乳酸菌胞外多糖研究進展
索超1,曲曉軍2,崔艷華1
(1.哈爾濱工業大學化工與化學學院,哈爾濱 150090;2.黑龍江省科學院微生物研究所,哈爾濱 150010)
胞外多糖作為乳酸菌重要的次級代謝產物,形式多樣,種類繁多,存在著明顯的差異。本文就乳酸菌菌胞外多糖的分類、組成及結構、生物合成及遺傳調控、構效關系進行了綜述,旨為胞外多糖研究、尤其是胞外多糖的構效關系提供參考。
乳酸菌;胞外多糖;遺傳調控;構效關系
0 引言
微生物胞外多糖(Exopolysaccharides,EPS)主要是由細菌、真菌和藍綠藻產生的高分子量的碳水化合物。乳酸菌胞外多糖分子量在4×104到6×106之間,是乳酸菌生長代謝過程中重要的次生代謝產物,具有廣泛的用途。例如,EPS是天然增稠劑,可以有效改善酸奶和奶酪的黏度和質地,為發酵乳制品提供良好的流變效應,改善乳制品的口感,且具有防止酸奶的脫水收縮的作用[1-2]。乳酸菌EPS已廣泛用于食品生產,在食品的穩定、持水、乳化及增稠等方面發揮作用。同時,研究發現某些乳酸菌EPS具有抗菌、抗氧化、抗腫瘤和免疫調節等益生特性。本文對乳酸菌EPS的分類、組成及結構、生物合成及遺傳調控和構效關系方面進行闡述,旨在為今后通過基因改良的方法改變EPS結構、提高EPS生物活性提供參考。
1 乳酸菌合成胞外多糖菌群及胞外多糖的分類
目前,已發現多種乳酸菌可產胞外多糖,包括乳桿菌屬、鏈球菌屬、明串珠菌屬和乳球菌屬等,其中研究最多的為鏈球菌屬的嗜熱鏈球菌[3-4]。
乳酸菌產生的胞外多糖可以基于它們的單糖組成不同,分為同型多糖和異型多糖。同型多糖是由一種單糖聚合而成,其中單糖種類包括四類:α-D-葡聚糖,β-D-葡聚糖,β-D-果聚糖和聚半乳糖[4]。腸膜明串珠菌所產的EPS是同型多糖的典型代表,其單糖組分為α-D-葡聚糖,又稱右旋糖苷。異型多糖是由重復單元聚合而成,其中重復單元組成以D-葡萄糖,D-半乳糖和L-鼠李糖最為常見。有些還含有其他的一些成分,如:L-巖藻糖、乙酰化氨基糖(例如N-乙酰基-D-半乳糖胺)、D-核糖、D-葡萄糖醛酸和D-壬酸,以及非糖組分如甘油、磷酸鹽、丙酮酰基和乙酰基等[5-6]。
2 乳酸菌胞外多糖的組成及結構
同型多糖組分簡單,僅由一種單糖聚合而成。本文主要介紹異型多糖的組成及結構,異型多糖主要的單糖有D-半乳糖、L-鼠李糖和D-葡萄糖。這些單糖在酶的作用下,通過α或β糖苷鍵連接形成基本重復單元,最后再聚合為不同分子量的異型多糖。多糖的一級結構決定了多糖的高級結構,而多糖的一級結構主要包括不同單糖糖基組成比例,單糖糖基之間的排列順序,相鄰單糖糖基的連接方式及糖鏈的分支情況[5,7]。將產胞外多糖的乳酸菌菌株及其所產胞外多糖的組成和結構匯總到表1。

表1 產胞外多糖的乳酸菌菌株及其所產胞外多糖的組成和結構
3 乳酸菌胞外多糖生物合成及遺傳調控
3.1 生物合成途徑
同型多糖合成過程相對簡單,合成過程主要發生在細胞壁上,通過糖基轉移酶作用胞外單糖轉移到胞內糖鏈上。而異型多糖生物合成較為復雜。合成體系主要由糖基核苷酸、酰基供體、脂中間體、酶系統和糖基受體(脂載體十一異戊烯磷酸)5個部分構成。在細胞膜上,胞內糖基核苷酸在糖基轉移酶催化作用下,進一步實現聚合[16]。下面以嗜熱鏈球菌ST 1275為例,闡述異型多糖代謝途徑(圖1)。
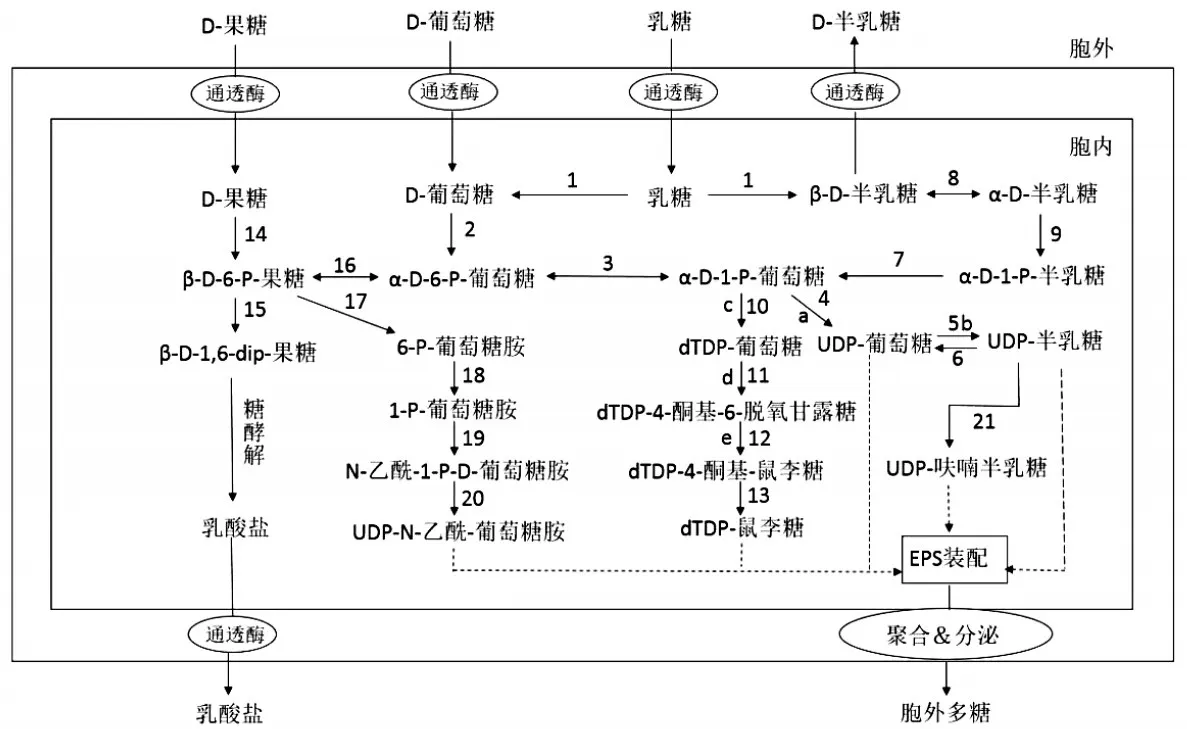
圖1 嗜熱鏈球菌糖代謝與胞外多糖合成途徑[17]
圖1中,數字代表所涉及的酶:1,β-半乳糖苷酶;2,葡萄糖激酶;3,α-磷酸葡萄糖變位酶;4,UDP-葡萄糖焦磷酸化酶;5,UDP-葡萄糖-4-差向異構酶;6,UDP-半乳糖-4-差向異構酶;7,半乳糖-1-磷酸-尿苷酰轉移酶;8,半乳糖變旋酶;9,半乳糖激酶;10,dT?DP-葡萄糖焦磷酸化酶;11,dTDP-葡萄糖-4,6-脫氫酶;12,dTDP-4酮基-6-脫氧葡萄糖-3,5-差向異構酶;13,dTDP-4-酮基-L-鼠李糖還原酶;14,果糖激酶;15,6-磷酸果糖激酶;16,磷酸葡萄糖異構酶;17,谷氨酰胺-果糖-6-磷酸轉氨酶;18,磷酸葡糖胺變位酶;19和20,N-乙酰葡糖胺-1-磷酸尿苷酰轉移酶(雙功能);21,UDP-吡喃半乳糖變位酶。
字母代表編碼相應酶的基因:a,galU編碼UDP-葡萄糖焦磷酸化酶的基因;b,galE編碼UDP-葡萄糖-4-差向異構酶的基因;c,rfbA編碼dTDP-葡萄糖焦磷酸化酶的基因;d,rfbB編碼dTDP-葡萄糖-4,6-脫氫酶的基因;e,rfbC編碼dTDP-4-酮基-6-脫氧葡萄糖-3,5-差向異構酶的基因。
在嗜熱鏈球菌ST 1275菌株中,葡萄糖在通透酶的催化作用下,由胞外進入胞內。隨后經過磷酸化,一部分進入糖酵解途徑,另一部分進入胞外多糖合成途徑。α-D-6-P-葡萄糖作為連接糖酵解途徑與胞外多糖途徑關鍵物質,其可以在磷酸變位酶催化下,生成α-D-1-P-葡萄糖,隨后α-D-1-P-葡萄糖作為中心代謝物通過一系列酶的催化作用,生成dTDP-鼠李糖、UDP-葡萄糖和UDP-半乳糖等的多糖合成前體,之后經過特定胞外多糖酶實現前體裝配,最終合成胞外多糖聚合分泌到胞外。此外,該菌可通過利用谷氨酰胺-果糖-6-磷酸轉氨酶對β-D-6-P-果糖的催化作用生成UDP-N-乙酰-葡萄糖胺,它也是合成胞外多糖重要的前體物質。
通過Wu等人對S.thermophilus ST 1275胞外多糖合成途徑的分析,ST 1275除了可以利用乳糖、半乳糖和葡萄糖外,還可以發酵果糖。然而,只有蔗糖和果糖這二種糖可以通過特異性的磷酸烯醇丙酮酸-糖磷酸轉移酶系統(PEP-PTS)進行轉運,而乳糖和葡萄糖則無法利用PEP-PTS實現轉運[17]。
3.2 遺傳調控
近年來,有關嗜熱鏈球菌和乳球菌EPS基因簇及其基因產物的功能研究越來越多[18-19]。首先從遺傳學角度來說,胞外多糖生成是由許多基因簇編碼,之后通過轉錄生成單個多順反子mRNA,并協調表達。EPS基因簇的結構大致分為4個部分,分別為編碼各糖基轉移酶的區域、控制基因簇轉錄的調控區域、編碼控制糖單元聚合輸出的區域、編碼決定多糖鏈長度的區域[20]。
以目前研究基因簇調控機制最明確的4個菌株為(S.thermophilus的 ST 1275、CNRZ 1066、LMG 18311菌株;Lactococcus lactis NIZO B40 和 Lactobacillus bulgari?cus Lfi5),其各個菌株編碼多糖基因簇及各片段相關功能示意圖如圖2所示。

圖2 各個菌株編碼多糖基因簇及各片段相關功能
在S.thermophilus ST 1275菌株的編碼多糖基因簇中,epsA和epsB用于生物合成調節同時eps1C和eps1D用于確定胞外多糖鏈的長度[21-22]。epsE基因編碼膜相關的糖基轉移酶,其功能是將1-磷酸-糖基轉移至細胞膜胞質面上的十一聚類異戊二烯醇磷酸酯(C55-lipid-p)糖基載體上,但并不催化糖苷鍵。隨后,編碼糖基轉移酶epsF,epsG,epsH,epsI,epsJ和epsK可以轉移各種糖基核苷酸(包括UDP-葡萄糖,UDP-半乳糖,dTDP-鼠李糖,UDP-N-乙酰-葡萄糖胺和UDP-半乳糖呋喃糖)以形成多糖的重復單元[23-24]。此外,在該基因簇中還發現了用于合成UDP-呋喃半乳糖的UDP-吡喃半乳糖變位酶。同時發現eps2C和eps2D這兩個基因與決定多糖鏈長度有關。ST 1275基因組中決定胞外多糖鏈長度的兩對基因(即eps1C-eps1D和eps2C-eps2D)的發現意味著可以產生不同分子大小的胞外多糖。重復單元的聚合和易位的特定功能分別通過epsL和epsN實現。epsO和epsP在磷酸化中起作用,而epsQ的功能為用于胞外多糖在膜和肽聚糖層之間的轉移。研究表明,分布在菌株的所有eps基因簇中的orf14.9基因與嗜熱鏈球菌的細胞生長相關[25]。通過對菌株eps基因簇的各種結構的了解,表明胞外多糖的合成與其化學結構具有菌株特異性[23,26]。
在L.lactis NIZO B40菌株的編碼多糖基因簇中,espR作用是調控蛋白質的表達,而espA和espB是決定多糖的鏈espDEFGH調控糖基轉移酶的產生,epsI和epsK的作用分別是調控蛋白質的聚合與輸出。至于espX,espC,espL,espJ的功能目前還不清楚。需要注意的是espD主要是調控起始糖基核苷酸轉移酶,這種酶的作用就是將UDP-葡萄糖中的葡萄糖轉運到脂載體上,構成多糖主鏈骨架,這一過程是胞外多糖生物合成的第一步,非常重要[27]。
在胞外多糖合成過程中,除了胞外多糖基因簇具有調控蛋白質合成、決定多糖重復單元的合成、決定多糖的鏈長以及蛋白質聚合與輸出等功能外,還有許多例如galU,galE和pgm等的持家基因也參與了胞外多糖的生物合成,其主要功能是編碼對胞外多糖合成前體的關鍵酶[16]。Svensson等人通過改變參與核苷酸糖代謝的中樞碳代謝中的酶的活性方式提高嗜熱鏈球菌LY03產EPS的水平[28]。
4 構效關系
不同乳酸菌EPS結構有很大的不同,其結構的差異必然導致其生物活性的不同。研究表明,多糖的一級結構包括單糖糖基,單糖糖基之間的排列順序,相鄰單糖糖基的連接方式以及糖鏈的分支情況等,每一種影響一級結構的因素對多糖的功能都會產生影響。
多糖的抗腫瘤活性與葡萄糖鏈上糖苷鍵類型有關。β-糖苷鍵比α-糖苷鍵構成的葡聚糖的抗腫瘤活性高,其中葡萄糖鏈上的β-1,3糖苷鍵和β-1,6糖苷鍵是具備抗腫瘤活性的必要條件[29]。經過乙酰化修飾的β-1,6糖苷鍵的葡聚糖,具有抗腫瘤活性,消除乙酰化修飾,抗腫瘤活性消失。經Hamuor發現具有β-1,3糖苷鍵的葡萄糖鏈骨架上由于具有多羥基基團,對抗腫瘤活性起到重要作用[30]。除此之外,胞外多糖其鏈長,支鏈組成對其致密性具有很大影響,從而改變多糖的流變性質。
同樣胞外多糖的抗氧化活性與其結構具有一定關系。多糖中的羥基與氧自由基間有相互作用,同時隨著羥基數目的增多,其抗氧化活性增強。研究表明,嗜熱鏈球菌胞外多糖通過硫酸酯化后,其多糖的抗氧化活性與抗菌活性得到顯著提高[31]。Li等人,通過對嗜熱鏈球菌ASCC 1275胞外多糖進行硫酸化,通過二苯基硝基苯肼(DPPH),超氧化物和羥基自由基清除試驗和三價鐵還原抗氧化能力測定法對硫酸化胞外多糖的抗氧化活性進行測定。結果表明,硫酸化修飾胞外多糖的抗氧化活性顯著提高(P<0.05)[32]。EPS的性質還可以通過化學改性或與其它生物聚合物和/或交聯劑的化學反應進而改變[33]。Zhao等人,通過利用硒化修飾后的多糖與未修飾的多糖作為抗氧化劑對DPPH、羥基自由基和超氧自由基的清除能力,金屬螯合能力和體外還原能力進行比較。結果表明,硒化修飾的多糖可以顯著增強抗氧化的活性[34]。
乳酸菌胞外多糖的黏度與其濃度有關,具有高粘度的聚合物的先決條件是具有高濃度和高比容量。同時多糖的黏度與其單糖之間的糖苷鍵有關。在Lac?tococcus lactis subsp.cremoris B40菌株產生胞外多糖中,由β-1,4糖苷鍵比β-1,3或α-1,4連接的鏈具有更強的剛性,并且α型鍵比β型鍵構成的鏈更具有柔性,進而影響多糖的粘度,除此之外,黏度與多糖分子量增加相關[35]。
多糖中單糖的成分與其功能有很大關系,巖藻糖作為單糖的一種,是公認的稀有糖之一。據報道,含有巖藻糖以及含有巖藻糖的寡糖的制劑具有增強其在藥物中(作為抗癌劑或抗炎劑)或化妝品(作為抗衰老劑)的應用的性質[36]。因此,具有高含量的巖藻糖(或其他增值成分)的多糖,可以被看作是有價值的化學品的來源。
5 展望
隨著人們生活水平的提高,對食品的安全和健康性越來越重視,乳酸菌產生的胞外多糖做為一種生物源性成分,具有廣泛的發展前景。其良好的增稠性能和保水性對食品加工與儲存具有重要作用。并且由于胞外多糖還具有抗腫瘤活性,在醫學領域也發揮了重要作用。在通過研究乳酸菌遺傳背景采用基因工程方法獲得高產優質胞外多糖菌株過程中,還需逐步建立和改進食品級的表達系統,同時轉基因菌株的安全性也是需要所考慮的。
[1]BROADBENT J R,MCMAHON D J,OBERG C J,et al.Use of exopolysaccharide-producing cultures to improve the functionality of low fat cheese[J].International Dairy Journal,2001,11(4):433-439.
[2]AMATAYAKUL T,SHERKAT F,SHAH N P.Syneresis in set yo?gurt as affected by eps starter cultures and levels of solids[J].Interna?tional Journal of Dairy Technology,2006,59(3):216–221.
[3]RUASMADIEDO P,HUGENHOLTZ J,ZOON P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].International Dairy Journal,2002,12(2):163-171.
[4]VUYST L D,VIN F D,VANINGELGEM F,et al.Recent develop?ments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria[J].International Dairy Journal,2001,11(9):687-707.
[5]DOCO T,WIERUSZESKI J M,FOUMNET B,et al.Structure of an exocellular polysaccharide produced by Streptococcus thermophilus[J].Carbohydrate Research,1990,198(2):313-321.
[6]VAN CALSTEREN M R,PAU-ROBLOT C,ROY D,et al.Struc?ture determination of the exopolysaccharide produced by Lactobacillus rhamnosus strains RW-9595M and R[J].Biochemical Journal,2002,363(1):7-17.
[7]MARSHALL V M,LAWS A P,GU Y,et al.Exopolysaccharide-pro?ducing strains of thermophilic lactic acid bacteria cluster into groups ac?cording to their eps structure[J].Letters in Applied Microbiology,2001,32(6):433-437.
[8]NAVARINI L,ABATANGELO A,BERTOCCHI C,et al.Isolation and characterization of the exopolysaccharide produced by Streptococcus thermophilus SFi20 1[J].International Journal of Biological Macromole?cules,2001,28(3):219-226.
[9]FABER E J,MJ VDH,KAMERLING J P,et al.Structure of the exo?polysaccharide produced by Streptococcus thermophilus S3[J].Carbohy?drate Research,2001,331(2):173-182.
[10]BUBB W A,URASHIMA T,FUJIWARA R,et al.Structural char?acterisation of the exocellular polysaccharide produced by Streptococcus thermophilus OR 901[J].Carbohydrate Research,1997,301(1-2):41-50.
[11]MONSAN P,BOZONNET S,JOUCLA G,et al.Homopolysaccha?rides from lactic acid bacteria[J].International Dairy Journal,2001,11(9):675-685.
[12]DOCO T,WIERUSZESKI J M,FOUMNET B,et al.Structure of an exocellular polysaccharide produced by Streptococcus thermophilus[J].Carbohydrate Research,1990,198(2):313-321.
[13]WHMVAN C,DIJKEMA C,SCHOLS H A,et al.Characterisation and modification of the exopolysaccharide produced by Lactococcus lac?tis subsp.cremoris B40[J].Carbohydrate Polymers,1998,37(2):123-130.
[14]CASTEREN WHMV,WAARD P D,DIJKEMA C,et al.Structural characterisation and enzymic modification of the exopolysaccharide produced by Lactococcus lactis subsp.cremoris B891[J].Carbohydrate Research,2000,324(3):170-181.
[15]SANCHEZ-MEDINA I,GERWIG G J,URSHEV Z L,et al.Struc?tural determination of a neutral exopolysaccharide produced by Lacto?bacillus delbrueckii ssp.bulgaricus LBB.B332[J].Carbohydrate Research,2007,342(18):2735-2744.
[16]范麗平,劉飛,霍貴成.嗜熱鏈球菌胞外多糖的結構生物合成與遺傳調控[J].中國乳品工業,2005,33(11):42-45.
[17]WU Q,TUN H M,LEUNG C C,et al.Genomic insights into high exopolysaccharide-producing dairy starter bacterium Streptococcus ther?mophilus ASCC 1275[J].Scientific Reports ,2014,4(7500):4974-4981.
[18]LEVANDER F,SVENSSON M,RADSTROM P.Enhanced exo?polysaccharide production by metabolic engineering of Streptococcus thermophilus[J].Applied&Environmental Microbiology,2002,68(2):784-790.
[19]SHIN K O,JEON J R,JI S L,et al.Lactic acid fermentation of chi?nese yam(dioscorea batatas decne)flour and its pharmacological ef?fect on gastrointestinal function in rat model[J].Biotechnology and Bioprocess Engineering,2006,11(3):240-244.
[20]LAWS A,GU Y,MARSHALL V.Biosynthesis,characterisation,and design of bacterial exopolysaccharides from lactic acid bacteria[J].Bio?technology Advances,2011,19(8):597-625.
[21]YONG J G,GOIN C,ALTENMANN E,et al.Specialized adapta?tion of a lactic acid bacterium to the milk environment:the comparative genomics of Streptococcus thermophilus LMD-9[J].Microbial Cell Fac?tories,2011,10 Suppl 1(1):10066-10071.
[22]MINIC Z,MARIE C,DELONME C,et al.Control of epsE,the phosphoglycosyltransferase initiating exopolysaccharide synthesis in Streptococcus thermophilus,by epsD tyrosine kinase[J].Journal of Bacte?riology,2007,189(4):1351-1357.
[23]JOLLY L,STINGELE F.Molecular organization and functionality of exopolysaccharide gene clusters in lactic acid bacteria[J].International Dairy Journal,2001,11(9):733-745.
[24]LEBEER S,VERHOEVEN T L,FRANCIUS G,et al.Identifica?tion of a gene cluster for the biosynthesis of a long,galactose-rich exopolysaccharide in Lactobacillus rhamnosus GG and functional analy?sis of the priming glycosyltransferase[J].Applied&Environmental Mi?crobiology,2009,75(11):3554-3563.
[25]TYVAERT G,MOREL C,JOLY J P,et al.The constant gene orf14.9 ,which belongs to the variable eps(exopolysaccharide)clus?ter,is involved in the cell growth of Streptococcus thermophilus[J].Cana?dian Journal of Microbiology,2006,52(9):908-912.
[26]BROADBENT J R,MCMAHON D J,WELKER D L,et al.Bio?chemistry,genetics,and applications of exopolysaccharide production in Streptococcus thermophilus:a review[J].Journal of Dairy Science,2003,86(2):407-423.
[27]VUYST L D,DEGEEST B.Heteropolysaccharides from lactic acid bacteria[J].Fems Microbiology Reviews,1999,23(2):153-177.
[28]LEVANDER F,SVENSSON M,RADSTROM P.Enhanced exo?polysaccharide production by metabolic engineering of Streptococcus thermophilus[J].Applied&Environmental Microbiology,2002,68(2):784-790.
[29]邱琳,辛現良,耿美玉.多糖構效關系研究進展[J].現代生物醫學進展,2009,9(9):1764-1768.
[30]HAMURO J,YAMASHITA Y,OHSAKA Y,et al.Carboxymethyl?pachymaran,a new water soluble polysaccharide with marked antitu?mour activity[J].Nature,1971,233(5320):486-488.
[31]YANG J,DU Y,WEN Y,et al.Sulfation of chinese lacquer polysac?charides in different solvents[J].Carbohydrate Polymers,2003,52(4):397-403.
[32]LI S,SHAH N P.Antioxidant and antibacterial activities of sulphated polysaccharides from pleurotus eryngii and Streptococcus thermophilus ASCC 1275[J].Food Chemistry,2014,165(3):262-270.
[33]WANG C,GONG Y,LIN Y,et al.A novel gellan gel-based micro?carrier for anchorage-dependent cell delivery[J].Acta Biomaterialia,2008,4(5):1226-1234.
[34]ZHAO B,ZHANG J,YAO J,et al.Selenylation modification can en?hance antioxidant activity of potentilla anserina L.polysaccharide[J].In?ternational Journal of Biological Macromolecules,2013,58(2):320-328.
[35]LOOIJESTEIJN P J,VAN CASTEREN W H,TUINIER R,et al.Influence of different substrate limitations on the yield,composition and molecular mass of exopolysaccharides produced by Lactococcus lac?tis subsp.cremoris in continuous cultures[J].Journal of Applied Micro?biology,2000,89(1):116–122.
[36]KUMAR AS,MODY K,JHA B.Bacterial exopolysaccharides-a per?ception[J].Journal of Basic Microbiology,2007,47(2):103-117.
Research advances in extracellular polysaccharide produced by Lactic acid bacteria
SUO Chao1,QU Xiaojun2,CUI Yanhua1
(1.Department of Food Science and Engineering,School of Chemistry and Chemical Engineering,Harbin Institute of Technology,Harbin 150090,China;2.Institute of Microbiology,Heilongjiang Academy of Sciences,Harbin 150010,China)
Extracellular polysaccharides(EPS)of Lactic acid bacteria(LAB)are important secondary metabolites,and present high diversities and obvious difference.In this paper,the classification,composition,structure,biosynthesis,genetic regulation,and the relationship between activity and structure of EPS of LAB were reviewed,in order to provide references for the research of EPS,especially in the relationship be?tween activity and structure of EPS.
Lactic acid bacteria;exopolysaccharide;gene regulation;structure-function relationship
Q539
B
1001-2230(2017)11-0032-05
2017-04-14
國家自然科學基金資助項目(31471712;31371827)。
索超(1993-),男,碩士研究生,從事分子微生物學研究。
崔艷華

