RRM1單核苷酸多態性與非小細胞肺癌患者對吉西他濱化療敏感性的相關性研究Δ
孟玲利,李晶,王艷娜,程艷芳,王慧,李娜,鞏平(石河子大學醫學院第一附屬醫院腫瘤內科,新疆石河子 832000)
·精準醫療·
RRM1單核苷酸多態性與非小細胞肺癌患者對吉西他濱化療敏感性的相關性研究Δ
孟玲利*,李晶,王艷娜,程艷芳,王慧,李娜,鞏平#(石河子大學醫學院第一附屬醫院腫瘤內科,新疆石河子 832000)
目的:探討核苷酸還原酶M1亞基(RRM1)的單核苷酸多態性(SNPs)與非小細胞肺癌(NSCLC)患者對吉西他濱化療敏感性的相關性。方法:選取2014年8月-2016年7月我院NSCLC初治患者96例,均接受以吉西他濱為基礎的兩藥聯合化療方案,連續化療至少2個周期(每28 d為1個周期)。以完全緩解、部分緩解的患者總數與受試患者總數的比值來計算化療敏感率;采用聚合酶鏈反應和直接測序法檢測其RRM1基因型;分析患者不同基因型與化療敏感性的相關性。結果:RRM1-37C>A的CC、CA、AA基因型分布頻率分別為35.42%、52.08%、12.50%,-524C>T的CC、CT、TT基因型分布頻率分別為18.75%、37.50%、43.75%,各基因型分布頻率均符合Hardy-Weinberg平衡(P>0.05)。96例NSCLC患者的化療敏感率為37.50%。患者的年齡、性別、民族、吸煙與否、TNM分期、病理類型、化療方案和美國東部腫瘤協作組評分與化療敏感性無關(P>0.05)。RRM1(-37CA)+(-524CT)、(-37CC)+(-524TT)基因型患者的化療敏感率(57.14%、39.39%)均顯著高于其他基因型患者(10.71%),差異均有統計學意義(P<0.05);而RRM1(-37CA)+(-524CT)與(-37CC)+(-524TT)基因型患者的化療敏感率比較,差異無統計學意義(P>0.05)。結論:NSCLC患者RRM1的SNPs可作為評價吉西他濱化療敏感性的預測因子,RRM1(-37CA)+(-524CT)和(-37CC)+(-524TT)基因型患者對該類化療方案具有更高的敏感性。
非小細胞肺癌;核苷酸還原酶M1亞基;單核苷酸多態性;吉西他濱;化療敏感性
肺癌已成為我國乃至全球發病率及病死率最高的惡性腫瘤。根據全國腫瘤登記中心的數據顯示,2012年我國惡性腫瘤發病率及病死率最高的為肺癌,每年新發病例約70.5萬,死亡病例約56.9萬[1-2]。肺癌分為非小細胞肺癌(Non-small cell lung cancer,NSCLC)和小細胞肺癌(Small cell lung cancer,SCLC),其中NSCLC占肺癌的85%以上,且大部分患者就診時已為晚期,失去手術機會,而靶向治療和放療也僅適用于少部分人群,化療仍是NSCLC患者的主要治療手段[3]。隨著藥物基因組學的發展,人們發現藥物相關基因的單核苷酸多態性(Single nucleotide polymorphisms,SNPs)及其表達水平與化療敏感性之間存在一定的相關性[4]。吉西他濱作為第三代新型化療藥物,可大大提高NSCLC患者的化療敏感性,但其單藥治療的有效率仍僅為18%~35%;同時在臨床工作中還發現,相同病理類型及分期的NSCLC患者可能對以吉西他濱為基礎的化療方案的敏感性存在很大差異[5]。研究證實,吉西他濱作用靶點核苷酸還原酶M1亞基(Ribonucleotide reductase M1,RRM1)編碼基因的SNPs與NSCLC患者的化療敏感性存在相關性[6]。鑒于此,本研究納入NSCLC患者96例,通過測定RRM1-37C>A和-524C>T的多態性,分析其與患者對以吉西他濱為基礎的化療方案敏感性的相關性,以期為NSCLC患者的個體化治療提供參考。
1 資料與方法
1.1 研究對象
選取2014年8月-2016年7月我院腫瘤內科收治的NSCLC初治患者96例,年齡18~72歲,平均年齡(59.9±8.4)歲。其中,男性77例,女性19例;維族36例,漢族60例;ⅢB期20例,Ⅳ期76例;鱗癌27例,腺癌69例;美國東部腫瘤協作組(Eastern Cooperative Oncology Group,ECOG)評分0~1分58例,2分38例。
納入標準:(1)經病理學或細胞學診斷為NSCLC;(2)不適合治療性手術或放療;(3)經計算機斷層掃描(Computed tomography,CT)或正電子發射計算機斷層顯像(Positron emission tomography-computed tomography,PET-CT)證實具有可測量的病灶;(4)卡氏評分≥60分,預計生存期≥3個月;(5)血常規、肝腎功能、電解質水平在化療允許范圍內;(6)未經系統性抗癌治療,無需姑息性放療,適合于以吉西他濱為基礎的化療。排除標準:(1)曾接受過放化療者;(2)病理診斷不明者;(3)不能耐受、不愿繼續配合化療或失訪者;(4)繼發惡性腫瘤、全身性疾病或感染者。本研究方案經醫院醫學倫理委員會審核通過,所有患者均知情并簽署知情同意書。
1.2 基因型檢測與分析
所有患者均于化療前抽取靜脈血2 mL,置于乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)抗凝管中,于-80℃低溫冰箱中保存,備用。采用DNA抽提試劑盒(北京天根生物科技有限公司)提取患者基因組DNA,使用Gene Amp 9700型聚合酶鏈反應(Polymerase chain reaction,PCR)儀(美國ABI公司),采用PCR法進行擴增。PCR引物由生工生物工程(上海)股份有限公司設計合成。RRM1-37位點上游引物:5′-CTGGACGGGGCGGCTGGACA-3′,下游引物:5′-TTGGCTACTGAAGACATGCTGG-3′,擴增片段大小為344 bp;RRM1-524位點上游引物:5′-GAGGGCAGTGAGAAACCAACGA-3′,下游引物:5′-CTCCTGCTACCATGTTTTGTGT-3′,擴增片段大小為624 bp。反應體系(50 μL)均含PCR Mix 22.5 μL,上、下游引物各 1 μL,DNA模板3 μL,加無酶水至50 μL。RRM1-37位點的反應條件:94℃預變性5 min,94℃變性10 s,72℃退火10 s,72 ℃延伸30 s,共35個循環;72 ℃再延伸5 min。RRM1-524位點的反應條件:94℃預變性5 min,94℃變性30 s,60 ℃退火10 s,72 ℃延伸30 s,共35個循環;72℃再延伸5 min。所有產物均于-20℃下保存。使用3730 XL型測序儀(美國ABI公司)、采用直接測序法測定各患者的基因型,利用Chromas V1.45軟件(http://technelysium.com.au/wp/)進行終點分析。
1.3 化療方案
每次化療前,應常規監測患者的血壓、呼吸、脈搏、體溫和血常規。所有患者均采用注射用鹽酸吉西他濱(江蘇豪森藥業集團有限公司,批準文號:國藥準字H20030104,規格:0.2 g)+順鉑注射液(江蘇豪森藥業集團有限公司,批準文號:國藥準字H20010743,規格:20 mL∶20 mg)或注射用鹽酸吉西他濱+注射用卡鉑(齊魯制藥有限公司,批準文號:國藥準字H10920028,規格:0.1 g)方案化療。具體用法用量為:吉西他濱1 000 mg/m2,持續靜脈滴注30 min,d1、d8+順鉑30 mg/m2,2 h內靜脈滴注,d2~d4或卡鉑[總劑量(mg)=設定藥-時曲線下面積×(肌酐清除率+25)[7]],避光條件下靜脈滴注,d1。以上方案均以28 d為1個周期,所有患者均連續治療不少于2個周期。
1.4 療效評價
療效評價參照實體瘤療效評價標準(Response evaluation criteria in solid tumours,RECIST)1.1版[8]——完全緩解(Complete response,CR):所有目標病灶消失,病理性淋巴結短徑<10 cm;部分緩解(Partial response,PR):與基線病灶長徑總和比較縮小30%;疾病進展(Progressive disease,PD):原靶病灶長徑總和增加>20%,且原靶病灶長徑總和的絕對值增加>5 mm;穩定(Stable disease,SD):基線病灶長徑總和有縮小但未達PR,或有增加但未達PD。化療敏感率(%)=(CR數量+PR數量)/患者總數×100%。
1.5 統計學方法
采用SPSS 22.0軟件對數據進行統計分析。計量資料以x±s表示,組間比較采用方差分析;計數資料以率表示,組間比較采用χ2檢驗。采用χ2檢驗考察RRM1各基因型分布是否符合Hardy-Weinberg平衡;采用χ2檢驗或Fisher確切概率法分析RRM1基因型與患者臨床特征(包括年齡、性別、吸煙與否、TNM分期、病例類型、化療方案和ECOG評分)的相關性。P<0.05為差異有統計學意義。
2 結果
2.1 患者基因型分布
共檢出RRM1-37C>A基因型3種,CC、CA、AA基因型的分布頻率分別為35.42%、52.08%、12.50%;共檢出RRM1-524C>T基因型3種,CC、CT、TT基因型的分布頻率分別為18.75%、37.50%、43.75%。上述2個位點各基因型分布頻率均符合Hardy-Weinberg平衡(P>0.05),表明受試群體基因遺傳平衡,數據來自于同一孟德爾群體,具有較好的群體代表性,詳見表1。
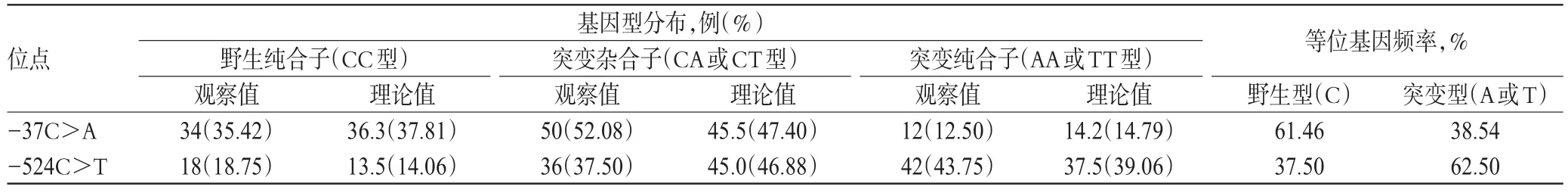
表1 NSCLC患者RRM1基因型分布Tab 1 Distribution of RRM1 genotype in NSCLC patients
2.2 患者臨床特征與化療敏感性
96例NSCLC患者中,CR 12例、PR 24例、SD 44例、PD 16例,對化療方案敏感的有36例,化療敏感率為37.50%。患者的年齡、性別、民族、吸煙與否、TNM分期、病理類型、化療方案、ECOG評分等一般資料比較,差異均無統計學意義(P>0.05),詳見表2。
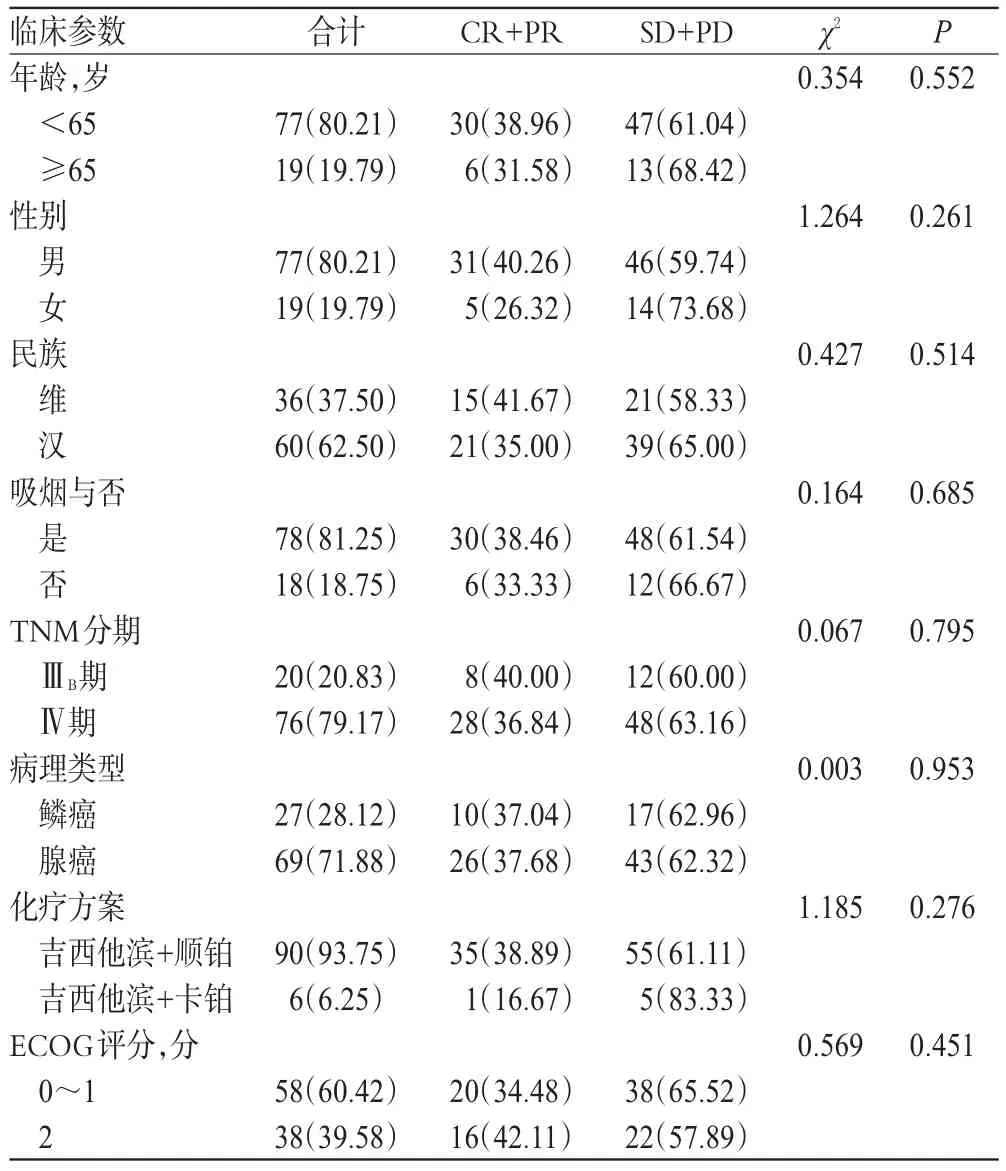
表2 NSCLC患者臨床特征與吉西他濱化療敏感性[例(%%)]Tab 2 The clinical characteristics and the sensitivity of gemcitabine chemotherapy in NSCLC patients[cas(e%%)]
2.3 患者RRM1基因型與化療方案敏感性的相關性
[6]及受試患者的基因型類型,本研究比較了RRM1(-37CA)+(-524CT)、RRM1(-37CC)+(-524TT)和其他基因型患者的化療敏感性。結果顯示,在35例RRM1(-37CA)+(-524CT)基因型患者中,敏感的有20例,化療敏感率為57.14%;33例RRM1(-37CC)+(-524TT)基因型患者中,敏感的有13例,化療敏感率為39.39%;28例其他基因型患者中,敏感的有3例,化療敏感率為10.71%。3種基因型NSCLC患者的化療敏感率比較,差異有統計學意義(P<0.05)。兩兩比較結果顯示,RRM1(-37CA)+(-524CT)、(-37CC)+(-524TT)基因型患者的化療敏感率顯著高于其他基因型患者,差異均有統計學意義(P<0.05);而 RRM1(-37CA)+(-524CT)與(-37CC)+(-524TT)基因型患者的化療敏感率比較,差異無統計學意義(P>0.05),詳見表3。
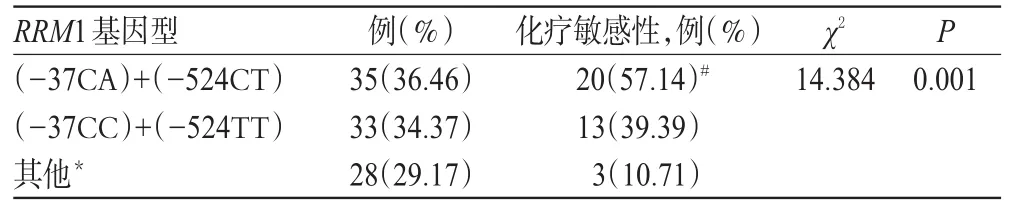
表3 NSCLC患者RRM1基因型與吉西他濱化療敏感性的相關性Tab 3 The correlation between the genotype of RRM1 and sensitivity of gemcitabine chemotherapy in NSCLC patients
3 討論
吉西他濱是90年代后期出現的第三代化療藥物,其出現使惡性腫瘤的化療敏感率得到了很大程度的提升,也為NSCLC患者的化療提供了新的選擇[9]。吉西他濱本質上是一種嘧啶類細胞周期特異性抗代謝藥,為胞嘧啶核苷衍生物,可與胞嘧啶競爭參與DNA的合成[10]。RRM1是目前已知的唯一一個使核糖核酸轉變為脫氧核糖核苷酸的限速酶,可以調控DNA的聚合和修復[11]。Pereira S等[12]的研究表明,吉西他濱進入人體后所生成的活性代謝產物可抑制RRM1酶的活性,從而使DNA生成所必需的脫氧核苷三磷酸減少,導致DNA鏈合成終止、DNA斷裂,最終誘導細胞死亡。上述研究表明,RRM1酶是吉西他濱的主要作用靶點,也是其發揮抗腫瘤作用的主要作用機制。
吉西他濱作為NSCLC治療的一線用藥,在臨床上被廣泛應用,但使用吉西他濱不可避免會出現耐藥,甚至有些患者在初次使用時就表現出非常低的敏感性,這使得是否該選擇吉西他濱成為困擾臨床的難題[13]。Bepler G等[14]研究發現,對于僅進行單純手術治療的早期NSCLC患者而言,RRM1高表達者的生存期更長;而對于進展期NSCLC患者而言,RRM1低表達者的生存期更長。這使得RRM1表達水平的高低成為預測吉西他濱療效的指標之一。但測定RRM1表達水平受到取材的限制,尋求更加準確和經濟的方法來預測、評估吉西他濱的敏感性尤為重要。
SNPs指基因組DNA序列中頻率>1%的單個核苷酸的變異,其差異將直接或間接地影響酶的生物功能[15]。SNPs可通過直接從全血(外周血白細胞、外周血淋巴細胞)標本中提取DNA進行測定,對于腫瘤組織難以獲得或不可用的NSCLC患者,更加便捷、經濟;除此之外,采用SNPs作為預測因子還具有結果恒定的優點[16]。相關研究表明,RRM1-37、-524位點的SNPs調控了啟動子的活性,從而調控了RRM1的表達,影響了NSCLC患者對吉西他濱的敏感性,但具體的轉錄機制尚缺乏充分研究[17]。張璇等[11]的研究發現,RRM1-37位點AC基因型患者對以吉西他濱為基礎的化療方案具有更高的敏感性和更長的生存期。Mazzoni F等[16]進行了一項前瞻性的臨床研究,檢測首次確診為NSCLC患者的RRM1基因型,并基于SNPs的情況將患者分為吉西他濱敏感[RRM1(-37AA)+(-524CC)以外的基因型]組和吉西他濱不敏感[RRM1(-37AA)+(-524CC)基因型]組,前者給予吉西他濱治療,后者改用多西他賽。結果表明,患者的無進展生存期(Progression-free-survival,PFS)和總生存時間(Overall survival,OS)得到了明顯延長,且鱗癌患者相比于腺癌患者更加受益于個體化治療。Bepler G等[14]的研究表明,與其他基因型患者相比,RRM1(-37CC)+(-524TT)基因型患者具有更好的化療緩解率和更長的PFS。而林莉等[18]則發現40例使用吉西他濱化療的NSCLC患者的療效及生存時間與RRM1-37位點的多態性無關(P分別為0.267、0.057)。因此,目前關于何種基因型攜帶者對吉西他濱化療敏感性更高尚存有爭議,這可能與研究樣本量、研究地點、種族和試驗方法的差異有關。
由于各基因型組合的患者數量差異較大,本研究在已有文獻的基礎上,初步比較了RRM1(-37CA)+(-524CT)、(-37CC)+(-524TT)和其他基因型患者對以吉西他濱為基礎的化療方案敏感性之間的差異。結果表明,在96例NSCLC患者中,RRM1(-37CA)+(-524CT)基因型患者的化療敏感性最高,其次為RRM1(-37CA)+(-524TT)基因型患者,而RRM1(-37AC)+(-524CC)等其他4種基因型患者對吉西他濱的化療敏感性最低,提示RRM1(-37CA)+(-524CT)和(-37CC)+(-524TT)兩種基因型患者對以吉西他濱為基礎的化療方案具有較高敏感性,該種基因型組合可能通過調控RRM1的表達,使患者的化療敏感性明顯提高;同時,也提示RRM1的SNPs可作為評價以吉西他濱為基礎的化療方案敏感性的預測因子,且不同基因型患者對應的敏感性也有所差異。但本研究結果有異于Bepler G等[17]的研究,這可能與種族、樣本量以及基因型測定方法不同有關。
綜上所述,NSCLC患者RRM1的SNPs對使用以吉西他濱為基礎的化療方案的敏感性評價具有一定的預測價值,RRM1(-37CA)+(-524CT)和(-37CC)+(-524TT)基因型患者對該化療方案具有更高的敏感性。通過測定NSCLC患者的RRM1基因型,對患者進行初篩,可在一定程度上提高使用以吉西他濱為基礎的化療方案的敏感率。但本研究僅能顯示特定基因型組合患者對以吉西他濱為基礎的化療方案的敏感性,并未提示野生型和突變型對化療敏感性的影響;其次,本研究并未發現NSCLC患者的性別、年齡、吸煙與否、TNM分期、病理類型、化療方案及ECOG評分與吉西他濱化療敏感性的相關性,這可能受到樣本量的限制;再次,本研究由于周期尚短,并未對不同基因型NSCLC患者的預后進行分析,也并未對維吾爾族和漢族患者RRM1基因型分布的差異進行探討,再加之入選的多為進展期NSCLC患者,故仍需大樣本量、長時間的后續研究予以進一步證實。
參考文獻
[1]World Health Organization.GLOBOCAN 2012:estimated cancerincidence,mortality and prevalence worldwide in 2012[EB/OL].(2014-01-09)[2014-07-01].http://globocan.iarc.fr/Pages/fact_sheets_population.aspx.
[2]陳萬青,鄭榮壽,張思維,等.2012年中國惡性腫瘤發病和死亡分析[J].中國腫瘤,2016,25(1):1-8.
[3]Maione P,Rossi A,Sacco PC,et al.Advances in chemotherapy in advanced non-small-cell lung cancer[J].Expert Opin Pharmacother,2010,11(18):2997-3007.
[4]周帆,辛華雯.藥物基因組學與個體化治療[J].中國藥師,2011,14(11):1673-1677.
[5]于世英.吉西他濱用于非小細胞肺癌治療的研究進展[J].中國癌癥雜志,2001,11(4):367-370.
[6]Kim SO,Jeong JY,Kim MR,et al.Efficacy of gemcitabine in patients with non-small cell lung cancer according to promoter polymorphisms of the ribonucleotide reductase M1 gene[J].Clin Cancer Res,2008,14(10):3083-3088.
[7]杜春雙,焦建杰,包樂紋,等.卡鉑按不同AUC給藥對晚期卵巢上皮癌患者藥動學參數的影響[J].中國藥房,2013,24(28):2637-2641.
[8]Jang GS,Kim MJ,Ha HI,et al.Comparison of RECIST version 1.0 and 1.1 in assessment of tumor response by computed tomography in advanced gastric cancer[J].Chin J Cancer Res,2013 ,25(6):689-694.
[9]梁會營.吉西他濱聯合鉑類與其它三代含鉑雙藥方案治療晚期非小細胞肺癌的療效和毒性反應比較[D].沈陽:中國醫科大學,2010.
[10]Li L,Schaid DJ,Fridley BL,et al.Gemcitabine metabolic pathway genetic polymorphisms and response in patients with non-small cell lung cancer[J].Pharmacogenet Genomics,2012,22(2):105-116.
[11]張璇.核糖核苷酸還原酶(RRM1)37位點基因多態性與晚期非小細胞肺癌患者GP化療敏感性關系的研究[D].
錦州:遼寧醫學院,2012.
[12]Pereira S,Fernandes PA,Ramos MJ.Mechanism for ribonucleotide reductase in activation by the anticancer drug gemcitabine[J].J Comput Chem,2004,25(10):1286-1294.
[13]信文.RRM1基因多態性與進展期胰腺癌患者吉西他濱化療敏感性及毒副作用的研究[D].天津:天津醫科大學,2014.
[14]Bepler G,Sharm S,Cantor A,et al.RRM1 and PTEN as prognostic parameters for overall and disease-free survival in patients with non-small cell lung cancer[J].Clin Oncol,2004,22(10):1878-1885.
[15]張靜.DNA損傷修復基因多態與苯作業工人遺傳損傷易感性關系的研究[D].烏魯木齊:新疆醫科大學,2012.
[16]Mazzoni F,Cecere FL,Meoni G,et al.PhaseⅡtrial of customized first line chemotherapy according to ERCC1 and RRM1 SNPs in patients with advanced non-small cell lung cancer[J].Lung Cancer,2013,82(2):288-293.
[17]Bepler G,Zheng Z,Gautam A,et al.Ribonucleotide reductase M1 gene promoter activity,polymorphisms,population frequencies,and clinical relevance[J].Lung Cancer,2005,47(2):183-192.
[18]林莉,劉曉晴,宋三泰,等.肺癌患者RRM1(-37)位點基因多態性及其與臨床相關性的研究[J].中國肺癌雜志,2008,11(6):784-788.
Study on the Correlation between RRM1 Single Nucleotide Polymorphisms and Chemotherapy Sensitivity of NSCLC Patients for Gemcitabine
MENG Lingli,LI Jing,WANG Yanna,CHENG Yanfang,WANG Hui,LI Na,GONG Ping(Dept.of Oncology,the First Affiliated Hospital,Shihezi University School of Medicine,Xinjiang Shihezi 832000,China)
OBJECTIVE:To investigate the correlation between ribonucleotide reductase M1 subunit(RRM1)single nucleotide polymorphisms(SNPs)and chemotherapy sensitivity of patients with non-small cell lung cancer(NSCLC)for gemcitabine.METHODS:A total of 96 NSCLC patients receiving primary treatment selected from our hospital during Aug.2014-Jul.2016 were all accepted gemcitabine-based two-drug chemotherapy plan,with continuous treatment for at least 2 cycles(28 d as a cycle).Chemotherapy sensitivity rate was calculated by using the ratio of the sum of patients with complete response and partial response to the sum of test patients.RRM1 genotype was tested by PCR and direct sequencing.The correlation between different genotypes and chemotherapy sensitivity was analyzed.RESULTS:Distribution frequency of RRM1-37C>A CC,CA,AA genotype were 35.42%,52.08%,12.50%,respectively;distribution frequency of-524C>T CC,CT,TT genotype were 18.75%,37.50%,43.75%,respectively.The frequency of each genotype was in the line with Hardy-Weinberg equilibrium(P>0.05).Chemotherapy sensitivity rate of 96 NSCLC patients was 37.50%.The patient’s age,sex,ethnicity,smoking or not,TNM stage,pathological type,chemotherapy plan,and the Eastern American Oncology Collaboration score were not associated with chemotherapy sensitivity(P>0.05).Chemotherapy sensitivity rates of RRM1(-37CA)+(-524CT)genotype and(-37CC)+(-524TT)genotype patients(57.14%,39.39%)were significantly higher than those of other genotype patients(10.71%),with statistical significance(P<0.05).There was no statistical significance in chemotherapy sensitivity rate between RRM1(-37CA)+(-524CT)and(-37CC)+(-524TT)genotype patients.CONCLUSIONS:In NSCLC patients,the SNPs of RRM1 can be used as predictive factor for the sensitivity of gemcitabine chemotherapy,and RRM1(-37CA)+(-524CT)and(-37CC)+(-524TT)genotype patients have higher sensitivity to this type of chemotherapy.
Non-small cell lung cancer;Ribonucleotide reductase M1 subunit;Single nucleotide polymorphisms;Gemcitabine;Chemotherapy sensitivity
R734.2
A
1001-0408(2017)35-4897-05
DOI10.6039/j.issn.1001-0408.2017.35.01
國家自然科學基金資助項目(No.81560381)
*碩士研究生。研究方向:腫瘤化療、生物免疫治療。電話:0993-2812389。E-mail:786415618@qq.com
#通信作者:主任醫師,教授,博士。研究方向:腫瘤綜合治療、藥物敏感性評價。電話:0993-2812389。E-mail:18999536479@163.com
2017-01-04
2017-10-15)
(編輯:張元媛)

