轉錄抑制因子鋅指蛋白57在乳腺癌中的表達及意義
鄭明潔, 王 水, 陳 列, 馬 哿
(南京醫科大學附屬第一醫院 乳腺外科, 江蘇 南京, 210029)
轉錄抑制因子鋅指蛋白57在乳腺癌中的表達及意義
鄭明潔, 王 水, 陳 列, 馬 哿
(南京醫科大學附屬第一醫院 乳腺外科, 江蘇 南京, 210029)
目的探討鋅指蛋白57(ZFP57)在乳腺癌中的表達及其與臨床病理的相關性。方法應用QPCR及Western Blot方法檢測乳腺癌細胞株中ZFP57表達,用QPCR方法檢測80例乳腺癌及癌旁組織中ZFP57表達,并分析與臨床及病理結果的相關性。結果在5種乳腺癌細胞(MDA-MB-231、SUM1315、T47D、MCF-7以及ZR-75-1)中, mRNA水平ZFP57相對表達量分別是(2.866±0.1986)、(1.000±0.0993)、(6.362±0.2970)、(10.150±0.4218)、(7.8000±0.421),蛋白水平相對表達量為(2.689±0.0905)、(1.018±0.0561)、(7.044±0.1232)、(9.328±0.2981)、(7.390±0.2332),差異有統計學意義(P<0.05)。在80例乳腺癌組織中ZFP57的相對表達水平為(0.0558±0.0101),與癌旁組織中ZFP57的相對表達水平(0.1708±0.0267)比較有顯著差異(P<0.05)。臨床病理分析結果顯示,無淋巴結轉移的患者為(0.0707±0.0138),與有淋巴結轉移的患者(0.0209±0.0064)比較有顯著差異(P<0.05)。腫塊≤2 cm為(0.0957±0.0215), 2~5 cm為(0.0418±0.0111), >5 cm為(0.0198±0.0097),差異有統計學意義(P<0.05)。結論ZFP57在乳腺癌中表達明顯下降,其表達與腫瘤大小以及淋巴結轉移程度呈負相關。
鋅指蛋白57; 乳腺癌; 淋巴結轉移
乳腺癌是女性最常見的惡性腫瘤之一,其發病率和死亡率均位于女性惡性腫瘤前列[1]。對乳腺癌相關標志物的預測研究仍是當前研究的熱點之一。腫瘤微環境對腫瘤的生物學特性有著重要的調節作用。在前期的研究中,作者建立了人源性乳腺微環境模型,該模型由于具備了組織特異性和種屬特異性,更接近于臨床,能更好地模擬乳腺癌的增殖和轉移[2]。在該模型基礎上獲得了受到人源性乳腺微環境調控的靶點基因譜,其中鋅指蛋白57(ZFP57)在人源性微環境調控下表達明顯下調[3]。
ZFP57基因是一種轉錄抑制因子,定位于6號染色體,ZFP57蛋白由536個氨基酸組成,其中包含一個KRAB域和7個鋅指結構,它所包含的KRAB結構域,能夠與Trime28結合形成轉錄抑制復合體,再與啟動子區結合以維持基因印記來調控印記基因的轉錄[4-5]。近年來,國外少量研究[6-7]提示該基因可能與纖維肉瘤、腦膠質瘤具有一定相關性。本研究探討ZFP57在乳腺癌組織中的表達及臨床意義,現將結果報告如下。
1 材料與方法
1.1 組織標本的收集
選取南京醫科大學第一附屬醫院2015年8月—2016年12月具有完整病例資料的乳腺浸潤性導管癌患者的病理組織80例,每例患者手術取切除的乳腺癌組織5 mm ×5 mm ×5 mm, 同時取其距離癌組織邊緣2 cm以上的癌旁組織5 mm ×5 mm ×5 mm。詳細記錄患者的性別、年齡及臨床病理特征,患者在手術前未進行任何的放療或化療等抗癌治療。
1.2 細胞培養
本實驗使用的細胞株SUM1315由密歇根大學的Stephen Ethier教授惠贈, MDA-MB-231、T47D、MCF-7以及ZR-75-1購自美國標準菌種收藏所(ATCC),這幾株細胞均是目前乳腺癌研究中最常用的細胞株。細胞體外培養時使用的是含有10%胎牛血清和1%青霉素-鏈霉素雙抗的DMEM培養基,培養時呈上皮樣貼壁生長。
1.3 引物設計合成
用 Primer 5.0軟件進行分析設計PCR引物,交由上海生工生物工程技術服務有限公司合成。引物序列如下: β-actin forward: 5′-GCATCGTCACCAACTGGGAC-3′; β-actin reverse: 5′-ACCTGGCCGTCAGGCAGCTC-3′; ZFP57 forward: 5′-CAGAGGGTCCTTTACCAGGAT-3′; ZFP57 reverse: 5′-CTCTCAGACTGGGATGTTGTTC-3′。
1.4 總RNA提取
① 從之前在液氮中取出5 mm ×5 mm ×5 mm的組織,放在EP管中用一次性研磨棒輕輕研磨至勻漿狀。同樣乳腺癌細胞經胰酶溶解,消化,離心置于EP管中,加入1 mL Trizol試劑,室溫靜置5 min。② 加入200 μL氯仿,振蕩15 s, 室溫靜置5 min, 在低溫高速離心機以4 ℃、12 000 r/min離心15 min。③ 吸取上層液體轉至另一新EP管中,加入500 μL異丙醇,混勻后室溫靜置10 min, 4 ℃、12 000 r/min離心10 min。④ 棄上清,加入1 mL 75%乙醇,置于4 ℃、10 000 r/min離心5 min, 棄上清。⑤加入DEPC處理后的水20~40 μL, 經反復吹打溶解RNA。⑥ 取2 μL抽提的RNA加入98 μL 0.1% DEPC滅活RNA酶的去離子水中。⑦ 用反轉錄試劑盒將總RNA反轉錄為cDNA,cDNA可直接用于RNA擴增。
1.5 實時定量熒光PCR
① 每個cDNA樣本都稀釋10倍(5 μL cDNA + 45 μL H2O)引物mixture(引物的F和R在同一管中),濃度各為5 pmol/μL。② 上樣: 一個樣本做3個復孔,用移液器移至96孔板中。反應體系: 2×的RTmix 10 μL; 模板(cDNA稀釋10倍)1 μL; 引物F和R各5 pmol/μL mix 2 μL; DEPC 水 7 μL; 共20 μL。③ PCR反應程序: 95 ℃, 10 min; 95 ℃, 10 s, 40個循環; 58 ℃退火,15 s; 72℃延伸,45 s。④ 每個樣品做3個副孔,以β-actin基因作為內參。結果以基因的相對表達量即2-△△CT進行比較。
1.6 蛋白印記
分別提取各乳腺癌細胞的總蛋白,用BCA蛋白濃度測定試劑盒測定蛋白濃度,上樣總蛋白50 μg, 經8%SDS聚丙烯酰胺凝膠電泳后,濕轉法將凝膠轉移到NC膜。將膜用5%脫脂牛奶封閉1 h后加入SNCG一抗(1∶1 000稀釋),置于搖床上4℃孵育過夜。次日,膜用TBST洗滌3次,每次10 min,洗膜后加入二抗(1∶3 000稀釋),再次TBST洗滌3次,每次10 min, 用超敏ECL化學發光試劑(購于Pierce公司)檢測蛋白條帶,最后用Image J軟件對蛋白條帶進行灰度分析。
1.7 統計學分析
數據分析采用GraphPad Prism 5.0的統計包,對于兩組間的比較,采用了t-檢驗,P<0.05(雙側)。對于多組數據間的比較采取單因素方差分析,P<0.05(雙側)。使用QPCR檢測結果, ZFP57在乳腺癌細胞及臨床標本中的相對表達量采用2-△△CT表示。
2 結 果
2.1 ZFP57在乳腺癌細胞中的表達水平分析
QPCR法檢測發現,在5種乳腺癌細胞(MDA-MB-231、SUM1315、T47D、MCF-7以及ZR-75-1)中,ZFP57相對表達量分別是(2.866±0.1986)、(1.000±0.0993)、(6.362±0.2970)、(10.15±0.4218)、(7.800±0.6797),相對于SUM1315,其余4種細胞的表達量均有顯著差異(P<0.05)。見圖1A。
Western法檢測發現,在5種乳腺癌細胞(MDA-MB-231、SUM1315、T47D、MCF-7以及ZR-75-1)中, ZFP57相對灰度值分別是(2.689±0.0905)、(1.018±0.0561)、(7.044±0.1232)、(9.328±0.2981)、(7.390±0.2332),相對于SUM1315, 其余4種細胞的表達量均有顯著差異(P<0.05)。見圖1B、C。
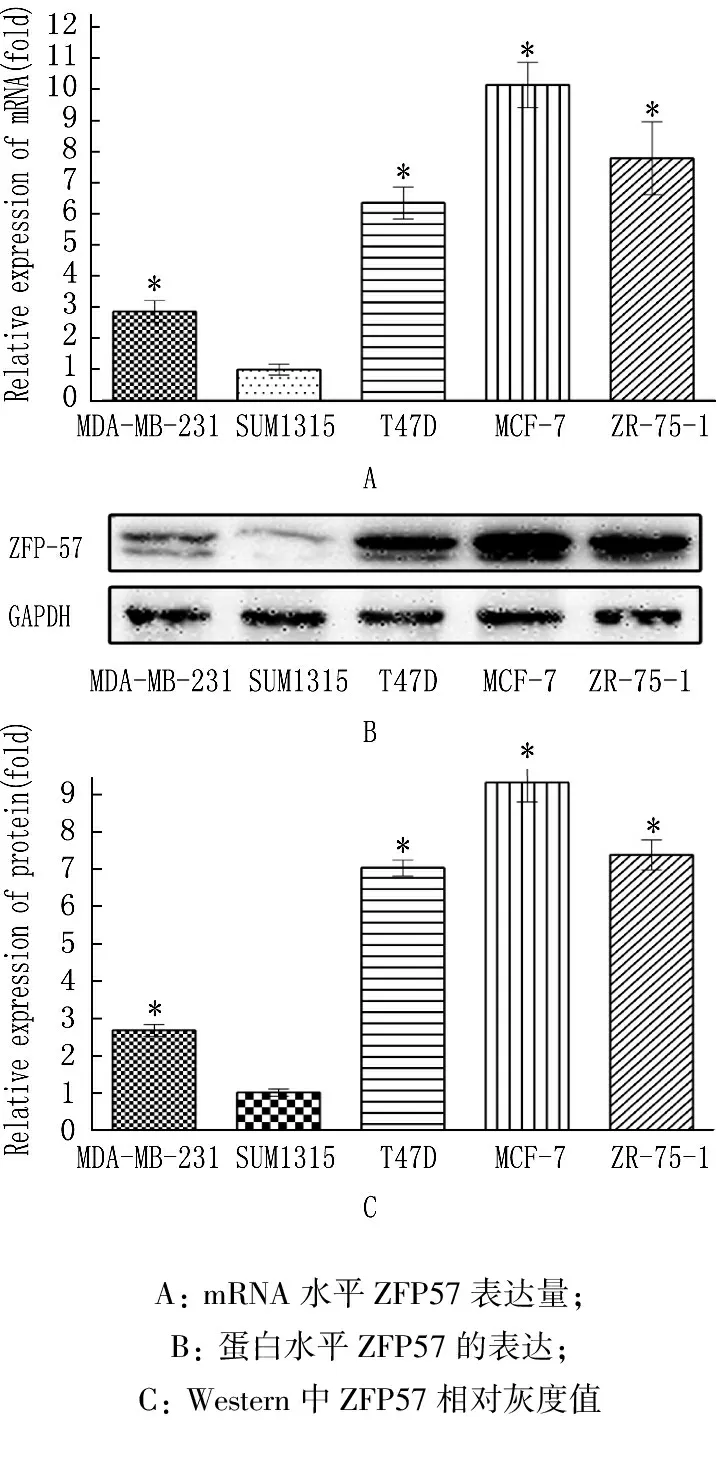
圖1 ZFP57 在乳腺癌細胞中的表達
2.2 ZFP57在臨床組織標本中表達水平分析
QPCR法檢測發現, 80例乳腺癌患者的癌組織內ZFP57的相對表達水平為(0.0558±0.0101), 80例乳腺癌患者的癌旁組織ZFP57的相對表達水平為(0.1708±0.0267), 差異有統計學意義(P<0.05)。見圖2。
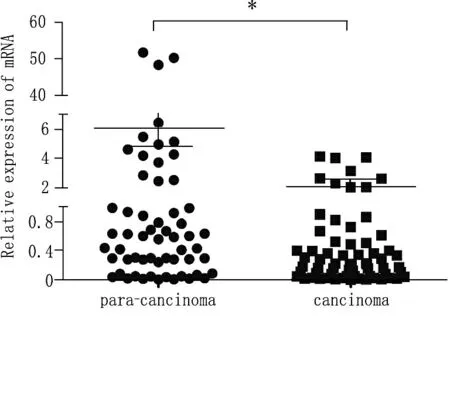
圖2 ZFP57 在乳腺癌及癌旁組織中的 相對表達量,* P < 0. 05
2.3 乳腺癌組織中ZFP57表達與臨床病理參數的關系
根據不同臨床及病理分類,作者發現乳腺癌組織中ZFP57相對表達量在≤50歲患者為(0.0496±0.0101), >50患者為(0.0626±0.0183), 差異無統計學意義(P=0.528)。絕經前患者為(0.0601±0.0121), 絕經后患者為(0.0527±0.0151), 差異無統計學意義(P=0.720)。無淋巴結轉移的患者為(0.0707±0.0138), 有淋巴結轉移的患者為(0.0209±0.0064), 差異有統計學意義(P=0.023)。腫塊≤2 cm為(0.0957±0.0215), 2~5 cm為(0.0418±0.0111), >5 cm為(0.0198±0.0097), 差異有統計學意義(P=0.013)。根據分子分型, Luminal A型為(0.0782±0.0238), Luminal B型為(0.0579±0.0167), HER-2陽性型為(0.0359±0.0165), 三陰性型為(0.0484±0.0164), 差異無統計學意義(P=0.730)。
3 討 論
本研究中,作者首次探討了鋅指蛋白57(ZFP57)在乳腺癌組織及細胞中的表達情況,結果發現乳腺癌組織中ZFP57的表達水平明顯低于癌旁乳腺組織。在與臨床及病理的相關性分析中,作者發現ZFP57的表達量與腫塊大小及淋巴結轉移情況具有顯著相關性,腫塊較大以及出現淋巴結轉移和乳腺癌組織中ZFP57表達量更低。同時,細胞實驗的結果顯示,在惡性度較低的MCF7中ZFP57表達較高,而在易于轉移的MDA-MB-231和SUM1315乳腺癌細胞株中表達較低。以上結果說明了ZFP57在乳腺癌中可能存在抑癌及抑制腫瘤轉移的作用。
有研究[4-5]表明, ZFP57基因作為一種轉錄抑制因子,與Trime28結合形成轉錄抑制復合體,再與啟動子區結合以維持基因印記來調控印記基因的轉錄。基因印記是指體細胞來源于不同親代的一對等位基因發生的差異性表達,即機體僅表達來自親本一方的等位基因,而另一方不表達或很少表達。它是表觀遺傳學中重要的組成部分。在維持印記基因正常印記中,印記控制區(ICR)起重要作用。印記控制區是一組富含CpG島的序列,該區域的甲基化水平在兩條等位基因中存在差異。當子代細胞同時獲得來自父源和母源的等位基因,其中一條表現為高甲基化,而另一條甲基化程度較低,造成這兩條等位基因表達的差異[6-8]。這種一方基因高甲基化的形成就與ZFP57密切相關。ZFP57與Trime28結合形成的轉錄抑制復合體在細胞核內與印記基因的印記控制區相連接,防止DNA的主動去甲基化,同時在甲基轉移酶的參與下維持印記基因的父源或母源的高甲基化。當ZFP57表達缺失或下調,其調控的下游印記基因的差異性表達就難以維持,從而造成印記缺失,表達異常[9]。
研究[10]發現,腫瘤中普遍存在印記基因的單等位基因調控缺失(LOI)。在正常組織中,印記基因的單等位基因甲基化,從而使表達處于中等水平。當單等位基因的甲基化無法維持,就會出現雙等位基因的普遍低甲基化,導致印記基因高表達。同時研究[11-12]表明多種惡性腫瘤中都存在印記缺失的現象,在病理級別高和更易于轉移的腫瘤中印記基因的印記缺失比例更高。本研究發現,乳腺癌中ZFP57的表達較正常組織明顯下降,這可能是腫瘤的異質性決定的,來源于不同組織不同器官的腫瘤發生機制均存在差異[13]。由于采用的病例數量有限,本研究仍存在一定的局限性,如作者發現ZFP57的表達與分子分型并無顯著相關性,可能在增加樣本量的情況下會出現不同的結果。
綜上所述,轉錄抑制因子ZFP57在乳腺癌中表達明顯下降,同時其表達與腫瘤大小以及淋巴結轉移程度呈負相關的特征。該基因在乳腺癌中表達異常的發現可能成為新的乳腺癌相關標志物,并作為靶點基因運用于乳腺癌的治療。
[1] Siegel R L, Miller K D, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30.
[2] Zheng M J, Wang J, Xu L, et al. Human mammary microenvironment better regulates the biology of human breast cancer in humanized mouse model[J]. Med Oncol, 2015, 32(2): 427-4.
[3] Zheng M, Wang J, Ling L, et al. Screening and analysis of breast cancer genes regulated by the human mammary microenvironment in a humanized mouse model[J]. Oncol Lett, 2016, 12(6): 5261-5268.
[4] Liu Y, Toh H, Sasaki H, et al. An atomic model of Zfp57 recognition of CpG methylation within a specific DNA sequence[J]. Genes Dev, 2012, 26(21): 2374-9.
[5] Takikawa S, Wang X, Ray C, et al. Human and mouse ZFP57 proteins are functionally interchangeable in maintaining genomic imprinting at multiple imprinted regions in mouse ES cells[J]. Epigenetics, 2013, 8(12): 1268-79.
[6] Tada Y, Yamaguchi Y, Kinjo T, et al. The stem cell transcription factor ZFP57 induces IGF2 expression to promote anchorage-independent growth in cancer cells[J]. Oncogene, 2015, 34(6): 752-60.
[7] Cirillo A, Di SA, Petillo O, et al. High grade glioblastoma is associated with aberrant expression of ZFP57, a protein involved in gene imprinting, and of CPT1A and CPT1C that regulate fatty acid metabolism[J]. Cancer Biol Ther, 2014, 15(6): 735-41.
[8] Jelinic P, Shaw P. Loss of imprinting and cancer[J]. J Pathol, 2007, 211(3): 261-8.
[9] Mackay D J, Temple I K. Transient neonatal diabetes mellitus type 1[J]. Am J Med Genet C, 2010, 154C(3): 335-42.
[10] Varmuza S, Miri K. What does genetics tell us about imprinting and the placenta connection[J]. Cell Mol Life Sci, 2015, 72(1): 51-72.
[11] Vennin C, Spruyt N, Robin Y M, et al. The long non-coding RNA 91H increases aggressive phenotype of breast cancer cells and up-regulates H19/IGF2 expression through epigenetic modifications[J]. Cancer Lett, 2017, 385: 198-206.
[12] Ribarska T, Goering W, Droop J, et al. Deregulation of an imprinted gene network in prostate cancer[J]. Epigenetics, 2014, 9(5): 704-17.
[13] Marusyk A, Polyak K. Tumor heterogeneity: causes and consequences[J]. Biochim Biophys Acta, 2010, 1805(1): 105-17.
Expressionoftranscriptioninhibitorzincfingerprotein57inbreastcanceranditsclinicalsignificance
ZHENGMingjie,WANGShui,CHENLie,MAGe
(DepartmentofBreastSurgery,TheFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing,Jiangsu, 210029)
ObjectiveTo investigate the expression of zinc finger protein 57 (ZFP57) in breast cancer and its clinical significance.MethodsThe ZFP57 expressions were detected by quantitative real-time PCR(QPCR) and Western Blot technique. And its expressions in breast cancer and para-tumorous tissues in 80 patients were detected by QPCR method, and its correlation with clinical and pathogenic results were explored.ResultsIn these breast cancer cells (MDA-MB-231, SUM1315, T47D, MCF-7 and ZR-75-1), the expression contents of ZFP57 in mRNA level detected by QPCR was (2.866±0.1986), (1.000±0.09928), (6.362±0.2970), (10.15±0.4218), (7.800±0.6797), respectively, (P<0.05), while in protein level was (2.689±0.09051), (1.018±0.05613), (7.044±0.1232), (9.328±0.2981), (7.390±0.2332), respectively, and the differences were statistically significant (P<0.05). The average expression of ZFP57 in breast carcinoma was (0.0558±0.0101), while was (0.1708±0.0267) in para-carcinoma and they showed significant differences (P<0.05). The clinical pathogenic analysis revealed that there were significant differences in the average expression of ZFP57 in breast carcinoma without lymph nodes involvement and with lymph nodes involvement [(0.0707±0.0138) vs. (0.0209±0.0064),P<0.05]. The average expression of ZFP57 in masses smaller than 2 cm was (0.0957±0.0215), was (0.0418±0.0111) in masses between 2~5cm, and (0.0198±0.0097) in masses larger than 5 cm, which showed significant differences (P<0.05).ConclusionThe expression of ZFP57 in breast carcinoma is decreased. And the expression of ZFP57 is negatively correlated with the lymph nodes involvement and the size of masses.
Zinc finger protein 57; breast cancer; lymph node involvement
2017-07-10
國家自然科學基金青年基金資助項目(81702607); 江蘇省自然科學基金青年基金資助項目(BK20151023)
R 737.9
A
1672-2353(2017)23-053-04
10.7619/jcmp.201723016

