傳染性胰壞死病毒的生物學研究進展
賀文斌,趙景壯,盧彤巖,尹家勝,徐黎明
(1.中國水產科學研究院黑龍江水產研究所,黑龍江 哈爾濱 150070;2.上海海洋大學水產與生命學院,上海 201306)
傳染性胰壞死病毒的生物學研究進展
賀文斌1,2,趙景壯1,盧彤巖1,尹家勝1,徐黎明1
(1.中國水產科學研究院黑龍江水產研究所,黑龍江 哈爾濱 150070;2.上海海洋大學水產與生命學院,上海 201306)
傳染性胰壞死病(infectious pancreatic necrosis,IPN)是一種危害多種水產動物的急性傳染性疫病,能造成鮭鱒稚魚大量死亡,造成世界范圍內鮭鱒養殖業重大經濟損失。IPN的病原為雙鏈RNA病毒科(Birnaviridae)水生雙鏈RNA病毒屬(Aquabirnavirus)的傳染性胰臟壞死病毒(infectious pancreatic necrosis virus,IPNV)。本文概述了該病原的基因組結構、生物學特征、診斷技術及免疫防治等研究進展,以期為IPN的防治提供參考。
傳染性胰壞死病毒(IPNV);水生雙鏈RNA病毒;基因型;血清型;鮭鱒
傳染性胰壞死病毒(Infectious pancreatic necrosis virus,IPNV)主要感染鮭鱒稚魚,一般在春季暴發,水溫10℃時最易感染[1]。由于毒株、宿主和環境因素的不同,IPNV可造成虹鱒Oncorhynchus mykiss 10%~90%的死亡率[2,3]。病魚常具有食欲減退、體色發黑、眼球突出、腹部腫脹、肛門紅腫等癥狀,解剖后可見胰腺壞死、腎臟腫大、腸內有粘液狀滲出物、腹水等癥狀。晚期病魚的肝臟和鰓上皮組織嚴重出血,肝臟和胰臟細胞核固縮,出現空泡變性,胰腺中有炎癥細胞浸潤的脂肪組織發生彌散性壞死。感染IPNV幸存的魚可不再發病,但是終生攜毒,依然能傳染病毒。IPNV可通過攜帶病毒的水體、網具、容器、染病魚的排泄物和精液進行水平傳播,也可由親代通過受精卵(無癥狀的攜病毒魚卵或懷卵魚被病毒感染)對子代進行垂直傳播。
1 IPNV基因組結構
IPNV病毒顆粒呈20面體,無囊膜,有92個殼粒,直徑67nm[4]。衣殼內有由2個片段組成的雙股RNA基因,片段A編碼一個多聚蛋白,包括VP2、VP3、VP4,并通過間隔的ORF編碼一個非結構蛋白VP5;片段B編碼一個依賴于RNA的RNA聚合酶(VP1)[5]。VP2蛋白是IPNV的主要外衣殼蛋白,含有病毒的主要抗原決定簇,并含有病毒特異性中和抗原表位[6],經常用于病毒的診斷、血清型分類及疫苗設計。
2 IPNV生物學特征
2.1 基因型分型
用MegAlign軟件分析基因型,以VP2基因片段為目標基因,同GenBank收錄的其他國家IPNV分離株及部分水生雙RNA病毒進行VP2核苷酸序列同源性分析。Blake等[7]證明,IPNV病毒基于VP2氨基酸序列可分為6個基因組genogroups(1-6)。一些研究者認為,海洋雙RNA病毒應該形成一個新的基因組genogroup7[8,9],Ji等[10]對一株分離于虹鱒的中國IPNV毒株ChRtm213采用鄰位相鄰法構建了IPNV的系統進化樹(圖1)。該進化樹清晰地將目前水生雙RNA病毒分為7個基因組。
2.2 血清分型
水生雙RNA病毒含有10個血清型,包括A組血清型 A1 (West Buxton,WB)、A2(Spajarup,Sp)、A3(Abild,Ab)、A4(Hecht,He)、A5(Tellina,Te)、A6(Canada1,C1)、A7(Canada2,C2)、A8(Canada3,C3)和 A9 (Jasper,Ja),B 組 血 清 型 B1(Tellinavirus,TV-1)。根據IPNV的多聚蛋白氨基酸序列,可將IPNV分為 6個基因簇(Genogroup 1-6),其中Genogroup1對應血清型為A3,Genogroup 2為A5和A6,Genogroup3 為 A2,Genogroup 4 為 A7 和 A8,Genogroup5 為 A1 和 A9,Genogroup6 為 A4[11,12],見表1。血清型A1主要出現在美國,血清型A6-A9主要出現在加拿大,血清型A2-A5和B1多出現在歐洲和亞洲[13]。中國早期IPNV分離株血清型均為A2(Sp),病毒滴度高,具有很高的致死性[14]。劉淼等[15]于2013年從云南某虹鱒養殖場的發病魚分離出一株IPNV(命名為ChRtm213)。系統發育分析結果表明,該ChRtm213分離株屬于Genogroup5基因型,與A1(Ja)血清型的美國的VR299、西班牙的2310株的VP2具有較高相似度。上述研究結果說明,目前中國至少有兩種血清型的IPNV毒株。
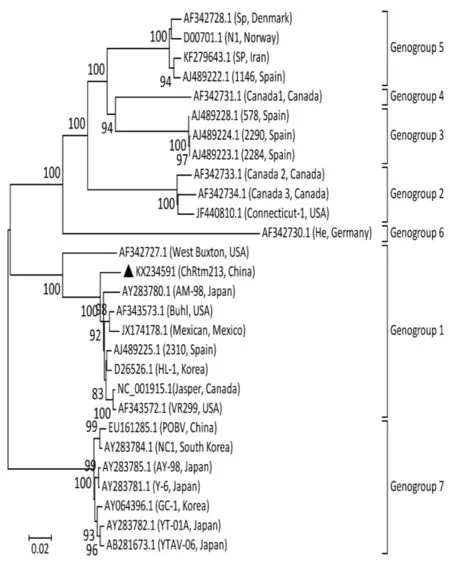
圖1 基于ChRtm213與其他水生雙RNA病毒A片段基因組序列同源性分析構建的進化樹Fig.1 Phylogenetic relationship of ChRtm213 and other reference aquabirnaviruses strains based on complete genome of segment A using the neighborjoining method
3 IPNV診斷技術
3.1 聚合酶鏈式反應(Polymerase Chain Reaction,PCR)
逆轉錄聚合酶鏈式反應法(Reverse transcription Polymerase Chain Reaction,RT-PCR)根據特定病毒的核苷酸序列設計特異性引物,然后擴增核酸以檢測病毒[16]。吳斌等[17]針對IPNVA片段VP5基因和VP3基因分別設計了兩對特異性引物,建立了成熟的IPNV RT-PCR檢測法。熒光定量RT-PCR檢測法是一種對PCR反應中的循環產物熒光信號的實時檢測和對起始模板進行定性定量分析的高靈敏檢測方法。徐曄等[18]建立了Taqman探針熒光定量RT-PCR檢測IPNV的方法,引物和探針只與IPNV的核酸特異性結合,與鯉春病毒血癥病毒(Spring viraemia ofcarp virus,SVCV)、病毒性出血性敗血癥病毒(Viral hemorrhagic septicemia virus,VHSV)、傳染性造血器官壞死病毒(Infectious hematopoietic necrosis virus,IHNV)、草魚草魚呼腸孤病毒(Grass carp reovirus,GCRV)和流行性造血器官壞死病毒(Epizootic haematopoietic necrosis virus,EHNV)均無交叉反應。
3.2 環介導等溫擴增法(Loop-mediated isothermal amplification,LAMP)
LAMP是一種新型體外等溫擴增特異核酸片段的技術[19]。與常規PCR相比,不需要對模板進行熱變性、溫度循環、電泳及紫外觀察過程。不用專門的儀器設備就可實現現場高通量快速檢測,具有簡單、快速、特異性強的特點。在LAMP的基礎上可使用逆轉錄LAMP(RT-LAMP)對特異RNA分子進行等溫快速擴增。Soliman[20]將RT-LAMP引入到病毒檢測中,并向反應產物中添加SYBR Green I熒光染料,建立了IPNV的RT-LAMP可視化檢測方法。
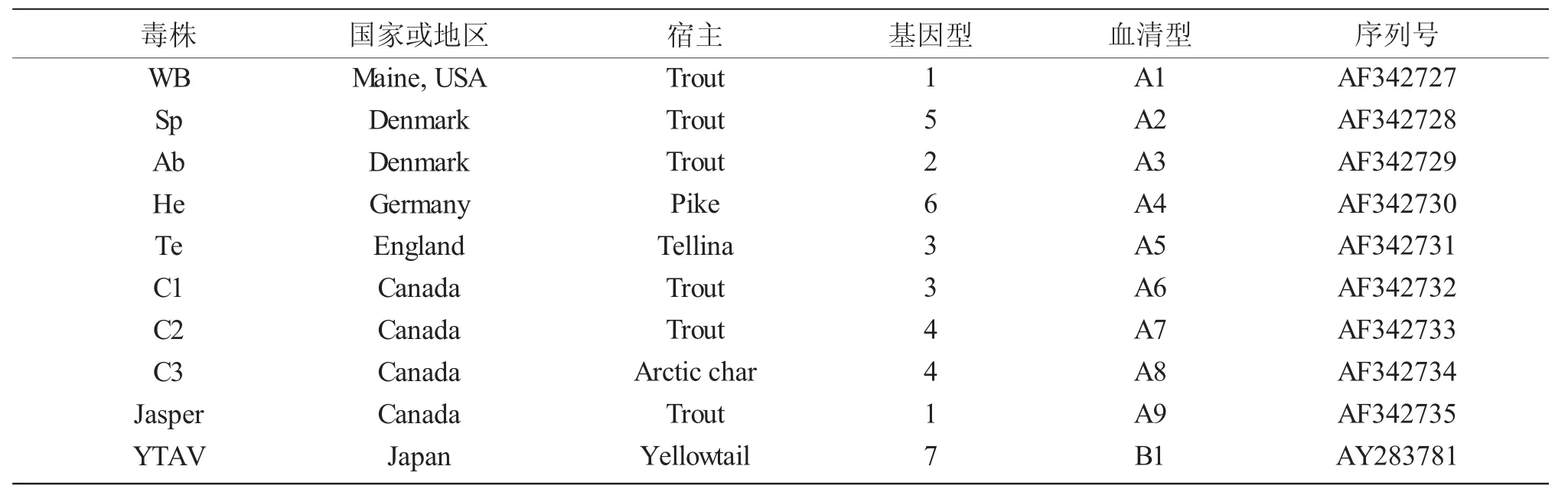
表1 水生雙RNA病毒的生物學分類Tab.1 Biological classification of aquabirnaviruses
3.3 酶聯免疫吸附測定法(enzyme-linked immunosorbent assay,ELISA)
以上方法靈敏度高,但需要檢測儀器,存在變異性,用于檢測臨床樣本的穩定性較低。相比較,單克隆抗體具有均質性好和易于標準化生產的優點。王健楠等[21]擴增了IPNV-ZYX分離株結構蛋白VP2的抗原表位區基因(616 bp),命名為IPNV VP2 COE,VP2 COE蛋白可作為IPNV的診斷抗原,為間接免疫熒光檢測IPNV方法的建立提供了更加現實的理論依據。連科訊等[22]利用純化的IPNVVP2 COE重組蛋白作為免疫原免疫小鼠,將小鼠的脾細胞與骨髓瘤SP2/0細胞融合,采用間接ELISA篩選雜交瘤細胞,制備的特異性單抗可應用于間接免疫熒光法檢測IPNV。
單克隆抗體法檢測IPNV病毒為更深入研究奠定了基礎。張琳琳等[23]利用鼠抗IPNV VP2單抗及兔抗IPNV VP2建立了雙抗體夾心ELISA檢測法。試驗中獲得抗體較純,克服了同屬抗體之間的交叉反應及同株抗體捕獲抗原能力弱的缺點,提高了檢測的特異性,減少了假陽性結果。該方法適合于基層現場檢驗需要,已應用于動物疫病的臨床診斷。
3.4 免疫熒光法(immunological fluorescence as-say test,IFAT)
用熒光抗體示蹤或檢查相應抗原的方法稱熒光抗體法,也叫免疫熒光法。Xu等[24]采用抗原抗體共表達的顯示技術,配合使用流式細胞儀檢測熒光信號,便捷而準確地獲得IPNV ChRtm213的單鏈抗體(single-chain antibodyfragment,scFv)。實驗證明,該scFv可以特異性識別IPNV ChRtm213,能作為診斷試劑檢測IPNVChRtm213。
3.5 核酸探針與基因芯片
核酸探針是繼免疫學診斷技術之后發展起來的新技術。有用32P標記的寡核苷酸DNA探針[25]、多核苷酸cDNA探針[26]和用生物素標記的寡核苷酸DNA探針[27]等快速檢測IPNV的研究。基因芯片是一種生物芯片,將大量探針分子固定后與標記的樣品分子進行雜交,通過檢測探針分子的雜交信號強度來獲取樣品分子的數量和序列信息。王勝強等[28]建立的基因芯片檢測技術能夠在一個微陣列中與7種病毒10個基因的標記擴增產物同時雜交,可以同步檢測包括IPNV在內的7種重要的養殖魚類病毒,具有通量高、特異性強的優勢。
4 IPNV免疫防治
4.1 免疫原理
疫苗是有效防治IPNV的重要措施。IPNV病毒疫苗多基于VP2和VP3等結構蛋白的基因,VP2蛋白攜帶決定病毒毒力和適應細胞培養的因子[29]。以往的研究證實,VP2蛋白的217~221氨基酸殘基與病毒毒力相關[30]。表達的VP2蛋白可在宿主細胞中自我組裝亞病毒顆粒,對虹鱒注射純的VP2亞病毒顆粒或喂食含有重組蛋白的載體菌,都可以引起魚的特異性免疫反應,誘導魚體產生抗體,降低IPNV侵染的病毒載量和患病率[31]。VP3也是IPNV重要的功能蛋白。Moon等[32]分別將VP3基因和VP2基因在大腸桿菌中表達純化后免疫虹鱒。ELISA和中和試驗檢測免疫后虹鱒血清的抗體效價,發現VP3蛋白也具有很好的免疫原性。趙麗麗等[33]構建的重組質粒pET30b-VP3在大腸桿菌BL21中表達,通過Western-blotting以及ELISA檢測表明,表達的融合蛋白與天然VP3蛋白一樣具有免疫原性和反應原性。劉巍巍等[34]對IPNV VP3基因的分段表達及其抗原表位區域分析進一步精確定位VP3蛋白抗原表位奠定了基礎。開發基于IPNV結構蛋白的多聯亞單位疫苗是防控IPNV的重要方向[35]。
4.2 免疫方法
理想的疫苗應在早期接種以產生持久的保護,對幼齡魚進行口服或浸泡免疫更適用于早期接種。而免疫效果與免疫方法和免疫劑量均有關系[36]。不同抗原運載系統疫苗的作用功效也不同[37]。de las Heras等[38]與Natalia A等[39]將IPNV的VP2疫苗包被在海藻酸鹽顆粒中,口服免疫虹鱒后保護率分別達80%和78%~85.9%。Miguel Reyes等[40]將 DNA疫苗添加到飼料中口服免疫大西洋鮭Salmon salar,免疫組與非免疫組的體重和長度相近,表明該疫苗沒有影響腸道功能和干擾營養吸收。Arun K Dhar等[41]將人類癌基因的抗原表位c-myc克隆后在酵母中表達,發現IPNV rVP2的SVP能耐受插入外來抗原基,不影響其蛋白質或插入的外來抗原表位的抗原表達,這為開發IPNVrVP2SVP多價疫苗奠定了基礎。還有用鮭氣單胞菌Aeromonas salmonicida[42]和乳酸菌Lactobacillus等表達的疫苗免疫大西洋鮭。劉敏等[43]將IPNV的VP2、VP3基因插入到乳酸菌表達載體中,構建重組干酪乳桿菌,誘導表達后口服免疫虹鱒幼魚,誘導虹鱒局部粘膜免疫和全身免疫反應,免疫后病毒載量顯著減少。
Skjesol等[44]發現,使用PKR激活促進細胞的病毒復制,而使用PKR抑制劑可減少病毒復制。免疫基因的死亡率和表達水平與病毒復制率、病毒基因序列有關。病毒基因組的快速變化可顯著降低病毒的增殖可能表明了較高的易感性的保護機制,即疾病的爆發和死亡率取決于宿主防御和病毒基因組特性[45]。有些疫苗雖然能刺激機體免疫反應產生抗體,但并不能產生有效的保護作用,而在試驗階段具保護作用的免疫制劑在生產中并不能真正起保護作用,這就亟待開發疫苗免疫效果的評價體系。除了免疫防治,國內外研究者也在尋找能夠抑制IPNV病毒的其他方法,如某些芳香衍生物對IPNV病毒復制具有抑制作用[46];一些乳制品蛋白質的早期酶解產物對IPNV具有一定的抗病毒活性[47]。Marroqui等[48]報道了霉酚酸(mycophenolic acid,MPA)能抑制次黃嘌呤核苷酸脫氫酶(Inosine 5′-monophosphate dehydrogenase,IMPDH) 而間接抑制細胞GMP的合成,使IPNV RNA的合成缺乏原料,抑制了IPNV的復制。
5 展望
IPN造成虹鱒高死亡率,嚴重威脅鮭鱒養殖業的健康發展,開發有效的疫苗是最有效的預防方法,需繼續對IPNV的感染機理、魚類免疫反應[49-51]等開展更加深入的研究。更加豐富的研究方法對IPN的防治技術也有重大意義,如用基因工程技術將抗原蛋白與受體結合蛋白、轉運蛋白以及信號肽融合,使抗原能夠精確定位到效應細胞[52],通過流式細胞術分析病毒感染后體內白細胞的變化,掌握病毒在體內的不同感染時期[53],采取針對性地的治療措施。
[1]王旭,顏其貴,雷燕.魚類傳染性胰腺壞死病的病毒學特征診斷及防治研究[J].水產科學,2010,29(9):559-562.
[2]EBiering,SVilloing,ISommerset,etal.Updateon viralvaccinesforfish[J].DevelopmentsinBiologicals,2005:121-113.
[3]RJ Roberts and MD Pearson.Infectious pancreatic necrosis in Atlantic salmon,Salmo salar L[J].Journal of Fish Diseases,2005,28(7):383-390.
[4]P Dobos P,B J Hill,R Hallett,et al.Biophysical and biochemical characterization of five animal viruses with bisegmented double-stranded RNA genomes[J].Journal of Virology,1979,32(2):593-605.
[5]葛均青,龔暉,陳超.水生動物雙RNA病毒的研究進展[J].武夷科學,2014(30):162-167.
[6]A Pyde,W T Melvin and A L Munro.Nucleotide sequence analysis of the serotype-specific epitope of infections pancreatic necrosis virus[J].Arch Virol,1993,129(1-4):287-293.
[7]S Blake,J Y Ma,D A Caporale,et al.Phylogenetic rela-tionships of aquatic birnaviruses based on deduced amino acid sequences of genome segment A cDNA[J].Diseases ofaquatic organisms,2001,45(2):89-102.
[8]T Isshiki,T Nagano and S Suzuki.Infectivity of aquabirnavirus strains to various marine fish species[J].Diseases ofAquatic Organism,2001,46(2):109-14.
[9]S J Jung,S R Kim,I Y Joung,et al.Distribution of Marine Birnavirus in Cultured Olive Flounder Paralichthys olivaceus in Korea[J].Journal of Microbiology,2008,46(3):265-273.
[10]F Ji,J ZZhao,MLiu,et al.Complete genomic sequence of an infectious pancreatic necrosis virus isolated from rainbow trout(Oncorhynchus mykiss) in China[J].Virus Genes,2016:215-225.
[11]L Zhu,X Wang,K Wang,et al.Outbreak of infectious pancreatic necrosis virus(IPNV)in farmed rainbowtrout in China[J].Acta Tropica,2017,170:63-69.
[12]R A Manríquez,T Vera,M V Villalba,et al.Molecular characterization of infectious pancreatic necrosis virus strains isolated from the three types of salmonids farmed in Chile[J].VirologyJournal,2017,14(1):14-17.
[13]MDadar,R Peyghan and H R Memari.Evaluation of the Bioaccumulation of Heavy Metals in White Shrimp(Litopenaeus vannamei)Along the Persian Gulf Coast[J].Bulletin of Environmental Contamination and Toxicology,2014,93(3):339-343.
[14]孫穎杰,陳文義,夏德昌,等.虹鱒魚傳染性胰臟壞死病毒的分離與鑒定[J].水產學雜志,1993,6(1):50-56.
[15]劉淼,徐黎明,趙景壯,等.虹鱒傳染性胰臟壞死病毒的分離鑒定及聚類分析[J].大連海洋大學學報,2017(1):56-61.
[16]江育林,徐伯亥,李偉,等.虹鱒傳染性胰臟壞死病毒(IPNV)的初步研究[J].水生生物學報,1989,13(4):353-358.
[17]吳斌,肇慧君,李葉,等.傳染性胰臟壞死病毒逆轉錄聚合酶鏈式反應法(RT-PCR)的研究[J].中國動物檢疫,2012,29(9):46-48.
[18]徐曄,段宏安,周毅,等.實時熒光定量RT-PCR檢測魚類傳染性胰臟壞死病病毒方法的建立[J].安徽農業科學,2011,39(31):19224-19226.
[19]TNotomi,H Okayama,H Masubuchi,et al.Loop-mediated isothermal amplification of DNA[J].Nucl Acids Res,2000,28(12):E63.
[20]H Soliman,P J Midtlyng and M EI-Matbouli.Sensitive and rapid detection of infectious pancreatic necrosis virus byreverse transcription loop mediated isothermal amplification[J].Journal of Virological Methods,2009,158(2):77-83.
[21]王健楠,趙麗麗,劉立月,等.傳染性胰腺壞死病病毒分離株VP2基因抗原表位區融合表達及免疫特性的分析[J].水產學報,2012,36(11):1770-1775.
[22]連科迅,趙麗麗,張琳琳,等.傳染性胰腺壞死病毒VP2 COE蛋白使用單克隆抗體的制備與初步應用[J].水產學報,2013,37(8):1229-1235.
[23]張琳琳,連科迅,張英,等.傳染性胰壞死病毒雙抗體夾心 ELISA檢測方法的建立[J].淡水漁業,2014,44(4):57-72.
[24]L MXu,J Z Zhao,MLiu,et al.Recombinant scFv antibodies against infectious pancreatic necrosis virus isolated byflowcytometry[J].JournalofVirologicalMethods,2016,237:204-209.
[25]E Rimstad,R Krona,E Hornes,et al.Detection of infectious pancreatic necrosis virus RNA by hybridization with an oligonucleotide DNA probe[J].Veterinary Microbiology,1990,23(1-4):211.
[26]C P Dopazo,F M Hetrick and S K Samal.Use of cloned cDNA probes for diagnosis ofinfectious pancreatic necrosis virus infectious[J].Journal of Fish Diseases,2006,17(1):1-16.
[27]周建玲,宮云浩.用生物素標記寡核苷酸DNA探針快速檢測魚傳染性胰臟壞死病病毒IPNV[J].水產學報,1995,19(4):310-314.
[28]王勝強,耿偉光,李晉,等.基因芯片檢測魚類病毒的方法建立與優化[J].中國動物檢疫,2015,32(7):77-84.
[29]HongJ R,GongH Y,Wu J L,et al.A novel Anti-apoptosis gene of the Bcl-2 family,regulates Mcl-l and viral protein expression[J].Virology,2002,295(2):217-229.
[30]H Song,N Santi,?ystein Evensen,et al.Molecular determinants of infectious pancreatic necrosis virus virulence and cell culture adaptation[J].Journal of Virology,2005,79(16):10289-10299.
[31]A J McBeath,M Snow,C J Secombes,et al.Expression kinetics ofinterferon and interferon-induced genes in Atlantic salmon (Salmo salar)following infection with infectious pancreatic necrosis virus and infectious salmon anaemia virus[J].Fish and Shellfish Immunology,2007,22(3):230-241.
[32]C H Moon,J W Do,S J Cha,et al.Comparison of the immunogenicity of recombinant VP2 and VP3 of infectious pancreatic necrosis virus and marine birnavirus[J].Archive ofVirology,2004,149(10):2059-2068.
[33]趙麗麗,劉敏,哈卓,等.傳染性胰腺壞死病毒VP3蛋白的原核表達及抗原性分析[J].水產學報,2010,34(4):604-610.
[34]劉巍巍,趙麗麗,趙永欣,等.傳染性胰腺壞死病毒VP3基因的分段表達及其抗原表位區域分析[J].淡水漁業,2011,41(4):61-65.
[35]A K Dhar,R MBowers,C G Rowe,et al.Expression of a foreign epitope on infectious pancreatic necrosis virus VP2 capsid protein subviral particle(SVP)and immunogenicity in rainbowtrout[J].Antiviral Research,2010,85(3):525-531.
[36]R BShivappa,P E McAllister,GH Edwards,et al.Development of a subunit vaccine for infectious pancreatic necrosis virus usinga baculovirus insect/larvae system[J].Developments in Biologicals,2005,12(121):165.
[37]Hetron M,Munang′andu,B?rge N,et al.Comparison of vaccine efficacy for different antigen delivery systems for infectious pancreatic necrosis virus vaccines in Atlantic salmon(Salmo salar L)in a cohabitation challenge model[J].Vaccine,2012,30(27):4007-4016.
[38]Heras AIDL,Saint-Jean S R and Pérez-Prieto S I.Immunogenic and protective effects of an oral DNA vaccine against infectious pancreatic necrosis virus in fish[J].Fish and Shellfish Immunology,2010,28(4):562-570.
[39]Ballesteros N A,Saint-Jean S S,Encinas P A,et al.Oral immunization of rainbow trout to infectious pancreatic necrosis virus (Ipnv)induces different immune gene expression profiles in head kidney and pyloric ceca[J].Fish&Shellfish Immunology,2012,33(2):174-85.
[40]Miguel Reyes,Cesar Ramírez,Ivan ?ancucheo et al.A novel“in-feed”delivery platform applied for oral DNA vaccination against IPNV enables high protection in Atlantic salmon(Salmon salar)[J].Vaccine,2017,35(4):626-632.
[41]Dhar A K,Bowers R M,Rowe,C G,et al.Expression of a foreign epitope on infectious pancreatic necrosis virus VP2 capsid protein subviral particle(SVP)and immunogenicity in rainbowtrout[J].Antiviral Research,2010,85(3):525-531.
[42]Kumari J,B agwald J and Dalmo R A.Vaccination Aeromonas salmonicida and infectious pancreatic of Atlantic salmon,Salmo salar L necrosis virus(IPNV)showed a with mixed Thl/Th2/Treg response[J].Journal ofFish Diseases,2013,36(10):881-886.
[43]劉敏,趙麗麗,葛俊偉,等.傳染性胰腺壞死病毒VP3蛋白的干酪乳桿菌表達系統構建[J].淡水漁業,2008,38(5):30-34.
[44]A Skjesol,T Hansen,C Y Shi,et al.Structural and functional studies of STAT1 from Atlantic salmon(Salmo salar)[J].BMCImmunology,2010,11(1):17.
[45]A Skjesol,I Skj?veland,MEln?s,et al.IPNV with high and low virulence:host immune responses and viral mutations during infection[J].Virology Journal,2011,8(1):396.
[46]B Modak,A MSandino,L Arata,et al.Inhibitory effect of aromatic geranyl derivatives isolated from Heliotropium filifolium on infectiouspancreatic necrosis virus replication[J].VeterinaryMicrobiology,2010,141(1-2):53-58.
[47]S S Rodríguez,S I Pérez Prieto,I Lópezexpósito,et al.Antiviral activity of dairy proteins and hydrolysates on salmonid fish viruses[J].International Dairy Journal,2012,23(10):24-29.
[48]L Marroqui,A Estepa and L Perez.Inhibitory effect of mycophenolic acid on the replication of infectious pancreatic necrosis virus and viral hemorrhagic septicemia virus[J].Antiviral Research,2008,80(3):332-338.
[49]H MMunang′Andu,S Mutoloki and ? Evensen.Acquired immunity and vaccination against infectious pancreatic necrosis virus of salmon[J].Developmental and Comparative Immunology,2014,43(2):184.
[50]H M Munang′Andu,B N Fredriksen,S Mutoloki,et al.The kinetics of CD4+gene expression correlate with protection in Atlantic salmon(Salmo solar)CD8+T cell vaccinated against infectious pancreatic necrosis[J].Vaccine,2013,31(15):1956-1963.
[51]A Kamil,A Raae,P G Fjelldal,et al.Comparative analysis ofIgMsub-variants in salmonid fish and identification ofa residue in μ3 which is essential for MAb4C10 reactivity[J].Fish and Shellfish Immunology,2013,34(2):667-72.
[52]Kuo T,Chen G H,Wu C,et al.Subunit vaccine for aquaculture:US,US8343505[P].2013.
[53]A R?nneseth,E F Pettersen and H I Wergeland.Flowcytometry assay for intracellular detection of infectious pancreatic necrosis virus(IPNV)in Atlantic salmon(Salmo salar L)leucocytes[J].Fish and Shellfish Immunology,2012,33(6):1292-1302.
Progress on Biological Research of Infectious Pancreatic Necrosis Virus:a Review
HE Wen-bin1,ZHAO Jing-zhuang1,LU Tong-yan1,YIN Jia-sheng1,XU Li-ming1
(1.Heilongjiang River Fishery Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Fishery and Life Science,Shanghai Ocean University,Shanghai 201306,China)
Infectious pancreatic necrosis (IPN)as an acute infectious disease of many aquatic animals,can cause high mortalities in worldwide salmon and trout fingerlings,whose pathogen,infectious pancreatic necrosis virus(IPNV),belongs to the Aquabirnavirus within the family Birnaviridae.This review summarizes the genomic structure,biological characteristics,diagnostic techniques and immunological control of the pathogen,in order to provide reference for the prevention and treatment of IPN.
infectious pancreatic necrosis virus (IPNV);Aquabirnavirus,aquatic double stranded RNA virus;genotype;serotype;salmon and trout
S941
A
1005-3832(2017)06-0001-06
2017-06-29
中央公益性事業單位基本科研業務費專項經費(HSY201514).
賀文斌(1992-),女,碩士研究生,從事魚類病毒學研究.E-mail:981073106@qq.com
徐黎明,女,博士,副研究員,從事魚類病毒學研究.E-mail:lmxu0917@163.com

