達氏鰉、施氏鱘及其雜交子代胚胎發育期的抗氧化酶活性
張穎 ,徐偉 ,孫大江 ,王斌 ,許式見 ,張鏡群 ,胡朝
(1.中國水產科學研究院黑龍江水產研究所,黑龍江 哈爾濱 150070;2.杭州千島湖鱘龍科技股份有限公司,浙江 杭州 310000;3.西藏自治區農牧科學院,西藏 拉薩 850000;4.四川省都江堰管理局,四川 都江堰 611830)
達氏鰉、施氏鱘及其雜交子代胚胎發育期的抗氧化酶活性
張穎1,3,徐偉1,孫大江1,王斌2,許式見2,張鏡群3,胡朝4
(1.中國水產科學研究院黑龍江水產研究所,黑龍江 哈爾濱 150070;2.杭州千島湖鱘龍科技股份有限公司,浙江 杭州 310000;3.西藏自治區農牧科學院,西藏 拉薩 850000;4.四川省都江堰管理局,四川 都江堰 611830)
利用形態學和生物化學的方法測定達氏鰉Huso dauricus、施氏鱘Acipenser schrenckii及其正反雜交子代的受精率、孵化率、出苗率與胚胎發育期間超氧化物歧化酶(SOD)、過氧化氫酶(CAT)等抗氧化酶活性,分析胚胎發育與抗氧化酶含量的關系。結果表明,達氏鰉與施氏鱘為雜交親和,可獲得正常發育的正反交后代,不影響受精率、孵化率及出苗率。不同胚胎發育期鱘的4種主導抗氧化酶類型及變化規律各不相同。在特定發育時期,達氏鰉(♀)與施氏鱘(♂)正交子代(大雜交鱘)的CAT等抗氧化酶活性和丙二醛(MDA)含量均接近或高于兩親本中較高的一方;而達氏鰉(♂)與施氏鱘(♀)反交子代(小雜交鱘)介于兩親本之間,特別是SOD、還原型谷胱甘肽(GSH)活性和MDA含量顯著低于其父母本。施氏鱘胚胎心臟搏動期SOD的活性最高,達氏鰉胚胎在卵黃栓期SOD的活性最高,而雜交子代的SOD活性均在囊胚期達最大值。綜上所述,4種鱘胚胎發育時期內源性抗氧化酶活性的表達差異在一定程度上可解釋物種間表型性狀的差異。
施氏鱘;達氏鰉;雜交子代;胚胎發育;抗氧化酶
達氏鰉Huso dauricus和施氏鱘Acipenser schrenckii是黑龍江流域特有的重要經濟魚類[1]。達氏鰉是世界上26種鱘科魚類中,生長速度最快和懷卵量最大的2種鰉屬魚類之一,經濟價值高。它性成熟晚,養殖個體大,養殖數量受限[2]。施氏鱘為我國第一個自主開發的養殖鱘,易馴養、性成熟早,但個體生長速度和懷卵量均小于達氏鰉。因此,研究達氏鰉和施氏鱘種屬間雜交子代的生物學特性有望獲得具有養殖優勢的鱘新品種。
魚類早期發育過程中,胚胎細胞的氧化代謝可產生·OH、O-2·等活性氧分子(Reactive oxygen species,ROS)[3,4]。自然狀態下,組織內的自由基清除酶類和抗氧化劑等防御系統可清除活性氧分子,維持體內氧化代謝平衡[4,5]。而在一些損傷環境作用下,胚胎細胞內的氧化代謝物增加,或細胞中抗氧化保護機制不足時活性氧堆積,對胚胎細胞產生毒性,阻滯或延遲胚胎發育[5,6]。研究證實,卵母細胞及胚胎細胞內均含有超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(Glutathione peroxidase,GPX)等物質的轉錄本,這些物質對維持胚胎發育過程中活性氧的動態平衡,保證胚胎正常發育,提高苗種成活率等具有重要的作用[6,7]。對哲羅鮭Hucho taimen胚胎發育過程中內源性抗氧化酶活性的研究表明,SOD等抗氧化酶的活性在胚胎的發生與發育過程中具有特異性變化,表明魚類胚胎的發生發育與其體內超氧化物自由基的清除有關[7]。本研究采用生物化學方法,研究SOD、GSH和丙二醛(MDA)在達氏鰉、施氏鱘及其正反交子代胚胎中的表達特點,旨在了解以SOD、GSH為代表的抗氧化酶系統在胚胎發育過程中的建立及其對胚胎發育的影響。
1 材料與方法
1.1 材料
達氏鰉、施氏鱘及其雜交子代各發育時期的胚胎取自杭州千島湖鱘龍科技股份有限公司孵化車間,均為全人工繁殖受精卵,孵化水溫為16~17℃,溶氧≥6.0 mg/L。采用解剖鏡觀察胚胎發育時期,每2h觀察一次,在卵裂期、卵黃栓期、神經胚期、視泡期、心搏期、孵出前期、孵出期等7個發育時期取樣(取3對親本的受精卵,每對親本10g左右)。用濾紙吸干胚胎水分后,放人5mL的采樣管中,于液氮罐中保存備用。
1.2 方法
1.2.1 受精率、孵化率及苗種成活率的計算方法
胚胎發育至高囊胚期時,從孵化瓶中隨機取卵100~200粒,放入培養皿中,借助放大鏡觀察,鑒別受精與否。重復取受精卵三次,取平均值,計算受精率:即正常受精卵數占總采卵數的百分比。
仔魚孵出期時,發育正常的孵出魚苗數占總受精卵數的百分比為孵化率。仔魚發育至平游期時,平游魚苗數占總受精卵數的百分比為出苗率。采樣和計算方法同上。
1.2.2 樣品制備
取4種魚不同發育時期的胚胎樣品,加入3倍體積的PBS緩沖液,冰浴勻漿5min,3 000r/min冷凍離心10min,取其上清液用于測定抗氧化酶的活性。
1.2.3 抗氧化酶活性的測定
超氧化物岐化酶(SOD)、過氧化氫酶(CAT)活性、還原型谷胱甘肽(GSH)、丙二醛(MDA)的含量采用南京建成生物工程研究所試劑盒的操作步驟測定。
1.3 數據處理
用Microsoft Excel 2010和SPSS 17.0軟件對試驗數據進行統計分析,結果以平均數±標準差(Mean±SD)表示。
2 結果與分析
2.1 4種鱘胚胎的受精率、孵化率與苗種成活率
由表1可知,4種鱘的平均受精率、孵化率與出苗率均高于70%,雜交未影響受精率、孵化率與出苗率,雖然雜交鱘與施氏鱘的平均受精率、孵化率與出苗率均高于達氏鰉。
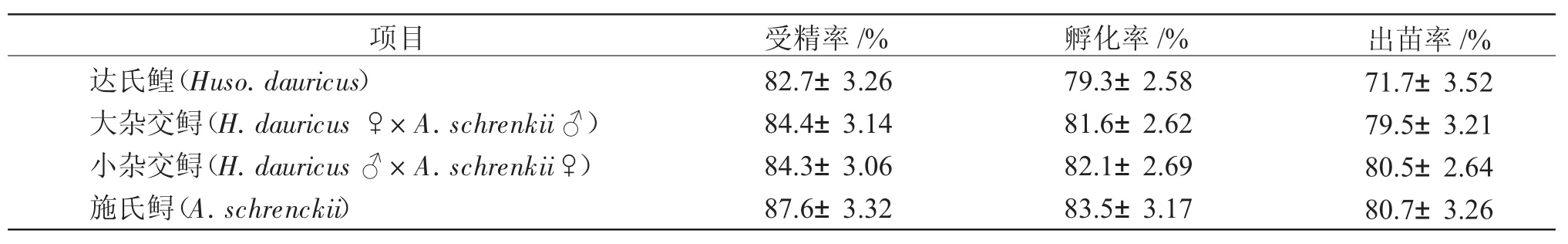
表1 4種鱘受精率、孵化率與出苗率Tab.1 Fertilization rate,and hatching rate of fertilized eggs and mortality of postlarvae in four sturgeons
2.2 4種鱘不同時期胚胎的SOD和CAT活性
4種鱘胚胎SOD活性隨胚胎發育進程的變化規律見圖1。如圖1所示,施氏鱘胚胎SOD活性隨發育的變動范圍為55.84~256.03 U/g prot,最大值出現在心臟搏動期。而達氏鰉胚胎的SOD活性值隨發育時間的變動范圍則為61.31~171.84 U/g prot,最大值出現在卵黃栓期。與施氏鱘和達氏鰉胚胎SOD活性的變動范圍不同,大雜交鱘SOD活性在囊胚期、神經胚期、初孵仔魚期較高,分別為136.25 U/g prot、113.59 U/gprot和 106.44 U/gprot,其他時期均較低。小雜交鱘SOD活性的變動范圍為60.36~142.34 U/gprot,囊胚期活性最高。
如圖2所示,4種鱘胚胎發育期CAT活性的變化規律大致相同。施氏鱘與達氏鰉卵黃栓期的CAT活性最高,分別為30.22 U/g prot和33.36 U/g prot。而大雜交鱘胚胎的CAT活性在囊胚期達最高,顯著高于施氏鱘、達氏鰉和小雜交鱘的同期胚胎(P<0.05)。與大雜交鱘的胚胎不同,小雜交鱘胚胎的CAT活性在卵黃栓期達最高,為21.52 U/gprot。
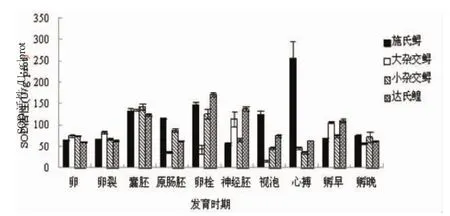
圖1 4種鱘不同胚胎發育時期SOD活性的變化Fig.1 Changes in SOD activity of four sturgeons

圖2 4種鱘不同胚胎發育時期CAT活性的變化Fig.2 Changes in CAT acitivity of four sturgeons
2.3 4種鱘不同胚胎期GSH含量的變化規律
由圖3可知,4種鱘胚胎的GSH含量隨著胚胎發育時間的增加而表現出不同的變化規律。施氏鱘胚胎的GSH含量在囊胚期最高,為778.78 U/gprot,而卵黃栓期和心臟搏動期的活性則分別為324.55 U/gprot和451.21 U/gprot。與施氏鱘胚胎相同,達氏鰉胚胎的GSH含量最高值也出現在囊胚期,最低值則出現在孵化晚期,為16.43 U/g prot。大雜交鱘胚胎的GSH含量較低,孵化晚期最高,為226.97 U/g prot。小雜交鱘胚胎的GSH含量則顯著低于其他3種鱘胚胎。
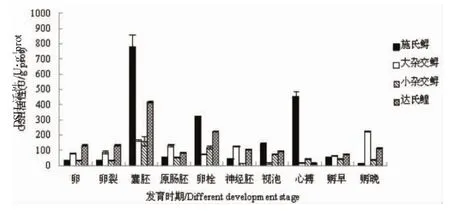
圖3 4種鱘不同胚胎發育時期GSH活性的變化Fig.3 Changes in GSH content of four sturgeons
2.4 4種鱘不同時期胚胎MDA含量的變化

圖4 4種鱘不同胚胎發育時期MDA含量的變化Fig.4 Changes in MDA content of four sturgeons
如圖4所示,4種鱘不同時期胚胎MDA含量的變化規律相同,均呈先升高后降低的變化規律。整個胚胎發育過程中,施氏鱘胚胎MDA含量呈升高后降低的趨勢,卵黃栓期含量最高,為48.26 U/mg prot,孵化晚期最低,為5.45 U/mg prot。達氏鰉胚胎的MDA含量也呈升高后降低的變化趨勢,卵黃栓期的MDA含量最高,為23.37 U/mgprot。大雜交鱘胚胎MDA含量在神經胚期最高,為24.39 U/mg prot,而小雜交鱘胚胎的MDA含量較低,孵化晚期的含量最低,為4.59 U/mgprot。
3 討論
3.1 鱘雜交親和性的研究
鱘染色體組型復雜,微型染色體數眾多[11]。長期以來,人們一直試圖通過種間或屬間雜交改良鱘的品質,實現鱘種質有益基因的滲透。1953年Nikoljukin和Timofeeva通過雜交組合,獲得多個雜交鱘新品種,篩選出生長迅速、可育、性成熟早的小鰉鱘(歐鰉H.huso♀×小體鱘Acipenser ruthenus♂),其能在淡水和咸淡水中生活,是目前較為成功的雜交鱘,表明鱘科魚類屬間雜交親和[12]。
近些年,隨著世界鱘養殖熱潮的興起,鱘雜交組合研究也方興未艾[13-15]。Hassanzadeh Saber(2015)等[14]進行了裸腹鱘(A.nudiventris Lovetsky,1828)和西伯利亞鱘(A.baerii,Brandt,1869)種間雜交;Schrey等2011年進行密蘇里鏟鱘Scaphirhynchus albus和鏟鱘Scaphirhynchus platorynchus雜交的組合,分析其雜交種的形態和遺傳特征[13,14]。Vasil’eva和Grunina(2011)[15]研究了西伯利亞鱘和達氏鰉屬間雜交的形態學。我國對雜交鱘的研究起步較晚,先后進行了施氏鱘×達氏鰉、施氏鱘×西伯利亞鱘、施氏鱘×俄羅斯鱘、小體鱘×施氏鱘、俄羅斯鱘×西伯利亞鱘等多個雜交組合。其中,小體鱘♂×施氏鱘♀種間雜種的胚胎發育過程中,受精率低于10%,胚胎發育至孵化早期出現異常,大量死亡。大量的研究結果表明,鱘的種間和種屬間雜交表現出一定的親和性,但有些種間雜交則表現出雜交不親和或弱親和[16-18]。
3.2 鱘胚胎發育過程中抗氧化酶活性的變化規律
研究證實,魚類的受精卵中儲存相關的抗氧化酶或mRNA,對胚胎發育的啟動具有重要作用,為胚胎早期發育中細胞的快速增長及遷移提供保障[19-21]。研究發現,普安銀鯽胚胎中含有母源性酶類,對胚胎發育的啟動以及早期卵黃物質的利用,一直發揮著重要的抗氧化作用[19]。對施氏鱘胚胎發育過程中抗氧化酶的研究也表明,鱘科魚類也存在著母源性抗氧化酶類,對胚胎發育具有重要的作用[5]。本研究發現,4種鱘受精卵和卵裂期開始時,SOD等酶均具有活性,表明了受精卵在發育早期具有一定的SOD等抗氧化酶活性,但均為受精卵中的母源性酶類,并非合子基因表達的產物。
活性氧是氧代謝產物和一些反應的含氧產物,生成量約占組織總耗氧量的l%~2%,可誘導生物大分子發生氧化反應而改變其結構及構象,發揮如信號傳遞等重要的調控功能[19-21]。不同發育階段的胚胎代謝特點及所需營養不同,活性氧分子(ROS)的產生類型和生成量不同,起主導作用的抗氧化酶的類型也不同[22,23]。本研究中,SOD和CAT在不同胚胎期活性不同,大雜交鱘SOD酶活性在囊胚期起關鍵性作用,促進囊胚腔的形成,這一時期可能是卵裂過程中產生的自由基使母源性SOD活性增加[24]。施氏鱘SOD活性在心搏期最高,CAT活性也較大。該期為心臟形成的關鍵期,表明SOD和CAT在施氏鱘心臟搏動發育中發揮著重要的抗氧化作用,這可能與合子基因的表達有關[24]。與施氏鱘不同,達氏鰉的SOD和CAT活性最高值出現在卵黃栓期,表明其卵黃栓發育過程中受到氧化損傷。達氏鰉胚胎通過增加SOD和CAT活性有效地降低損傷,這一結果與Rudneva的研究結論一致[25]。
GSH含量是衡量魚體抗氧化能力的重要因子之一[15]。本研究中,大雜交鱘胚胎出膜期的GSH含量最高,表明其在出膜期發揮了重要的抗氧化作用,促進了出膜,與哲羅魚胚胎發育的研究結果一致[15]。整個胚胎發育過程中,小雜交鱘GSH含量較低,表明SOD和CAT在小雜交鱘胚胎發育過程中起主要抗氧化作用。研究證實,MDA可間接地反映魚類組織細胞受自由基攻擊的程度[22]。本研究中,施氏鱘胚胎的MDA含量在囊胚期和卵黃栓期出現兩個峰值,與其胚胎死亡率較高的現象相一致,表明施氏鱘胚胎在囊胚期和卵黃栓期易受到氧化損傷[5]。達氏鰉胚胎的在卵黃栓期MDA含量最高,大雜交鱘則出現在神經胚期,而整個胚胎發育時期小雜交鱘胚胎的MDA含量變化不顯著,表明4種鱘胚胎發育期的抗氧化機制不同。
[1]孫大江.中國鱘魚養殖[M].北京:中國農業出版社,2015:1-8.
[2]孫大江,曲秋芝,張穎,等.中國的鱘魚養殖[J].水產學雜志,2011,24(4):67-70.
[3]張克烽,張子平,陳蕓,等.動物抗氧化系統中主要抗氧化酶基因的研究進展[J].動物學雜志,2007,42(2):153-160.
[4]孔祥會,王書平,江紅霞,等.金魚胚胎發育過程中免疫相關酶活性及丙二醛含量的變化[J].中國水產科學,2011,18(6):1293-1298.
[5]席慶凱,張穎,劉曉勇,等.施氏鱘胚胎發育階段可溶性蛋白、性激素含量和免疫相關指標的變化[J].大連海洋大學學報,2015,30(4):357-362.
[6]周凡,肖金星,何中央,等.不同規格莫桑比克草蝦肌肉營養組成、消化酶及免疫酶活性分析[J].水產科學,2013,32(11):653-656.
[7]豐程程,張穎,張永泉,等.哲羅魚胚胎至仔稚幼魚主要免疫指標和抗氧化酶的活性變化[J].淡水漁業,2013,43(6):35-38.
[8]孫大江,張穎,馬國軍.鱘魚子醬的生產與國際貿易概況[J].水產學雜志,2014,27(1):1-7.
[9]王念民,楊貴強,彭濤,等.三種鱘魚及其雜交種肌肉營養成分分析[J].吉林農業大學學報,2010(1):53-56.
[10]胡佳,汪登強,危起偉,等.施氏鱘、達氏鰉及其雜交子代的分子鑒定[J].中國水產科學,2010,17(1):21-30.
[11]Arefjev V A.Cytogenetics of interploid hybridization of sturgeons[J].J Appl Ichthyol,1999,15:277.
[12]Nikoljukin N I and Timofeeva N A.Hybridization beluga with starlet[M].In:Reports of Academy of Science of USSR,1953,93(5):899-902.
[13]Schrey W R and Boley E J.Hybridization between pallid sturgeon Scaphirhynchus albus and shovelnose sturgeon Scaphirhynchus platorynchus[J].Journal ofFish Biology,2011,79(7):1828-1850.
[14]Hassanzadeh Saber,S Baradaran Noveiri,M Pourkazemi,et al.Confirmation of induced hybrid from female ship sturgeon (Acipenser nudiventris Lovetsky,1828)and male Siberian sturgeon(Acipenser baerii,Brandt,1869)usingmicrosatellite markers[J].J Appl Ichthyol,2015,31:1002-1005.
[15]Vasil’eva E Dand Grunina A S.Features ofinheritance of several morphological characters in the hybrids between Siberian sturgeon Acipenser baerii and beluga A.huso(Acipenseridae)and in gynogenetic individuals ofSiberian sturgeon[J].Journal of Ichthyology,2011,51(5):373-381.
[16]石振廣,董雙林,魯宏申,等.人工養殖條件下達氏鰉雜交種幼魚生長特性的初步研究[J].中國海洋大學學報,2008,38(1):33-38.
[17]張穎,劉曉勇,曲秋芝,等.達氏鰉、施氏鱘及其雜交種(施氏鱘♂×達氏鰉♀)形態差異與判別分析[J].淡水漁業,2012,42(6):27-32.
[18]丁厚猛,李吉方,溫海深,等.放養密度對西伯利亞雜交鱘攝食、生長以及肌肉組分的影響[J].海洋湖沼通報,2015(1):79-84.
[19]熊鏵龍,姚俊杰,安苗,等.普安銀鯽胚胎發育中抗氧化酶活性及外源維生素C的作用[J].水產科學,2014,33(10):631-634.
[20]鄒立軍,莊遠紅,龔婧,等.翹嘴鱖胚胎發育期間酸性和堿性磷酸酶活性的變化[J].江蘇農業科學,2015,43(10):287-289.
[21]孫虎山,王宜艷,梁建光,等.貽貝發育早期酸性和堿性磷酸酶活性[J].海洋與湖沼,2008,39(1):42-48.
[22]陳霞.活性氧在卵泡發育及胚胎發育中的作用[J].實用醫學雜志,2008,24(11):2014-2015.
[23]尹飛,孫鵬,彭士明,等.低鹽度脅迫對銀鯧幼魚肝臟抗氧化酶、鰓和腎臟ATP酶活力的影響[J].應用生態學報,2011,22(4):1059-1066.
[24]李鐘淑,唐貴娥,方南洙,等.活性氧對胚胎體外發育阻滯的影響[J].黑龍江畜牧獸醫,2006(10):21-23.
[25]Rudneva I I.Antioxidant system of Black Sea animals in early development[J].Comp Biochem Physiol,1999,122(2):265-271.
Antioxidant Enzyme Activities During Embryonic Development of Huso dauricus,Acipenser schrenckii and their Hybrids
ZHANG Ying1,2,XU Wei1,SUN Da-jiang1,WANG Bin2,XU Shi-jian2,ZHANG Jing-qun3,HU Cao4
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China;3.Tibet Autonomous Region Academy of Agriculture and Animal Husbandry,Lhasa 850000,China;4.Dujiangyan Authority of Sichuan Province,Dujiangyan 611830,China)
Fertilization rate and hatching rate of fertilized eggs and mortality of post-larvae were monitored and activities of antioxidant enzymes including acid phosphatase (ACP),alkaline phosphatase (AKP),superoxide dismutase (SOD)and catalase(CAT)were determined during embryonic development in Acipenser schrenckii,Huso dauricus and their hybrids by biochemical methods to evaluate the mechanism of heterosis.It was found that hybridization between Acipenser schrenckii and Huso dauricus showed high cross-compatibility with natural crossing progenies,indicating that the fertilization rate,hatchability and mortality of post-larvae were not affected by hybridization.Antioxidant enzyme activities were shown to be different patterns during embryonic development in Acipenser schrenckii and Huso dauricus and their hybrids.There were similar or higher antioxidant enzyme activities in the hybrid between Huso dauricus(♀)×Acipenser schrenkii(♂)than those in their parents with higher antioxidant enzyme activity in some particular embryonic development stage.The hybrid between Acipenser schrenkii(♀)×Huso dauricus(♂)had significant lower SOD activity and glutathione(GSH)and malondialdehyde(MDA)contents than their parents did(P < 0.05).The maximal SOD ac-tivity was observed at heart beating phase in Acipenser schrenkii and at yolk plug phase in Huso dauricus.The maximal SOD activity,however,was found at blastula phase in the hybrids.The findings indicate that the heterosis between Huso dauricus and Acipenser schrenkii can partially be explained by the differences in antioxidant enzyme activities among the sturgeons.
Acipenser schrenkii;Huso dauricus;hybrid;embryonic development;antioxidant enzyme
S965.215
A
1005-3832(2017)06-0019-05
2017-03-21
公益性行業(農業)科研專項(201203086);杭州市錢江特聘專家(2016);黑龍江省冷水性魚類種質與增養殖重點實驗室項目.
張穎(1977-),女,博士,副研究員,從事魚類繁殖生理研究.E-mail:juletzhang@hotmail.com
孫大江,男,研究員.E-mail:13845059350@163.oom

