勒夏特列原理與化學平衡常數
李卓陽
(山東省平度市第一中學 266700)
勒夏特列原理與化學平衡常數
李卓陽
(山東省平度市第一中學 266700)
勒夏特列原理可以定性的判斷一些化學平衡移動問題,在解決這些問題時也很方便,無論教師還是學生遇到這些問題,都習慣運用勒夏特列原理,勒夏特列原理成為解決此類問題的主要工具.
勒夏特列原理;化學平衡常數;定量
新課改后,在蘇教版和魯科版的高中化學教科書中突出了化學平衡常數的地位,強化了用平衡常數來解決化學平衡移動問題的應用.那么勒夏特列原理與化學平衡常數誰更具有優勢?
以前,學生對勒夏特列原理的理解可能有很多誤區.往往認為勒夏特列原理是無條件的,在任何環境下都可以使用,其實并非如此,學生要關注勒夏特列原理適用的條件.從熱力學的觀點來探究知識,分析原理,明確知識本質.在探究中學生要明確:如果改變影響平衡的一個方面,整個平衡就會向能夠減弱這種改變的方向移動,形成一種動態的平衡.如“沉淀溶解平衡、電離平衡、鹽類水解平衡等”.在使用勒夏特列原理時,只能允許有一個因素發生改變,其他條件被認為是封閉不動的,否則就會出現錯誤.例如氨的合成過程,按照勒夏特列原理分析,很多學生會認為到實驗反應過程中,如果溫度和壓力固定保持不變,在這個時候加入氨氣,實驗平衡會朝著合成氨的方向移動.但是實際上并非如此,學生通過用濃度商Q跟平衡常數K的比值來看,會發現這個結果跟勒夏特列的判斷是截然不同的,這與學生的理論推斷相反.因為合成氨的化學反應過程并不是一個封閉體系,勒夏特列原理在這個環境中不適用,不符合應用條件.下面通過一個例題詳細說明.

如果應用勒夏特列原理,平衡一定向正向移動.但是這個判斷是錯誤的.下面利用平衡常數和濃度商來判斷正確的方向.該體系的平衡常數可表示為:
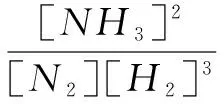
在原來平衡的混合物中,1.0L氣體含分子(0.5mol+0.2mol+0.2mol)=0.9mol.當加入平衡體系中加入0.18molN2時,體系即時有分子(0.9mol+0.18mol)=1.08mol,在理想氣體情況下,溫度和壓強不變,瞬時體系的氣體總體積變為1.0L×1.08mol/0.9mol=1.2L,此時濃度商Q可表示為:
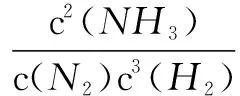
由于Q>K,平衡將向逆方向移動.為什么利用勒夏特列原理判斷平衡移動方向是錯誤的呢?原因是只關注了N2的分子數量變化,忽略了H2和NH3的氣體體積變化.所以勒夏特列原理并不是什么情況下都可以用的.
在了解了化學平衡常數之后,明確濃度商Q跟平衡常數K完全能夠解決這個問題.因為,不管是什么樣的實驗體系,開放的或者是混合的,都是可以應用的,而不像勒夏特列原理那樣有條件約束,在某些環境下不可使用.應用化學平衡常數解決平衡問題時,需要在大腦中建立一個基于狀態分析的探究程序,尤其要明確濃度和壓強與化學反應平衡狀態的影響.在探究中,學生要明確:在一個化學反應平衡系統中,首先要弄清平衡時,Q=K.如果這時候的外界環境發生變化,包括濃度、溫度、壓強的改變會對K或Q產生什么樣的影響?通過怎樣的調整和變化才能夠使Q重新等于K,重新回到平衡的狀態.例如,如果增加反應物的濃度,K保持不變,這個時候濃度商Q就會變小,這是化學反應就會向著生成物濃度增大,反應物濃度減少的變化進行,直到平衡為止.化學平衡常數還有其他的應用,如:
1.化學平衡常數可用來判斷反應進行的程度(即反應限度)

A.①>②B.①<②C.①=②D.不能確定
解析平衡常數越大,表示化學反應進行地越徹底;平衡常數越小,表示反應向正向進行的程度越小.如果一個化學反應的平衡常數的數值在105左右,通常認為,反應可以進行得比較完全;相反,一般,如果一個化學反應的平衡常數的數值在10-5左右,則認為這個反應很難進行.各個化學反應的平衡常數相差很大,如本題中給出的兩個化學反應:反應①的程度很小,而反應②進行的程度很大.因此,B選項是正確的.
2.化學平衡常數可用來判斷化學反應的熱效應.

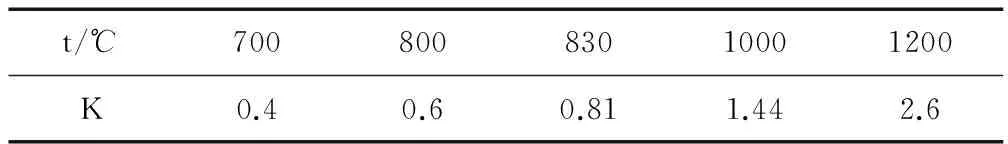
t/℃70080083010001200K0.40.60.811.442.6
該反應ΔH 0(填“<”、“>”或“=”).
解析K值的大小與濃度、壓強和是否使用催化劑無關,只與溫度這一外界條件有關,溫度發生變化時平衡常數也會發生改變.溫度越高,K值越大,則正反應為吸熱反應;溫度越高,K值越小,則正反應為放熱反應.在題中,平衡常數隨溫度的增大而增大,該反應的正反應為吸熱反應,因此ΔH>0.
3.判斷一個化學反應是否達到平衡狀態
4.計算物質的含量、轉化率、平衡濃度等
前面我們講過勒夏特列原理不是在所有條件下都成立的,不能用勒夏特列原理解釋所有的化學平衡移動的問題:勒夏特列原理只完全適用與封閉、均相體系,只能在改變影響化學平衡的一個條件時適用.在這一基本前提下,可以運用勒夏特列原理定性解釋化學平衡移動的問題.
例4 在配制FeCl3溶液時,為什么通常加入少許稀鹽酸?
解FeCl3是一種強酸弱堿鹽,溶液中存在著水解平衡:

在配制FeCl3溶液時,加入酸可使平衡向逆反應方向移動,抑制水解.
總之,勒夏特列原理的使用有局限性:這個原理更加注重的是從理論上來探究化學知識;是一種定性的認識,而不是定量的計算.而平衡常數有科學理論基礎,并經過實驗檢驗,有定量計算,所以化學平衡常數應該作為解決化學平衡移動問題的主要工具.用勒夏特列原理定性判斷平衡移動方向,有時比較難,需要考慮多方面的因素和條件,才能夠判斷出化學平衡的移動方向.但是勒夏特列原理是通過平衡常數進行定量的計算,這個常數就像是計算的中介一 樣,使化學變化的數量可以加以測量,更加準確地進行計算,達到快速解決問題的目的.可以說勒夏特列原理展示了一個客觀變化的共同規律.
[1]徐守兵.勒夏特列原理和化學平衡常數學習現狀的調查分析和教學反思[J]. 化學教育,2011(06):42-44.
[2]孟彥.對“化學平衡常數”教學內容的看法和建議[J]. 化學教與學,2011(11):26-38.
G632
A
1008-0333(2017)31-0093-02
2017-07-01
李卓陽(2000.3-),男,山東平度人,現讀于山東省平度市第一中學,曾代表學校參加省化學競賽,并獲一等獎.
閆久毅]

