林茜草根黃酮對S-180小鼠腫瘤TG-3、MHC-Ⅰ和MHC-Ⅱ蛋白表達的影響①
劉德財,王 雪,蘭 瑩,于菁妮,張躍華
(1.佳木斯大學生命科學學院,黑龍江 佳木斯 154007;2佳木斯大學理學院,黑龍江 佳木斯 154007)
林茜草根黃酮對S-180小鼠腫瘤TG-3、MHC-Ⅰ和MHC-Ⅱ蛋白表達的影響①
劉德財1,王 雪2,蘭 瑩2,于菁妮1,張躍華2
(1.佳木斯大學生命科學學院,黑龍江 佳木斯 154007;2佳木斯大學理學院,黑龍江 佳木斯 154007)
目的:以林茜草根醇提取總黃酮為研究對象,干預其對小鼠S-180肉瘤的抑制作用,探究抗腫瘤機制。方法:以常規ELISA檢測、IH測定和RT-PCR手段,測定其在瘤體中三種蛋白TGF-β1、MHC-I、MHC-Ⅱ的上調表達;以此探索TG-3在小鼠S-180肉瘤實體瘤表面免疫蛋白分子的分泌,從而說明其分泌蛋白增強瘤體的免疫應答作用強度,以此機制制約瘤細胞在模型鼠體內移動和定置。結果:腫瘤細胞MHC-Ⅰ,MHC-Ⅱ和MHC-ⅠmRNA模型組顯著減少;抗腫瘤逃逸機制和植物醇提取物總黃酮組顯著增加。結論:林茜草根總黃酮可能能提高和增強宿主的免疫功能從而抑制小鼠S-180荷瘤,達到抑制腫瘤目的。
林茜草根黃酮;S-180瘤株;免疫應答;轉移
應用從林茜草根中純化提取的林茜草黃酮,以小鼠腫瘤S-180為實驗主體,研究其對腫瘤細胞誘導凋亡的作用。采用黃酮類物質對小鼠體內腫瘤細胞誘導凋亡實驗[1,2],證實林茜草總黃酮提取液對S-180癌細胞的轉移和定殖具有明顯抑制作用,實驗數據表明其具有誘導細胞凋亡和抗細胞表面抗體蛋白導致抗免疫機制,為探索中西醫結合控制腫瘤的轉移、復發和定殖具有重要意義,為腫瘤的綜合治療提供實驗依據。以林茜草根醇提取總黃酮為研究對象,干預其對小鼠S-180肉瘤的抑制作用,探究抗腫瘤機制;以常規ELISA檢測、IH測定和RT-PCR手段,測定其在瘤體中三種蛋白TGF-β1、MHC-I、MHC-Ⅱ的上調表達;以此探索TG-3在小鼠S-180肉瘤實體瘤表面免疫蛋白分子的分泌,從而說明其分泌蛋白增強瘤體的免疫應答作用強度,以此機制制約瘤細胞在模型鼠體內移動和定置。以及其對小鼠機體免疫功能的影響,探討林茜草根醇提取物在抗腫瘤方面的作用機制。
1 材料與方法
1.1 材料
1.1.1 林茜草總黃酮提取物
實驗材料林茜草9月份采自黑龍江省小興安嶺腹地,帶嶺區涼水國家原始森林公園,超臨界提取純化總黃酮粉末,待用。
1.1.2 實驗動物
實驗所用小鼠為常規小鼠腹水腫瘤細胞株種鼠,瘤株型號為S-180 荷瘤小鼠,活體荷瘤鼠購置于哈醫大二院附屬動物實驗中心;實驗用小鼠為健康成年昆明種小鼠,由佳木斯大學實驗動物中心提供,根據試驗要求,對體重、性別、數量進行篩選,試驗前經適應性飼養觀察1w。
1.1.3 試劑和儀器
環磷酰胺,山西普德藥業;MHC-Ⅰ、MHC-Ⅱ免疫組化試劑盒、SABC免疫組化檢測試劑盒、DAB顯色試劑盒,天津百浩公司;RNA酶(RNase),國產,北京瑞達公司;碘化丙啶,北京泛博化學公司;核酸染液,南京賽泓瑞生物公司;TGF-β1 RNA逆轉錄試劑盒,上海金穗生公司;Taq DNA聚合酶、dNTP、TRIZOL-RNA提取試劑盒,上海江萊生物科技公司提供。倒置相差顯微鏡:CX-10型,日本Olympus公司;紫外分光光度計:UV1900型,北京普析通用公司;-美國熱電公司-JENA梯度PCR儀,PowerCycler Gradient SL;北京君意東方JY04S-3G型凝膠成像分析系統:Champ GelTM 5000,軟件LANE-1D,北京賽智公司。
1.2 方法
1.2.1 實驗荷S-180實驗小鼠模型預制
無菌條件下抽取S-180腹水瘤細胞,注入肝素鈉浸潤無菌采集管中;鏡檢瘤細胞黏度,以無菌生理鹽水稀釋5~10倍,注射于實驗小鼠腹腔內,注意進針后皮下平行,以防刺入腹腔;單只實驗目標鼠注射1.0mL經過無菌生理鹽水稀釋的S-180腹水瘤細胞液,濃度在1×1010~1×1011cfumL;每個周期接種8~10只傳代小鼠;實驗中造模時,依據以上要求,將以無菌生理鹽水稀釋的濃度在1×1010~1×1011cfu的S-180腹水瘤細胞液皮下接種實驗小鼠的左右后肢腹股溝處[3]。
1.2.2 實驗小鼠分組以及處理干預方案
依據前述的試驗方案,挑選符合要求的KM實驗小鼠群體,將其分為3個組別,每個組別30只,以上實驗小鼠建模成功后,進行藥物和對照干預,分別為空白對比組、化療藥物環磷酰胺對照組和植物-林茜草根醇提取總黃酮組;空白對照組的處理策略是每日腹腔注射無菌生理鹽水0.2mL,以及0.3mL生理鹽水灌胃,藥物處理組采用林茜草根醇提取液的總黃酮,每日0.3mL灌胃,灌胃量控制為0.40g/kg·d,每天上午進行以上操作,灌胃、注射在上午進行,以上操作連續給藥處理10d。
將注射過的荷瘤小鼠模型隨機分為5組,每組10只,分別為正常組(NG)、模型組(MG)、總黃酮組(TFG)、化療藥物環磷酰胺組(CTX)和共同作用組 (TFG+CTX)。普通對照組(NG):無菌生理鹽水干預組,劑量為每日0.4mL/只;造模對照組(MG):無菌生理鹽水干預,每天灌胃0.4mL/只;植物醇提取物總黃酮組(TFG):干預情況如下,每日每只TFG灌胃240mg/ kg;化療藥物 (CTX):無菌生理鹽水干預每天0.4mL/只,CTX尾部靜脈注射,第3天開始注射,注射劑量為每日100mg /kg·只;共同干預組別(TFG+CTX)處理如下: TFG灌胃每天每只240mg/ kg·只,至第3天,CTX干預,腹腔注射每天、每只100mg/kg。
1.3 統計學方法
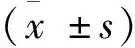
2 結果
2.1 總RNA提取
依據試劑盒提供的方法PCR擴增,并逆轉錄合成cDNA,實體瘤組織細胞中的總RNA提取依據市售的RNA提取試劑盒說明書要求操作。將樣品分為3份,1份電泳,1份用于測定純度RNA,1份備用,置于-80℃冰箱凍干保存備用。
2.2 實體腫瘤組織cDNA的反轉錄要求
反轉錄操作合成cDNA按照附帶的RT-PCR Kit說明要求步驟。五局條件下,反應體系總體積10μL,按照說明書要求分別加入各種要求試劑混勻,進行反轉錄合成DNA反應;反應過夜后,反轉錄合成的產物置于超低溫冰箱存放。
2.3 實驗小鼠瘤細胞株中PCR擴增和凝膠電泳分析MHC-ⅠmRNA表達
依據試劑盒說明書要求步驟進行反轉錄PCR合成反應。步驟要求如下:
總反應體系體積為50μL,配制PCR反應液:將混合體系中各個試劑加入混勻,保持備用;離心后,進行PCR合成操作,結束后再用加樣器吸取5.0μL的PCR產物和2.5μL內標以及1μL (6×)樣品buffer混勻,點至2%瓊脂糖凝膠電泳板孔內,其中瓊脂糖凝膠預先融入,溴化乙錠染料的加入劑量比例為瓊脂糖凝膠體積的5%混合于電泳膠板,在冷卻條件下,低溫電泳,以防止產物分解,電泳參數如下:電泳電壓控制在100~120V,電泳時間為60min。
2.4 凝膠電泳產物判讀
瓊脂糖電泳膠板經過凝膠板熒光染料著色,方法采用Gold-Veiw DNA染色用的電泳條帶分析法;圖像用軟件Bio-Rad Quantity one 5.0自帶的數據分析系統判讀,軟件半定量分析各個基因條帶的光密度,結果用內置的參照β-actin比值顯示。
2.5 蛋白免疫組化TG-3、MHC-Ⅰ、MHC-Ⅱ判讀
實驗樣本的免疫組織化學素材圖像分析采用分析軟件Pro-Plus-Image處理;取采集到的MHC-Ⅰ和 MHC-Ⅱ切片圖像判讀,樣品切片、染色后,每張選取分散視野中的5個區域測定S-180小鼠腫瘤組織的積分光密度值(IOD值),每張樣片圖像判讀數字,取算數平均值代表MHC-Ⅰ同MHC-Ⅱ相對應的蛋白表達的強度,實驗數據依據統計學示意,統計分析,求平均數,ANOVA單因素方差分析,LSD法作兩兩比較SPSS-13.0軟件操作,見表1。

表1 各實驗組對S-180實驗鼠瘤體MHC-I和MHC-Ⅱ蛋白表達的影響
注:與模型組比較,*P<0.05。
2.6 TFG對荷S-180小鼠瘤組織中MHC-ⅠmRNA表達檢測
荷瘤小鼠組織總RNA提取依據試劑盒Trizol-10要求操作,按前述的方法用紫外分光光度計測定其表達的強度以及提取的質量鑒定。同健康組小鼠組織細胞中MHC-ⅠmRNA基因表達同腫瘤細胞表達相比,下降顯著;與模型組對照比較比較,各個藥物干預組表達指標呈明顯上升勢頭,見表2。

表2 各個處理組對荷瘤鼠S-180組織中MHC-ⅠmRNA分泌比較
注:與模型組比較,*P<0.05。
3 討論
機體在產生腫瘤后,會發生腫瘤的免疫逃逸,即腫瘤細胞可以在免疫系統的監控攻擊中憑借多種方法逃避攻擊從而繼續分裂生長的現象。生命體特異性免疫系統在啟動清除腫瘤細胞免疫過程中,腫瘤抗原表達、抗原識別、加工、提呈、T細胞增殖、活化和分化以及免疫效應的產生這一系列環節[5],需要啟動腫瘤抗原的鑒定,捕獲,加工;主要呈現為兩個方面:抗原呈遞細胞的共刺激分子信號轉導的協同效應,通路的激活;特異性識別并殺死腫瘤細胞I類分子的限制性表達[6]。研究發現,主要組織相容性復合體(MHC)I類分子和共刺激減少或薄弱和缺少的元素表達缺失,導致免疫細胞反應無能、腫瘤細胞普遍存在的生物學現象中的細胞表面表達[7],也導致癌細胞逃避免疫監視,意味著一個重要特異性抗免疫反應發生的逃逸機制[8]。
實驗結果表明,林茜草黃酮能增加免疫分子MHC-I,MHC-Ⅱ的腫瘤細胞表面的表達,增強特異性細胞的抗腫瘤免疫反應的作用,對于癌癥病人的臨床實踐期間,抑制殘余腫瘤細胞體內轉移和重要措施防止復發。由上可知,腫瘤細胞MHC-Ⅰ,MHC-Ⅱ和MHC-ⅠmRNA模型組顯著減少;抗腫瘤逃逸機制和TFG組顯著增加。說明林茜草總黃酮可上調免疫分子的腫瘤細胞表面的表達,提高特定細胞的抗腫瘤免疫應答的功能,抑制腫瘤細胞的體內轉移和復發。
[1]中華人民共和國藥典委員會. 中華人民共和國藥典[M]. 北京: 化學工業出版社, 2000:245-247
[2]中國醫學科學院藥用植物資源開發研究所. 茜草屬藥用植物的研究-Ⅰ.中藥茜草的原植物與國內資源[J]. 天然產物研究與開發,1991, 13(4):7-15
[3]侯柏玲, 王素賢. 林茜草化學成分的研究[J]. 中草藥,2000, 31(7):492-494
[4]華會明, 王素賢, 吳立軍,等. 茜草中萘酸酯類成分的研究[J]. 藥學學報, 1992,27(40): 279-281
[5]張華, 曲震寰, 王瑩, 等. 小鼠腹腔巨噬細胞的分離培養與吞噬功能測定[J]. 黑龍江醫藥科學, 2007, 30(5):9-10
[6]Liu Xi, Li Fei and Zhang Li. Experimental Research on the Effects of the Honey-Boiled Parent Root of Aconitum Carmichael on the Immune Function in the H (22)-Bearing Mice[J]. Beijing University of Traditional Chinese Medicine, 2004, 27(2):68-70
[7]呂延杰主編. 藥理學實驗指導[M]. 北京: 人民衛生出版社,2008:117
[8]白玉靜, 佟麗華. 香菇多糖提取工藝和含量測定方法研究[J]. 黑龍江醫藥科學, 2006, 29(1): 55-56
EffectofRubiasylvaticagrassrootsflavonoidsontheexpressionofTG-3,MHC-IandMHC-IIproteinsinS-180mice
LIUDe-cai1,WANGXue2,LANYing2,YUJing-ni1,ZHANGYue-hua2
(1.The College of Life Science, Jiamusi University, Jiamusi 154007, China;2.The College of Science, Jiamusi University, Jiamusi 154007, China)
ObjectiveTo discuss the inhibitory effect of Rubia sylvatica grassroots flavonoids to mouse sarcoma S-180 and explore its anti-tumor mechanism.MethodDetection of TGF-β1, MHC-I, MHC-Ⅱ protein by ELISA, IH and RT-PCR methods in tumor tissues was to reveal the secretion of TG-3 in mice S-180 sarcoma tumor surface, so that the secreted proteins enhanced the immune response intensity of tumor which restricted the movement and location of the tumor cell in mice.ResultsThe expression of MHC-I, MHC-Ⅱ and MHC-ⅠmRNA were significantly reduced in model group; a obviously increase in anti-tumor escape mechanism was observed in plant alcohol extract of total flavonoids group.CconclusionRubia sylvatica Nakai of total flavonoids can improve and enhance the host immune function, thereby exerts an inhibitory effect to mouse sarcoma S-180.
Rubia sylvatica flavonoids; S-180 tumor lines; immune response; transfer
黑龍江省衛生廳科學技術研究項目,編號:2012-268。
劉德財(1974~)男,黑龍江佳木斯人,碩士,高級實驗師。
張躍華(1962~)男,黑龍江佳木斯人,博士,副教授。E-mail:zhangyaohua_2008@163.com。
R285.5
A
1008-0104(2017)06-0022-03
2017-06-19)

