分蘗蔥頭蛋白提取工藝優化及其基礎特性
劉婷婷,劉 陽,張 晶,宋云禹,李桂杰,張艷榮*
分蘗蔥頭蛋白提取工藝優化及其基礎特性
劉婷婷,劉 陽,張 晶,宋云禹,李桂杰,張艷榮*
(吉林農業大學食品科學與工程學院,吉林 長春 130118)
采用堿溶酸沉正交法對分蘗蔥頭中蛋白質進行提取工藝優化,并對其基礎特性進行測定,結果表明在料液比1∶15(g/mL)、pH 9.0、提取溫度50 ℃、提取時間1.5 h條件下提取率最大為79.38%。電泳結果表明蛋白分子質量分別為61.94、27.10、17.62、13.34 kDa。高效液相色譜法測得分蘗蔥頭蛋白中必需氨基酸質量分數為38.96%,非必需氨基酸質量分數為61.04%。二級結構測定結果表明分蘗蔥頭蛋白中α-螺旋含量為52.60%,β-折疊含量為8.60%,β-轉角含量為15.60%,無規則卷曲含量為22.40%。采用紅外圖譜法對分蘗蔥頭蛋白特征官能團進行測定,其特征官能團明顯。
分蘗蔥頭;蛋白;正交試驗;基礎特性
分蘗蔥頭為百合科(Liliaceae)蔥屬(Allium)多年生草本植物[1]。1931年由日本引進吉林省,又名“鬼子蔥”[2]。分蘗蔥頭是喜冷耐凍耐寒的高產作物[3],生育期短為58 d,畝產量在2 000~3 000 kg,其主產區集中在我國的東北、中北部[4],是吉林省和黑龍江省傳統農作物,栽培面積日漸擴大[5-6]。新鮮的分蘗蔥頭中含有糖類、蛋白質及微量元素等基礎成分[7],除此之外,分蘗蔥頭中還含有揮發性油成分[8],已有文獻報道其具有抗菌、降血脂、抗癌、防治血栓病等多種生理功效[9-10]。
目前,分蘗蔥頭主要以鮮菜形式進行銷售,工業化加工產品極少。國內外對分蘗蔥頭的研究主要集中在分蘗蔥頭栽培套作提高產量[11]、黃酮類抗氧化物質的提取優化及制備、分蘗蔥頭精油的制備等方面[12-13],目前在植物蛋白研究領域鮮見分蘗蔥頭蛋白的研究報道。由于植物蛋白食品因其資源豐富且不含膽固醇[14],已成為人們飲食中的主要蛋白質來源。尋找新的植物蛋白資源并進行開發利用,有利于滿足人們對高品質蛋白質的需求,市場潛力巨大,前景廣闊[15]。本實驗采用堿溶酸沉法對分蘗蔥頭中蛋白質進行提取,正交試驗法優化出最佳提取工藝條件,并對分蘗蔥頭蛋白基礎特性進行深入的研究。為分蘗蔥頭蛋白的進一步開發應用研究提供了良好的理論基礎。
1 材料與方法
1.1 材料與試劑
新鮮分蘗蔥頭 吉林省烏拉街鎮農貿市場;溴化鉀、丙烯酰胺、雙丙烯酰胺、考馬斯亮藍、2-巰基乙醇、十二烷基磺酸鈉、四甲基二乙胺(均為分析純)北京化工廠;17 種氨基酸標準品、衍生劑、乙腈、甲醇、異丙醇、磷酸鹽緩沖液(均為色譜純) 美國Waters公司。
1.2 儀器與設備
DY-40型電動粉末壓片機 天津科器高新技術公司;傅里葉交換紅外檢測器 日本島津公司;HYP-1004型消化爐 上海纖檢儀器有限公司;PHS-3D型pH計 上海精密科學儀器有限公司;CT15RT型臺式高速冷凍離心機上海天美科學儀器有限公司;UV-2300型紫外-可見分光光度計 北京普析通用儀器有限公司;Alpha1-4LP Plus型凍干機 德國Christ公司;DYC2-24D型垂直電泳槽 北京君意東方電泳設備有限公司;超高效液相色譜系統 美國Waters公司。
1.3 方法
1.3.1 工藝流程及分蘗蔥頭蛋白提取率的計算
分蘗蔥頭→預處理→脫脂(用于生產分蘗蔥頭精油)→調節料液比→調 節pH值及溫度→堿提→過濾(廢渣)→濾液→酸沉→離心→凍干→分蘗蔥頭蛋白
分蘗蔥頭蛋白含量的測定參考GB5009.5—2010《食品中蛋白質的測定》中的分光光度法,提取率及蛋白純度計算見公式(1)和(2)。

1.3.2 分蘗蔥頭蛋白提取單因素試驗
本實驗以分蘗蔥頭蛋白質的提取率為考察指標,分別對料液比、pH值、提取溫度、提取時間4 個影響提取率的因素進行考察[16-17],設定料液比分別為1∶5、1∶10、1∶15、1∶20、1∶25(g/mL),pH值分別為8.0、8.5、9.0、9.5、10.0,提取溫度分別為20、30、40、50、60 ℃,提取時間分別為1.0、1.5、2.0、2.5、3.0 h,每組重復3 次平行實驗,取其平均值[18-19]。固定的單因素條件為料液比1∶15(g/mL)、pH 9.0、提取溫度30℃、提取時間2 h。
1.3.3 分蘗蔥頭蛋白提取的工藝優化
在單因素試驗的基礎上,設計正交試驗的因素與水平如表1所示。

表1 正交試驗因素與水平Table 1 Coded levels and corresponding actual levels of independent variables used for orthogonal array design
1.3.4 分蘗蔥頭蛋白基礎特性的測定
1.3.4.1 等電點的測定
準確稱取一定量的分蘗蔥頭蛋白凍干粉,用去離子水溶解調至pH 9.0,蛋白質充分溶解后,用0.1 mol/L的HCl溶液分別調節pH值為2.5、3.0、3.5、4.0、4.5、5.0靜置30 min,使蛋白充分沉淀,3 800 r/min離心15 min,取上清液1 mL,加入4 mL雙縮脲試劑,充分搖勻,靜置30 min,于540 nm波長處測定吸光度,吸光度越低說明上清液中蛋白質含量越少,即為分蘗蔥頭蛋白質的等電點[20-21]。
1.3.4.2 紫外-可見分光光度計測定
稱取一定質量的分蘗蔥頭蛋白樣品,溶于去離子水中,稀釋到適當的倍數配制成一定質量濃度的蛋白溶液,然后用紫外-可見分光光度計在270~700 nm波長范圍內進行掃描測定[22-23]。
1.3.4.3 蛋白分子質量的測定
采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)測定分蘗蔥頭蛋白的分子質量,選擇10%分離膠、120 V電壓、3%濃縮膠、80 V電壓進行測定。樣品上樣量25 μL;以標準蛋白相對分子質量對數值為縱坐標,蛋白質相對遷移率為橫坐標,繪制標準曲線,計算相對分子質量[24-25]。蛋白質相對遷移率的計算見公式(3)。

1.3.5 氨基酸組分分析
氨基酸含量測定:準確稱取分蘗蔥頭蛋白凍干粉50 mg 110 ℃水解24 h,取1 mL水解液蒸干、洗滌、定容至10 mL備用。吸取定容后的液體樣品10 μL,與70 μL硼酸鹽緩沖溶液漩渦混合均勻,再加入20 μL衍生劑充分混合,放置1 min,封口,移入55 ℃烘箱中加熱10 min。測定條件:BEHC18色譜柱,檢測波長266 nm,柱溫49 ℃,樣品溫度20 ℃,流速0.7 mL/min,梯度洗脫程序見表2[26-27]。
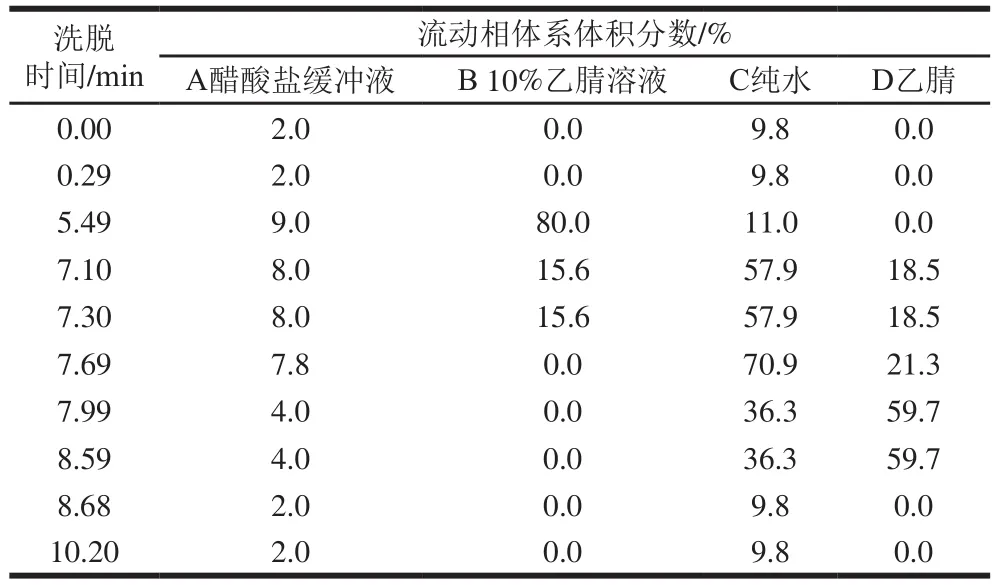
表2 梯度洗脫程序Table 2 Gradient elution program
1.3.6 二級結構的測定
配制8 mg/mL的分蘗蔥頭蛋白溶液,在遠紫外光區190~250 nm波長范圍內掃描,比色池為0.1 cm,光譜帶寬為1 nm,分辨率為0.2 nm,響應時間為0.25 s,掃描速率為10 nm/min,圓二色光譜(circular dichroic spectroscopy,CD)分辨率為20 mdeg,室溫條件下測定蛋白質二級結構并計算相對含量[28-29]。
1.3.7 特征性官能團的測定
采用傅里葉交換紅外檢測器,參照李晉等[30]方法并略有改動。將溴化鉀烘干至質量恒定,準確稱取分蘗蔥頭蛋白樣品2 mg和200 mg溴化鉀于研缽中研磨均勻,采用電動粉末壓片機壓片,于2 cm-1分辨率,4 000~400 nm-1范圍條件下進行掃描測定。
2 結果與分析
2.1 分蘗蔥頭蛋白提取單因素試驗結果
2.1.1 料液比對蛋白提取率的影響

圖1 料液比對蛋白提取率的影響Fig. 1 Effect of solid-to-solvent ratio on the extraction yield of protein
由圖1可知,料液比對分蘗蔥頭蛋白質提取率影響較大,料液比在1∶5~1∶25(g/mL)范圍內變化時,蛋白提取率隨著提取液用量的增加,呈現先升高后降低的趨勢,料液比在1∶15(g/mL)時,提取率最大。在蛋白質提取過程中,適當的增加提取液的用量有助于蛋白質的溶出,可提高分蘗蔥頭蛋白提取率。但繼續增加提取液用量,蛋白質溶出達到飽和,提取率趨于穩定,過多的提取液會使酸沉過程中酸的用量大大增加,致使成本增加。因此選取料液比1∶15(g/mL)為最適宜條件。
2.1.2 pH值對蛋白提取率的影響

圖2 pH值對蛋白提取率的影響Fig. 2 Effect of solvent pH on the extraction yield of protein
由圖2可知,當提取液pH值在8.0~10.0范圍內變化時,隨著提取液pH值的不斷增加,分蘗蔥頭蛋白提取率呈現先上升后下降的趨勢,在pH 9.0時,蛋白提取率達到最大。pH值適當的增加有助于蛋白溶出,但pH值過大,會使蛋白質中的氫鍵斷裂,也可以使蛋白質內部的可解離基團因受強烈的靜電排斥作用造成分子伸展,蛋白質發生變性,從而導致蛋白提取率降低。另外,蛋白質暴露在強堿環境中會改變其營養特性并產生毒副產物[17]。因此選取pH 9.0為最適宜條件。
2.1.3 提取溫度對蛋白提取率的影響

圖3 提取溫度對蛋白提取率的影響Fig. 3 Effect of temperature on the extraction yield of protein
由圖3可知,當提取溫度在20~40 ℃范圍內變化時,隨著溫度的升高,蛋白提取率不斷增加至最大,當提取溫度在40~60 ℃范圍內繼續上升時,蛋白提取率呈現下降趨勢。因為溫度升高,分子的運動速度加快,提高了蛋白溶出率,繼續升高溫度,蛋白質的空間構象發生變化且在一定程度上發生變性沉淀,造成蛋白質溶出量減少,提取率下降[31]。因此選取提取溫度40 ℃為最適宜條件。
2.1.4 提取時間對蛋白提取率的影響

圖4 提取時間對蛋白提取率的影響Fig. 4 Effect of extraction timeon the extraction yield of protein
由圖4可知,提取時間在1~2 h范圍內變化時,隨著提取時間的延長,蛋白提取率呈現上升趨勢,在提取時間為2 h時,蛋白提取率最大,但隨著提取時間繼續延長,提取率趨于平緩。提取時間過短,蛋白質從原料中溶解不完全。但隨著提取時間的延長,蛋白質溶出量達到飽和,因此繼續延長提取時間,蛋白提取率不再有明顯的增加。因此選取提取時間2 h為最適宜條件。
2.1.5 分蘗蔥頭蛋白提取工藝優化
根據單因素試驗結果,分別以料液比、pH值、提取溫度、提取時間為考察因素,以蛋白提取率為評價指標,按L9(34)進行正交試驗,優化最佳提取條件,結果見表3。

表3 正交試驗設計及結果Table 3 Orthogonal array design matrix with experimental results
由表3可知,對分蘗蔥頭蛋白提取率影響因素大小分別為pH值>料液比>提取溫度>提取時間。得到堿溶酸沉法提取的最佳工藝條件為A2B2C3D1,即料液比1∶15(g/mL)、pH 9.0、提取溫度50 ℃、提取時間1.5 h,在此條件下蛋白提取率為79.38%,在此條件下,進行驗證實驗,蛋白提取率為80.12%,與正交試驗優化得到的提取率相差不大。
2.1.6 正交試驗方差分析

表4 正交試驗的方差分析Table 4 Analysis of variance of the experimental results of orthogonal array design
由表4可知,校正模型具有顯著性,A、B、C、D各因素對提取率的影響P值均小于0.01,表明料液比、pH值、提取溫度、提取時間4 個因素對分蘗蔥頭蛋白質的提取影響均極顯著,因此上述4 個影響因素可作為提取過程中影響蛋白提取率的首要考慮因素,且該提取方法可用于分蘗蔥頭蛋白提取。
2.2 分蘗蔥頭蛋白基礎特性測定結果
2.2.1 等電點測定結果
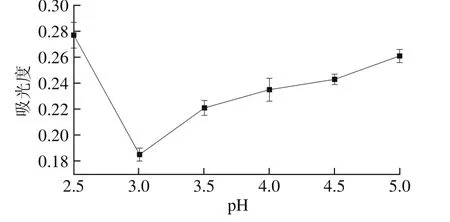
圖5 等電點測定結果Fig. 5 Isoelectric point of the protein
由圖5可知,pH值在2.5~5.0范圍內變化時,樣品上清液吸光度呈現先下降后上升的趨勢,在pH 3.0時吸光度最低,即上清液中蛋白含量最少,此時蛋白質沉淀完全,因此pH 3.0為分蘗蔥頭蛋白的等電點。
2.2.2 紫外-可見分光光度計測定結果

圖6 蛋白溶液紫外-可見光譜掃描Fig. 6 UV-visible spectrum of the protein solution
由圖6可知,在波長270~700 nm范圍內對蛋白溶液進行紫外-可見光譜掃描時,279 nm波長處出現最大吸收峰,且其他波長處曲線較平緩,未見明顯雜峰,而蛋白溶液的紫外-可見光光譜的最大吸收峰在280 nm波長附近。由此可知提取的分蘗蔥頭蛋白純度較高,且結合分光光度法測得純度數據結果可知,凍干粉中蛋白純度為80.02%,說明該方法提取制備分蘗蔥頭蛋白的方法可靠。
2.2.3 蛋白分子質量測定結果
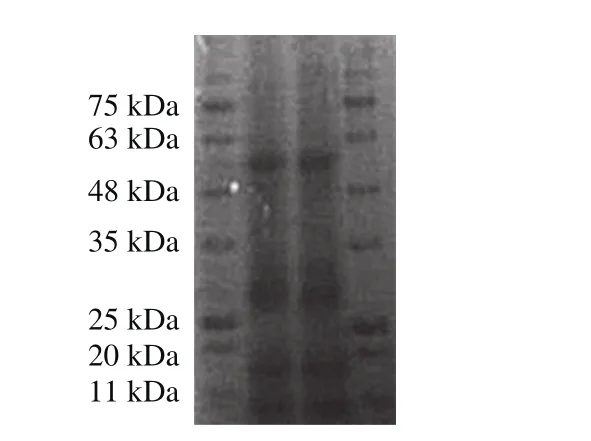
圖7 SDS-PAGE法分析蛋白分子質量電泳圖Fig. 7 SDS-PAGE analysis of the protein
根據SDS-PAGE條帶計算標準蛋白的遷移率,以標準蛋白分子質量的對數為縱坐標,相對遷移率為橫坐標,繪制標準曲線,得到回歸方程:y=-0.595 3x+2.233 5,R2=0.978 4,由圖7可知,分蘗蔥頭蛋白的分子質量在48~63、25~35、17~20 kDa以及11~17 kDa之間均有條帶,在25~35 kDa條帶顏色較深,根據標準曲線方程計算出分蘗蔥頭蛋白的分子質量可分為61.94、27.10、17.62、13.34 kDa 4 組。
2.2.4 氨基酸組分分析

表5 氨基酸組成成分及含量Table 5 Amino acid composition of the protein
由表5可知,分蘗蔥頭蛋白中必需氨基酸質量分數為38.96%,非必需氨基酸質量分數為61.04%,必需氨基酸和非必需氨基酸的比例為0.638,接近世界衛生組織規定值0.666,說明分蘗蔥頭蛋白氨基酸組成較為合理,并且賴氨酸含量較高,可彌補谷物蛋白中賴氨酸含量較低的缺陷。
2.2.5 蛋白二級結構的測定結果
CD是研究低濃度蛋白質分子構象的一種簡單、便捷且準確度較高的方法。蛋白質在遠紫外區的主要生色基團是肽鍵,肽鍵在蛋白質的二級結構中排列規則,且排列方向決定了肽鍵能級躍遷情況,不同蛋白質在二級結構測定過程中產生的譜帶位置和吸收峰強弱都是不同的。α-螺旋構象在222 nm和208 nm波長處呈現負峰,109 nm波長處有一正峰,β-折疊為構象在217~218 nm波長處有一負峰,在195~198 nm波長處有一強的正峰,β-轉角構象在206 nm波長附近有一正峰,無規則卷曲構象在198 nm波長處有一負峰,在220 nm波長處有一小而寬的正峰。
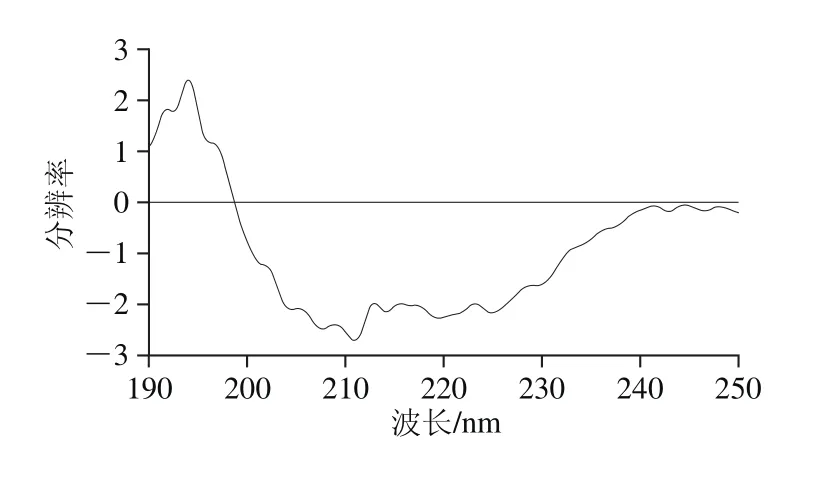
圖8 蛋白的CD圖譜Fig. 8 Far-UV CD spectrum of the protein
由圖8可知,通過CD-Pro軟件計算結果可知,分蘗蔥頭蛋白質中α-螺旋含量為52.60%,β-折疊含量為8.60%,β-轉角含量為15.60%,無規則卷曲含量為22.40%。主要結構為α-螺旋,含量最低的為β-折疊。
2.2.6 特征性官能團測定結果

圖9 蛋白的紅外光譜圖Fig. 9 Infrared spectrum of the protein
由圖9可知,波數在3 303 cm-1處出現了典型的—OH吸收峰,2 935 cm-1出現的峰是由—CH2—反對稱伸縮振動產生的,在2 356 cm-1處的吸收峰是由CO2反對稱伸縮振動引起的,1 653 cm-1處的吸收峰是由蛋白質酰胺I帶特征基團R—CO—NH2中—C=O—伸縮振動產生的,1 530 cm-1處吸收峰是由蛋白質仲酰胺基團中的—NH面內彎曲振動產生的,1 390 cm-1處較弱的吸收峰由蛋白質中游離的COO—對稱伸縮振動產生的,1 249 cm-1處的吸收峰可能由—C(CH3)3中的C—C反對稱伸縮振動產生的,后面出現的小雜峰可能是由于少量水分的存在而引起的[22]。
3 結 論
采用堿溶酸沉法提取分蘗蔥頭中的蛋白質,并通過正交試驗法優化得到最佳提取工藝為料液比1∶15(g/mL)、pH 9.0、提取溫度50 ℃、提取時間1.5 h,此條件下蛋白提取率最大為(79.38±0.90)%。
對所提取的分蘗蔥頭蛋白進行基礎特性研究,實驗結果表明蛋白的等電點為pH 3.0,由紫外-可見光譜圖顯示結果可知,堿溶酸沉法提取的蛋白純度較高,提取方法可靠。電泳條帶顯示,分蘗蔥頭蛋白的分子質量可分為4 個組分,分別為61.94、27.10、17.62、13.34 kDa。高效液相色譜測得結果表明分蘗蔥頭中必需氨基酸質量分數為38.96%,非必需氨基酸質量分數為61.04%。在分蘗蔥頭蛋白二級結構中,α-螺旋含量為52.60%,β-折疊含量為8.60%,β-轉角含量為15.60%,無規則卷曲含量為22.40%。紅外圖譜結果顯示,分蘗蔥頭蛋白的特征性官能團明顯,具有典型的吸收峰。
[1] 趙靖, 宋述堯, 趙春波, 等. 分蘗洋蔥營養成分的保健作用與藥用價值研究進展[J]. 食品工業科技, 2013, 34(23): 365-372.DOI:10.13386/j.issn1002-0306.2013.23.071.
[2] 賈帆. 毛蔥油的提取、組分分析及微膠囊的制備研究[D]. 長春: 長春工業大學, 2014: 1-2.
[3] 李鵬. 從分蘗蔥頭中提取抗氧化活性成分的研究[D]. 長春: 長春工業大學, 2013: 1-8.
[4] 郭文場, 周淑榮, 劉佳賀. 毛蔥的栽種和開發利用(1)[J]. 特種經濟動植物, 2011, 14(5): 45-47. DOI:10.3969/j.issn.1001-4713.2011.04.022.
[5] 徐啟江, 吳姝菊, 徐鑫成, 等. 脫毒分蘗洋蔥高產優質栽培技術[J].北方園藝, 2003(1): 21-22. DOI:10.3969/j.issn.1001-0009.2003.01.013.
[6] 金玉忠, 李志民, 趙福順, 等. 無公害農產品毛蔥生產技術規程[J].蔬菜, 2015(4): 38-40. DOI:10.3969/j.issn.1001-8336.2015.04.020.
[7] 王強, 曹愛麗, 王蘋, 等. 洋蔥油的提取價值及其技術研究[J]. 食品科學, 2001, 22(8): 56-58.
[8] 孫昌平. 超聲波輔助萃取毛蔥油及其抑菌效果的研究[D]. 長春: 吉林農業大學, 2011: 2-5.
[9] 江漫濤, 陳滴. 分蘗蔥頭和長梗薤白的研究(一): 有效成份[J]. 白求恩醫科大學學報, 1984(5): 477-480.
[10] FAN J, LI H T, ZHANG H Y, et al. Optimize conditions for extracting crude oil from Alliums cepa. L. var. agrogatum Don using response surface methodology[J]. IERI Procedia, 2013(5): 304-311.DOI:10.1016/j.ieri.2013.11.108.
[11] 王成武. 分蘗蔥頭栽培技術[J]. 農民致富之友, 2008(3): 162.DOI:10.3969/j.issn.1002-2767.2008.03.069.
[12] 邱俊, 王建剛, 柳杰, 等. 分蘗蔥頭揮發性成分的提取工藝研究[J]. 食品研究與開發, 2013, 34(10): 95-98. DOI:10.3969/j.issn.1005-6521.2013.010.025.
[13] 楊曉虹, 劉銀燕, 劉麗娟, 等. 分蘗蔥頭中新黃酮苷的結構鑒定[J]. 藥學學報, 2000(10): 752-755. DOI:10.3321/j.issn:0513-4870.2000.10.008.
[14] 曾光娟, 李春敏, 張新忠, 等. 適于雙向電泳分析的蘋果葉片蛋白質提取方法[J]. 色譜, 2009, 27(4): 484-488. DOI:10.3321/j.issn:1000-8713.2009.04.021.
[15] 張霞, 王峰. 植物蛋白質的特性及應用價值分析[J]. 現代農業科技,2014(1): 289-291. DOI:10.3969/j.issn.1007-5739.2014.01.187.
[16] XIONG G Y, GAO X Q, WANG P, et al. Comparative study of extraction efficiency and composition of protein recovered from chicken liver by acid-alkaline treatment[J]. Process Biochemistry,2016, 51(10): 1629-1635. DOI:10.1016/j.procbio.2016.07.007.
[17] 趙晨霞, 祝海娟, 張翌楠. 正交試驗優化大麥蟲蛋白質提取工藝[J].食品科學, 2013, 34(16): 42-45. DOI:10.7506/spkx1002-6630-201316009.
[18] WANG M, JIANG L Z. Optimization of extraction process of protein isolate from mungbean[J]. Procedia Engineering, 2011, 15: 5250-5258.DOI:10.1016/j.proeng.2011.08.973.
[19] AMAGLIANI L, O’REGAN J, KELLY A L. et al. The composition,extraction, functionality and applications of rice proteins: a review[J].Trends in Food Science & Technology, 2017, 64: 1-12. DOI:10.1016/j.tifs.2017.01.008.
[20] YU H, KANG B, WEI J, et al. 33 ku protein associated several polypeptides with nearly the same molecular weight but not the same isoelectric point[J]. Chinese Science Bulletin, 2000(1): 57-60.DOI:10.1007/BF02884904.
[21] 劉婷婷, 吳玉瑩, 秦宇婷, 等. 綠豆淀粉工藝廢水中蛋白質的功能性質[J]. 食品科學, 2017, 38(5): 104-110. DOI:10.7506/spkx1002-6630-201705017.
[22] 許彥騰. 黑水虻幼蟲蛋白質提取與抗氧化活性及理化特性研究[D].楊凌: 西北農林科技大學, 2015: 1-12.
[23] BOGOMOLOV A, BELIKOVA V, GALYANIN V, et al. Referencefree spectroscopic determination of fat and protein in milk in the visible and near infrared region below 1 000 nm using spatially resolved diffuse reflectance fiber probe[J]. Talanta, 2017, 167: 563-572. DOI:10.1016/j.talanta.2017.02.047.
[24] ZHANG Y T, TIAN L, LI M F. Protein extraction methods suitable for two-dimensional gel electrophoresis analysis on protein expression in tomato pedicel[C]. Proceedings of the Third Conference on Horticulture Science and Technology, Beijing: science and technology review, 2012.
[25] 李瑩瑩, 吳彩娥, 楊劍婷, 等. 白果蛋白質提取及SDS-PAGE分析[J].食品科學, 2010, 31(22): 36-40.
[26] 許憲祝, 孫言春, 徐衍嶺, 等. 柱前衍生-超高效液相色譜法測定魚卵中的17 種氨基酸[J]. 色譜, 2013, 31(3): 275-280. DOI:10.3724/SP.J.1123.2012.11011.
[27] FIECHTER G, MAYRE H K. Characterization of amino acid profiles of culture media via pre-column 6-aminoquinolyl-N-hydroxysuccinimidyl carbamatederivatization and ultra performance liquid chromatography[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2011, 879(17/18):1353-1360. DOI:10.1016/j.jchromb.2011.02.003.
[28] 胡熠凡, 趙亞周, 田文禮, 等. 蜂王漿中主蛋白成分(MRJP2)的分離純化及圓二色譜分析[J]. 食品科學, 2013, 34(23): 57-61.DOI:10.7506/spkx1002-6630-201323013.
[29] 梁源, 陳敏. 藍隱藻葉綠素蛋白復合物的圓二色譜特性[J]. 煙臺大學學報(自然科學與工程版), 2014(3): 177-183. DOI:10.3969/j.issn.1004-8820.2014.03.005.
[30] 李晉, 徐懷德, 米林峰. 洋蔥多糖的分離純化及單糖組成研究[J]. 中國食品學報, 2012, 12(2): 202-206. DOI:10.3969/j.issn.1009-7848.2012.02.031.
[31] 洪晶, 陳濤濤, 唐夢茹, 等. 響應面法優化韭菜籽蛋白質提取工藝[J]. 中國食品學報, 2013, 13(12): 89-96. DOI:10.16429/j.1009-7848.2013.12.024.
Optimization of Extraction and Characterization of Protein from Allium cepa L. var. agrogatum Don
LIU Tingting, LIU Yang, ZHANG Jing, SONG Yunyu, LI Guijie, ZHANG Yanrong*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
The extraction of protein from Allium cepa L. var. agrogatum Don by alkali dissolution and acid precipitation was optimized using orthogonal array design method. Along with this, the extracted protein was also characterized. The results showed that the maximum extraction efficiency of protein of 79.38% was obtained after extraction at 50 ℃ and pH 9.0 with a solid-to-solvent ratio of 1:15 (g/mL) for 1.5 h. HPLC analysis demonstrated that the protein consisted of 38.96%essential amino acids and 61.04% non-essential amino acids. Electrophoresis showed that the protein was composed of four components with molecular weights of 61.94, 27.10, 17.62, and 13.34 kDa. The secondary structure consisted of 52.60% α-helix, 8.60% β-sheet, 15.60% β-turn and 22.40% random coil. The characteristic functional groups of the protein were confirmed by infrared spectroscopy.
Allium cepa L. var. agrogatum Don; protein; orthogonal array design; characteristics
10.7506/spkx1002-6630-201802042
TS255.1
A
1002-6630(2018)02-0267-06
劉婷婷, 劉陽, 張晶, 等. 分蘗蔥頭蛋白提取工藝優化及其基礎特性[J]. 食品科學, 2018, 39(2): 267-272.
10.7506/spkx1002-6630-201802042. http://www.spkx.net.cn
LIU Tingting, LIU Yang, ZHANG Jing, et al. Optimization of extraction and characterization of protein from Allium cepa L. var. agrogatum Don[J]. Food Science, 2018, 39(2): 267-272. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802042. http://www.spkx.net.cn
2017-06-21
吉林農業大學人才計劃項目(20160509)
劉婷婷(1984—),女,副教授,博士,研究方向為谷物食品科學與副產物高值化利用。E-mail:xcpyfzx@163.com
*通信作者簡介:張艷榮(1965—),女,教授,博士,研究方向為糧油植物蛋白工程與功能食品。E-mail:xcpyfzx@163.com

