杜仲配伍黃芪對雌性大鼠去勢后骨質疏松的影響
王吉博,王兆杰,安榮澤,彭浩,曾旋,王敏
(1遵義醫學院珠海校區,廣東珠海519041;2遵義醫學院第五附屬醫院)
杜仲配伍黃芪對雌性大鼠去勢后骨質疏松的影響
王吉博1,王兆杰2,安榮澤2,彭浩1,曾旋2,王敏1
(1遵義醫學院珠海校區,廣東珠海519041;2遵義醫學院第五附屬醫院)
目的探討杜仲配伍黃芪對雌性大鼠去勢后骨質疏松的治療效果。方法將雌性SD大鼠50只去勢處理后隨機分為杜仲組、黃芪組、杜仲與黃芪配伍組(配伍組)、雌激素組及模型組,并設假手術組,每組10只;前三組分別灌胃給予杜仲水煎液、黃芪水煎液及杜仲聯合黃芪水煎液,雌激素組給予尼爾雌醇,其余組給予等量生理鹽水,連續給藥12周。除假手術組外,其余各組在給藥期間肌注地塞米松磷酸鈉注射液,每周2次。給藥結束后檢測血清鈣、磷、堿性磷酸酶(ALP)、雌二醇(E2)、骨鈣素(BGP)及股骨扭力;收集殘骨進行灰化處理,檢測骨鈣、磷、氯含量。結果①與假手術組比較,其他組血清E2水平均降低,ALP水平均升高;模型組血清鈣、磷水平降低,BGP水平升高。與模型組比較,杜仲組、黃芪組、配伍組、雌激素組血清鈣、磷、E2水平升高,ALP、BGP水平降低。與配伍組比較,杜仲組、黃芪組血清鈣、磷、E2水平降低,ALP、BGP水平升高;雌激素組血清ALP水平降低,E2水平升高。上述指標組間比較P均<0.05。②杜仲組、黃芪組、配伍組、雌激素組、模型組、假手術組股骨扭力分別為(9.70±2.10)、(9.67±1.30)、(10.32±2.37)、(10.69±2.40)、(8.54±1.23)、(12.63±4.95)N/g,假手術組、配伍組、雌激素組均高于模型組(P均<0.05)。③與假手術組比較,模型組骨鈣、骨磷含量降低,骨氯含量升高;雌激素組骨鈣含量降低,骨磷、骨氯含量升高;杜仲組、黃芪組、配伍組骨氯含量升高。與模型組比較,杜仲組、黃芪組、配伍組骨鈣、骨磷含量升高,骨氯含量降低;雌激素組骨磷含量升高,骨氯含量降低。與配伍組比較,杜仲組、黃芪組骨鈣、骨磷含量降低,骨氯含量升高;雌激素組骨鈣含量降低,骨氯含量升高。上述指標組間比較P均<0.05。結論杜仲配伍黃芪對雌性去勢大鼠骨質疏松具有正向調節作用,提高股骨抗外力,抑制骨鈣、骨磷丟失,且效果優于杜仲和黃芪單藥。
骨質疏松;杜仲;黃芪;去勢;糖皮質激素;大鼠
絕經后骨質疏松(PMO)是原發性骨質疏松癥的一種[1]。隨著我國人口老齡化程度逐漸嚴重,PMO發病率逐年升高[2]。目前臨床治療骨質疏松主要以單一靶點化學藥物為主,但效果均不理想[3,4]。臨床實踐證實,中藥可對骨質疏松發揮整體治療作用,且不良反應相對輕微,臨床療效確切[5],但關于杜仲配伍黃芪治療PMO的研究較少。2015年1月~2016年12月,我們觀察了杜仲配伍黃芪對雌性大鼠去勢后骨質疏松的影響。現報告如下。
1 材料與方法
1.1 材料 動物:8月齡雌性SD大鼠100只,體質量250~280 g,購自長沙市天勤生物技術有限公司[動物合格證號:scxk(湘)2014-0010,清潔級]。大鼠標準飼料喂養于遵義醫學院實驗室,自由進食及飲水。實驗室生物安全防護水平BSL-1級,自然光照,溫度18~22 ℃,相對濕度50%~70%。主要藥物:杜仲,珠海萬寶中藥飲片有限公司,批號161001;黃芪,廣東匯群中藥飲片股份有限公司,批號20160901;地塞米松磷酸鈉注射液,貴州天地藥業有限責任公司,國藥準字號H52020477,批號140328,規格:1 mL/5 mg;尼爾雌醇片,湖南正清制藥集團股份有限公司,國藥準字號H19983206,批號131216,規格:5 mg。主要試劑盒:鈣、磷、堿性磷酸酶(ALP)試劑盒,南京建成生物技術公司;雌二醇(E2)、骨鈣素(BGP)放射免疫試劑盒,北京原子高科股份有限公司。主要儀器:小動物骨骼強度測定儀,上海軟隆科技發展有限公司,型號:BW-YLS-16A;X-射線能譜儀,美國伊達克斯有限公司。
1.2 實驗方法
1.2.1 去勢雌性大鼠制備 將90只大鼠適應性喂養7天,給予水合氯醛(220 mg/kg)麻醉。麻醉后趴位固定,在大鼠腰部腎區偏下中間位置皮膚剪口2~3 cm,鈍性剝離至腹腔,用鑷子夾出子宮后結扎,摘除卵巢,再將子宮送回腹腔,縫合。術后肌注青霉素40萬U/(kg·d),連續給藥3天。自術后7天開始連續5天行陰道脫落細胞涂片檢查,若涂片未發現角化上皮細胞,提示去勢大鼠造模成功。將未成功去勢或造模過程中死亡大鼠剔除本實驗。優選50只造模成功大鼠進行后續研究。
1.2.2 動物分組處理 將50只去勢大鼠隨機分為五組,分別為杜仲組、黃芪組、杜仲與黃芪配伍組(配伍組)、雌激素組及模型組,每組10只。另取10只大鼠同法手術但不去勢(即不摘除卵巢)作為假手術組。杜仲組、黃芪組、配伍組分別灌胃給予杜仲水煎液(杜仲5.4 g/kg)、黃芪水煎液(黃芪5.4 g/kg)及杜仲聯合黃芪水煎液(杜仲2.7 g/kg、黃芪2.7 g/kg);雌激素組給予尼爾雌醇(0.18 mg/kg)灌胃;模型組、假手術組給予等量蒸餾水灌胃。各組均于術后第7天開始給藥,1次/d,連續給藥12周。除假手術組外,其余各組在給藥期間肌注地塞米松磷酸鈉注射液,每周2次(周一、四);假手術組注射等量生理鹽水。
1.3 相關指標觀察 ①血清鈣、磷、ALP、E2與BGP:給藥結束后以腹腔注射水合氯醛(3.5%,10 mL/kg)麻醉大鼠,頸外靜脈采血,3 000 r/min離心15 min,獲得血清。采用全自動生化儀檢測血清鈣、磷、ALP,采用放射免疫法檢測血清E2、BGP,所有檢測嚴格參照試劑盒說明進行操作。②股骨扭力:將完成采血的大鼠脫頸處死,解剖獲得左右兩側股骨(將股骨上附著的肌肉與結締組織完全剔除),采用小動物骨骼強度測定儀檢測股骨扭力[6]。③骨灰鈣、磷、氯:完成扭力檢測后收集殘骨,以800 ℃進行灰化處理,采用X-射線能譜儀檢測骨鈣、磷、氯含量。
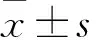
2 結果
2.1 各組血清鈣、磷、ALP、E2與BGP水平比較 與假手術組比較,其他組血清E2水平均降低,ALP水平均升高;模型組血清鈣、磷水平降低,BGP水平升高(P均<0.05)。與模型組比較,杜仲組、黃芪組、配伍組、雌激素組血清鈣、磷、E2水平升高,ALP、BGP水平降低(P均<0.05)。與配伍組比較,杜仲組、黃芪組血清鈣、磷、E2水平降低,ALP、BGP水平升高;雌激素組血清ALP水平降低,E2水平升高(P<0.05)。見表1。

表1 各組血清鈣、磷、ALP、E2與BGP水平比較
注:與假手術組比較,*P<0.05;與模型組比較,#P<0.05;與配伍組比較,▲P<0.05。
2.2 各組股骨扭力比較 杜仲組、黃芪組、配伍組、雌激素組、模型組、假手術組股骨扭力分別為(9.70±2.10)、(9.67±1.30)、(10.32±2.37)、(10.69±2.40)、(8.54±1.23)、(12.63±4.95)N/g,假手術組、配伍組、雌激素組均高于模型組(P均<0.05)。
2.3 各組骨鈣、磷、氯含量比較 與假手術組比較,模型組骨鈣、骨磷含量降低,骨氯含量升高;雌激素組骨鈣含量降低,骨磷、骨氯含量升高;杜仲組、黃芪組、配伍組骨氯含量升高。與模型組比較,杜仲組、黃芪組、配伍組骨鈣、骨磷含量升高,骨氯含量降低;雌激素組骨磷含量升高,骨氯含量降低。與配伍組比較,杜仲組、黃芪組骨鈣、骨磷含量降低,骨氯含量升高;雌激素組骨鈣含量降低,骨氯含量升高。上述指標組間比較P均<0.05。見表2。
3 討論
現代中醫理論根據PMO的某些臨床癥狀,如易發骨折、腰背或全身多處疼痛、駝背等,將其歸屬于“骨痿”“骨枯”“骨極”“骨痹”等范疇[7]。祖國醫學認為,腎與骨的關系非常密切,早在《皇帝內經》中已有大量而明確的論述。腎是先天之本,主骨生髓,骨的生長、發育、衰弱與腎精盛衰密切相關。女性在絕經之后,腎精虧虛,骨髓生化乏源,致骨骼脆弱。脾為后天之本,主百骸。先天之精有賴于后天脾胃運化水谷精微的不斷充養,若脾胃虛弱,運化乏力,先天之精無以充養,則精虧髓空,百骸痿廢。因此,本病的病因當首責于腎虧,其次為脾虛。杜仲性味甘溫,入肝腎二經,有補肝腎、強筋骨之功,可用于治療各種腰痛,是防治骨質疏松癥的一味良藥[8]。黃芪味甘,性微溫,歸肝、脾、肺、腎經,是臨床上常用的補益藥,在治療骨質疏松的方藥中頻繁應用。由此可見,杜仲與黃芪的中藥藥理切中PMO病機。當代醫學證實,杜仲在促進成骨樣細胞以及成骨細胞增殖方面均具有明確作用[9~12]。近年研究發現,黃芪在體外試驗中可抑制破骨細胞的骨吸收,并通過有效防止大鼠去勢后骨量丟失而發揮防治PMO作用[13]。

表2 各組骨鈣、磷、氯含量比較
注:與假手術組比較,*P<0.01;與模型組比較,#P<0.05;與配伍組比較,▲P<0.05。
將去卵巢大鼠作為臨床研究骨質疏松癥的首推動物模型同時獲得了WHO與美國食品藥品管理局的認可[14]。大鼠在去除卵巢后其體內雌激素水平快速降低,與此同時對破骨細胞的抑制作用相應減弱,骨吸收呈亢進狀態。在此種情況下,代償性骨形成將會增強,繼而表現為高轉換狀態;但實際情況卻是骨形成仍不及骨吸收,整個骨代謝處于失衡狀態,總體骨量及骨強度較正常水平減少或下降,這與婦女絕經后的骨丟失狀態大體上一致。外源性糖皮質激素所致骨質疏松是一種發病率僅次于PMO的骨質疏松類型,主要發生于長期使用糖皮質激素治療患者,長期使用糖皮質激素能抑制成骨細胞活性,并促進破骨細胞活化,進而導致骨質疏松。外源性糖皮質激素所致的骨質疏松是當前最常見的藥源性骨質疏松造模方法[15]。本研究通過去勢及糖皮質激素誘導建立的骨質疏松雌性大鼠模型既符合國際骨質疏松建模習慣,也接近臨床PMO患者的實際情況。
PMO的形成是一個相對漫長的過程,有效的骨活性藥物臨床應用3~4年也未必能顯示出顯著的治療效果,在短時間內很難看到直觀作用[16]。因某些血清生化指標可在一定程度上反映骨代謝的實際水平,故可將其作為評價藥物治療效果的主要參考依據。機體正常的骨代謝調節主要包括三個方面,分別為腸道的吸收與排泌、腎臟的濾過與重吸收以及骨骼的礦化與再吸收。在上述過程中,血液中鈣、磷含量將直接影響骨的鈣化及溶解[17]。本研究結果顯示,與模型組比較,各組血鈣與血磷均有不同程度升高,且配伍組效果強于單藥,提示杜仲配伍黃芪可提高血鈣、磷濃度,促進鈣、磷沉積,進而增強機體內成骨細胞增殖活動。動物實驗與臨床研究均表明,女性在絕經后其機體雌激素水平降低是導致骨質疏松的主要原因。E2作為調節骨代謝的重要雌激素,在絕經后其水平迅速降低,引起骨轉換加快。BGP又稱骨Gla蛋白,是由49個氨基酸殘基組成的直鏈多肽,屬非骨膠原蛋白的一種。血BGP來源于成骨性細胞譜系,主要由非增殖期成骨細胞分泌入血,BGP含有維生素K依賴性γ-輕基骨氨酸,具有結合鈣的特性。因此認為BGP可能參與了骨礦化調節。骨轉換率增加時血BGP升高,BGP是反映骨形成的特異指標。本研究結果顯示,模型組血清E2水平降低,BGP水平升高。當卵巢被摘除后,雌性大鼠體內的雌激素嚴重不足,繼而導致對破骨細胞的抑制作用顯著減弱,骨吸收亢進導致代償性骨形成增強,最終呈現出骨的高轉換狀態。在骨吸收大于骨形成的情況下,骨代謝平衡遭到破壞,繼而導致骨丟失,誘導骨高轉換型骨質疏松的發生。本研究結果顯示,去勢大鼠在接受杜仲配伍黃芪的藥物處理后,其體內E2含量明顯增加,BGP含量降低,提示杜仲與黃芪配伍對骨質疏松有明顯的正向調節作用,其具體作用機制可能是兩藥可直接提高去勢大鼠的雌激素水平或發揮類雌激素作用。ALP由成骨細胞產生,其活性水平直接反映成骨細胞活性。成骨活躍時ALP水平升高,一部分直接參與骨鈣化;另一部分釋放入血,使血中酶活性增強。因此,ALP被認為是評價機體成骨活性和骨組織鈣化能力的具有較高特異性的指標[18]。本實驗中去勢大鼠由于雌激素減少或缺乏使其對破骨細胞的抑制作用解除,骨吸收顯著增加,隨之骨形成增加,ALP活性增加,提示去勢大鼠成骨細胞活躍、骨轉換增強。在藥物干預后代償性反應相應減弱,ALP水平降低。
骨力學強度下降是PMO的本質特征,骨生物力學和骨鈣、磷含量是衡量骨質量的重要指標,可以反映骨質疏松的程度,亦是預測骨折危險性的重要指標。另有研究表明,病骨中氯含量一般較正常骨高出兩倍以上。本研究對實驗大鼠的股骨生物力學扭力進行檢測,同時檢測骨灰中鈣、磷、氯含量。結果顯示,與假手術組比較,模型組骨鈣、骨磷含量降低,骨氯含量升高;與模型組比較,杜仲組、黃芪組、配伍組骨鈣、骨磷含量升高,骨氯含量降低。提示杜仲配伍黃芪可明顯提高去勢雌性大鼠股骨的抗外力性能,且能抑制骨鈣、骨磷丟失。
綜上所述,杜仲配伍黃芪對去勢雌性大鼠骨質疏松可發揮明顯的正向調節作用,提高股骨的抗外力性能,抑制骨鈣、骨磷丟失,且效果優于杜仲和黃芪單藥。
[1] 黎宗保.激素替代療法聯合阿侖膦酸鈉治療對絕經后骨質疏松癥患者子宮內膜及骨代謝的影響[J].山東醫藥,2016,56(25):90-92.
[2] 鐘秋生,韓臨曉,陸向然,等.絕經后骨質疏松癥證候規律研究[J].世界中西醫結合雜志,2013,8(s1):30-32.
[3] 中華醫學會骨質疏松和骨礦鹽疾病分會.原發性骨質疏松癥診治指南(2011)[J].中華骨質疏松和骨礦鹽疾病雜志,2011,4(1):2-17.
[4] 歐莉,張素寧,曾小紅,等.黃芪配伍熟地對去卵巢骨質疏松癥大鼠骨組織形態的影響[J].時珍國醫國藥,2013,24(5):1097-1098.
[5] 戴鵬,鄧鳴濤,張立超,等.杜仲葉對去勢骨質疏松大鼠骨代謝的影響[J].中國骨質疏松雜志,2012,18(12):1127-1130.
[6] 張敏,孫付軍,虞慧娟,等.葛藤提取物對糖皮質激素骨質疏松模型大鼠的影響[J].中國骨質疏松雜志,2011,17(7):589-592.
[7] 謝雁鳴,宇文亞,董福慧,等.原發性骨質疏松癥中醫臨床實踐指南(摘錄)[J].中華中醫藥雜志,2012,27(7):1886-1890.
[8] 陸成龍,范鑫梅,郭艷幸.杜仲對骨形成作用的研究進展[J].中醫藥導報,2016,22(7):104-106.
[9] 王度,戴燚,范彥博,等.中藥杜仲補骨脂對去勢鼠成骨細胞增殖以及MMP3/OPM通路蛋白表達的作用[J].中國醫院藥學雜志,2016,36(8):620-624.
[10] 徐祥赫,劉釗,王虹,等.杜仲對MC3T3-E1成骨細胞及的影響值[J].天津醫科大學學報,2013,19(3):203-205.
[11] 李三華,何志全,陳全利,等.杜仲總黃酮對成骨細胞增殖及Ⅰ型膠原蛋白表達的影響[J].西北藥學雜志,2011,26(4):272-274.
[12] 張立超,鄧嗚濤,戴鵬,等.杜仲葉通過激活ERK及AKT磷酸化促進大鼠成骨細胞增殖的研究[J].中國骨質疏松雜志,2013,19(3):217-220.
[13] 潘靜華,張海嘯,李芳芳,等.黃芪對去卵巢大鼠骨組織的動態影響[J].中國中醫基礎醫學雜志,2010,3(3):251-253.
[14] 朱克儉,黃敏,郭喜庚.藤黃健骨片對去勢骨質疏松模型大鼠干預作用的實驗研究[J].國醫論壇,2015,30(6):57-60.
[15] 劉仁慧,康學,張偉華,等.女貞子配伍對GIOP大鼠骨代謝生化指標的影響研究[J].世界中醫藥,2013,8(12):1450-1453.
[16] 歐莉,曾小紅,衛培峰.黃芪配伍熟地對去勢大鼠骨礦含量及生物力學的影響[J].中國醫院藥學雜志,2013,33(16):1318-1321.
[17] 鄧偉坤,李艷卿,李敏研.中藥復骨方對糖皮質激素致骨質疏松骨折大鼠骨代謝及骨密度的影響[J].中國當代醫藥,2014,21(16):8-11.
[18] 姚榮成,謝宇,張悅,等.JGYS對大鼠去卵巢高轉換型骨質疏松癥的影響[J].昆明醫科大學學報,2015,36(1):4-11.
貴州省科學技術基金資助項目(黔科合LH字[2014]7580號)。
10.3969/j.issn.1002-266X.2017.48.009
R681.1
A
1002-266X(2017)48-0031-04
2017-04-09)

