強(qiáng)直性脊柱炎患者血清和關(guān)節(jié)液中IL-17、IL-4水平變化及意義
孟景紅,趙海濤,陳海英
(河北醫(yī)科大學(xué)第三醫(yī)院,石家莊050051)
強(qiáng)直性脊柱炎患者血清和關(guān)節(jié)液中IL-17、IL-4水平變化及意義
孟景紅,趙海濤,陳海英
(河北醫(yī)科大學(xué)第三醫(yī)院,石家莊050051)
目的探討強(qiáng)直性脊柱炎(AS)患者血清和關(guān)節(jié)液中IL-17、IL-4水平變化及意義。方法選取初治AS患者42例(觀察組),體檢健康者20例(對(duì)照組)。采用ELISA法檢測(cè)兩組血清及觀察組關(guān)節(jié)液IL-17、IL-4,計(jì)算IL-17/IL-4;采用Pearson相關(guān)分析法分析AS患者血清IL-17、IL-4、IL-17/IL-4與血小板數(shù)量、白細(xì)胞數(shù)量、紅細(xì)胞沉降率(ESR)、CRP、Bath強(qiáng)直性脊柱炎病情活動(dòng)指數(shù)(BASDAI)的相關(guān)性。結(jié)果觀察組血清IL-17水平及IL-17/IL-4均高于對(duì)照組,血清IL-4水平低于對(duì)照組,組間比較P均<0.01。觀察組關(guān)節(jié)液中IL-17、IL-4水平均高于血清(P均<0.01)。AS患者血清IL-17、IL-17/IL-4與血小板數(shù)量、ESR、CRP、BASDAI呈正相關(guān)(P<0.05或<0.01);IL-4與血小板數(shù)量、ESR、CRP、BASDAI呈負(fù)相關(guān)(P<0.05或<0.01);IL-17、IL-4、IL-17/IL-4與白細(xì)胞數(shù)量均無(wú)相關(guān)性(P均>0.05)。結(jié)論AS患者血清及關(guān)節(jié)液中均存在IL-17水平升高、IL-4水平降低、IL-17/IL-4失衡,檢測(cè)IL-17、IL-4水平變化有助于了解AS病情程度、疾病活動(dòng)度及判斷患者預(yù)后。
強(qiáng)直性脊柱炎;白細(xì)胞介素17;白細(xì)胞介素4;血清;關(guān)節(jié)液
強(qiáng)直性脊柱炎(AS)是一種主要侵犯人體中軸骨關(guān)節(jié)系統(tǒng)及外周大關(guān)節(jié)的慢性進(jìn)行性自身免疫性疾病,主要累及滑膜關(guān)節(jié)、軟骨關(guān)節(jié)以及肌腱、韌帶附著骨等部位,以骶髂關(guān)節(jié)炎為主要臨床表現(xiàn),致殘率較高。目前認(rèn)為,AS的發(fā)生與免疫系統(tǒng)失調(diào)、炎癥反應(yīng)、遺傳等因素有關(guān),但確切發(fā)病機(jī)制尚未闡明。IL-17是由輔助性T細(xì)胞17(Th17)產(chǎn)生的前炎癥細(xì)胞因子,具有促進(jìn)炎癥反應(yīng)的作用;IL-4是由Th2細(xì)胞分泌的細(xì)胞因子,可抑制細(xì)胞免疫、促進(jìn)體液免疫。目前,關(guān)于IL-17、IL-4與AS發(fā)生、發(fā)展關(guān)系的報(bào)道較少。本研究探討AS患者血清和關(guān)節(jié)液中IL-17、IL-4水平變化及意義。
1 資料與方法
1.1 臨床資料 選取2015年10月~2016年6月我院收治的初治AS患者42例(觀察組),診斷均符合1984年修訂的AS紐約標(biāo)準(zhǔn)。其中男33例、女9例,年齡18~52(32.4±9.3)歲,病程0.25~40(18.2±8.0)年,均累及膝關(guān)節(jié),白細(xì)胞數(shù)量[4~10(6.5±1.9)]×109/L,血小板數(shù)量[219~639(365.9±92.7)]×109/L,紅細(xì)胞沉降率(ESR)10~122(55.4±27.8)mm/h,CRP 8~99(42.6±26.0)mg/L,Bath強(qiáng)直性脊柱炎病情活動(dòng)指數(shù)(BASDAI)2~9(4.8±2.0)。排除其他免疫相關(guān)性疾病及嚴(yán)重心、肝、腎等疾病患者。選擇同期體檢健康者20例為對(duì)照組,男16例、女4例,年齡19~47(29.5±8.4)歲。兩組性別、年齡具有可比性。
1.2 血清及關(guān)節(jié)液IL-17、IL-4檢測(cè) 分別采集兩組清晨空腹靜脈血3 mL,室溫靜置20 min,3 000 r/min離心20 min,收集血清,置于-80 ℃冰箱保存待測(cè);抽取AS患者膝關(guān)節(jié)內(nèi)關(guān)節(jié)液5 mL,靜置2 h,抽取上清液,置于-80 ℃冰箱保存待測(cè)。采用ELISA法檢測(cè)血清及關(guān)節(jié)液IL-17、IL-4,具體步驟參照試劑盒(RD生物科學(xué)公司)說(shuō)明書。計(jì)算IL-17/IL-4。
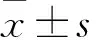
2 結(jié)果
2.1 血清和關(guān)節(jié)液IL-17、IL-4及IL-17/IL-4 觀察組血清IL-17水平及IL-17/IL-4均高于對(duì)照組,血清IL-4水平均低于對(duì)照組,組間比較P均<0.01,見(jiàn)表1。觀察組關(guān)節(jié)液IL-17、IL-4水平均高于血清(P均<0.01),見(jiàn)表2。
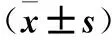
表1 兩組血清IL-17、IL-4水平及IL-17/IL-4比較
注:與對(duì)照組比較,*P<0.01。
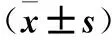
表2 觀察組血清和關(guān)節(jié)液中IL-17、IL-4水平及IL-17/IL-4比較
注:與血清比較,*P<0.01。
2.2 AS患者血清IL-17、IL-4、IL-17/IL-4與白細(xì)胞數(shù)量血小板數(shù)量、ESR、CRP、BASDAI的相關(guān)性 AS患者血清IL-17、IL-17/IL-4與血小板數(shù)量、ESR、CRP、BASDAI均呈正相關(guān)(P<0.05或<0.01);IL-4與血小板數(shù)量、ESR、CRP、BASDAI均呈負(fù)相關(guān)(P<0.05或<0.01);IL-17、IL-4、IL-17/IL-4與白細(xì)胞數(shù)量均無(wú)相關(guān)性(P均>0.05)。見(jiàn)表3。
3 討論
AS的主要發(fā)病機(jī)制可能是具有一定遺傳背景的易感個(gè)體出現(xiàn)免疫功能紊亂,導(dǎo)致細(xì)胞因子網(wǎng)絡(luò)失衡,開(kāi)啟瀑布式炎癥反應(yīng),激活更為廣泛的效應(yīng)機(jī)制,最終導(dǎo)致關(guān)節(jié)破壞及修復(fù)的病理過(guò)程[1]。Th17、調(diào)節(jié)性T細(xì)胞(Treg)是除Th1、Th2細(xì)胞亞群外的另一對(duì)免疫調(diào)控細(xì)胞。IL-17是由Th17細(xì)胞產(chǎn)生的前炎癥細(xì)胞因子,介導(dǎo)防御胞外病原微生物感染[2]。IL-4是由Th2細(xì)胞分泌的抗炎癥細(xì)胞因子。研究發(fā)現(xiàn),IL-17/IL-4失衡可能是關(guān)節(jié)炎的啟動(dòng)環(huán)節(jié),糾正IL-17/IL-4失衡可能阻止疾病的進(jìn)展[3]。

表3 AS患者血清IL-17、IL-4、IL-17/IL-4與白細(xì)胞數(shù)量血小板數(shù)量、ESR、CRP、BASDAI的相關(guān)性
IL-17與受體結(jié)合后被激活,促進(jìn)趨化因子、集落刺激因子和黏附分子表達(dá)或釋放,招募炎癥細(xì)胞尤其是嗜中性粒細(xì)胞,刺激巨噬細(xì)胞產(chǎn)生IL-1β、TNF-α、IL-6和前列腺素E2(PGE2)等因子,誘導(dǎo)并促進(jìn)炎癥反應(yīng),導(dǎo)致細(xì)胞浸潤(rùn)和組織破壞,影響感染、腫瘤和自身免疫性疾病等病理過(guò)程[1]。研究發(fā)現(xiàn),在系統(tǒng)性紅斑狼瘡、類風(fēng)濕關(guān)節(jié)炎、銀屑病、多發(fā)性硬化癥及幼年特發(fā)性關(guān)節(jié)炎等多種自身免疫性疾病中IL-17水平均升高,參與上述疾病的發(fā)生、發(fā)展[4~6]。在自身免疫性疾病動(dòng)物模型中,IL-17缺乏可阻止疾病發(fā)生;在實(shí)驗(yàn)性關(guān)節(jié)炎的發(fā)生過(guò)程中阻斷IL-17表達(dá),可以阻止關(guān)節(jié)及骨質(zhì)破壞[7],提示IL-17是多種自身免疫病重要的致病因子,具有增強(qiáng)病理性免疫反應(yīng)和促進(jìn)炎癥反應(yīng)的作用。Mcinnes等[8]報(bào)道,IL-17可誘導(dǎo)破骨細(xì)胞生成,與破骨細(xì)胞IL-17受體結(jié)合,促進(jìn)骨破壞的發(fā)生,在關(guān)節(jié)損傷中發(fā)揮重要作用。Koenders等[9]發(fā)現(xiàn),在關(guān)節(jié)炎癥發(fā)生的早期階段,IL-17和TNF-α對(duì)炎癥的發(fā)展及關(guān)節(jié)骨質(zhì)的破壞具有協(xié)同誘導(dǎo)作用;但關(guān)節(jié)炎一旦發(fā)生,IL-17可以不依賴TNF-α而單獨(dú)發(fā)揮促炎及破壞骨質(zhì)的作用。IL-17是關(guān)節(jié)炎和骨質(zhì)破壞發(fā)生的獨(dú)立危險(xiǎn)因素[10]。關(guān)節(jié)腔內(nèi)持續(xù)注射IL-17可以促進(jìn)關(guān)節(jié)炎的發(fā)生,其可能通過(guò)對(duì)病理性滑膜進(jìn)行持續(xù)性的炎性刺激,并且激活滑膜細(xì)胞及炎性細(xì)胞的抗凋亡機(jī)制,從而使這些細(xì)胞聚集在關(guān)節(jié)腔,最終形成病理性損傷[10]。在動(dòng)物關(guān)節(jié)炎病變組織局部分離出的單個(gè)核細(xì)胞高表達(dá) IL-17,且病灶內(nèi)IL-17表達(dá)量與疾病的嚴(yán)重程度密切相關(guān)[11]。
IL-4是由Th2細(xì)胞分泌的細(xì)胞因子,主要作用于B細(xì)胞、T細(xì)胞、巨噬細(xì)胞和肥大細(xì)胞等靶細(xì)胞,可抑制Th1和細(xì)胞毒T淋巴細(xì)胞(Tc1)增殖及產(chǎn)生細(xì)胞因子,抑制細(xì)胞免疫、促進(jìn)體液免疫,增強(qiáng)殺傷細(xì)胞的特異性及非特異性殺傷功能[12]。IL-4能夠抑制單核-巨噬細(xì)胞產(chǎn)生IL-1β、TNF-α、IL-8、PGE等,下調(diào)活化的單核-巨噬細(xì)胞分泌氧自由基[13]。隨著IL-4水平逐漸降低,其抑制炎癥反應(yīng)的能力逐漸減弱,自身的免疫穩(wěn)態(tài)遭到破壞,促進(jìn)免疫相關(guān)性疾病的發(fā)生、發(fā)展。動(dòng)物研究發(fā)現(xiàn),抗IL-4抗體可使小鼠膠原誘導(dǎo)性關(guān)節(jié)炎加重,系統(tǒng)給予IL-4可阻止小鼠關(guān)節(jié)炎癥進(jìn)展及關(guān)節(jié)組織學(xué)改變,顯著減輕急性關(guān)節(jié)炎癥狀。IL-4還可通過(guò)抑制損傷性蛋白酶-基質(zhì)金屬蛋白酶來(lái)降低關(guān)節(jié)損傷程度[14]。在膠原誘導(dǎo)性關(guān)節(jié)炎動(dòng)物模型中通過(guò)腺病毒載體植入IL-4基因,可抑制炎性介質(zhì)IL-6、IL-12、IL-17和滑膜骨蛋白原配體的產(chǎn)生,從而阻止軟骨及骨質(zhì)的破壞[15,16]。去除IL-4基因的小鼠關(guān)節(jié)炎程度明顯加重[17]。但是,Wang等[18]研究發(fā)現(xiàn),AS患者血清IL-4水平明顯降低。上述研究結(jié)果提示,在免疫相關(guān)性關(guān)節(jié)炎的發(fā)病過(guò)程中IL-4可通過(guò)不同的機(jī)制阻止關(guān)節(jié)炎的發(fā)生及發(fā)展。在膠原誘導(dǎo)的關(guān)節(jié)炎發(fā)生初期,IL-4可通過(guò)T細(xì)胞抑制IL-17產(chǎn)生,進(jìn)而減輕關(guān)節(jié)局部的炎癥反應(yīng),但在疾病后期卻不能發(fā)揮相似的作用[19,20]。
本研究結(jié)果顯示,AS患者血清IL-17水平及IL-17/IL-4均較健康對(duì)照者明顯升高,IL-4水平較健康對(duì)照者明顯降低,提示IL-17促進(jìn)AS發(fā)生,IL-4則抑制AS發(fā)病,IL-17/IL-4失衡促進(jìn)關(guān)節(jié)炎的發(fā)生。上述結(jié)果與動(dòng)物實(shí)驗(yàn)研究結(jié)果一致[21]。AS患者膝關(guān)節(jié)液中IL-17水平高于血清,且本研究AS患者病變均累及膝關(guān)節(jié),提示IL-17在關(guān)節(jié)病變和骨質(zhì)破壞中可能占據(jù)更重要的地位;關(guān)節(jié)液中IL-4水平高于其血清水平,提示在關(guān)節(jié)炎發(fā)生時(shí)IL-4有向關(guān)節(jié)炎癥部位聚集的傾向,以恢復(fù)局部IL-17/IL-4平衡,控制局部炎癥反應(yīng)。血小板數(shù)量、ESR、CRP、BASDAI均為評(píng)價(jià)AS患者病情程度、疾病活動(dòng)度及預(yù)后的指標(biāo)。AS患者血清IL-17水平均與血小板數(shù)量、ESR、CRP、BASDAI呈正相關(guān),IL-4與血小板數(shù)量、ESR、CRP、BASDAI呈負(fù)相關(guān),提示血清IL-17、IL-4水平可以反映AS疾病活動(dòng)度,檢測(cè)二者水平有助于判斷患者預(yù)后。血清IL-17、IL-4水平均與白細(xì)胞數(shù)量無(wú)相關(guān)性,可能與白細(xì)胞數(shù)量受多種因素影響有關(guān)。
綜上所述,AS患者血清及關(guān)節(jié)液中均存在IL-17水平升高、IL-4水平降低、IL-17/IL-4失衡,檢測(cè)IL-17、IL-4水平變化有助于了解AS病情程度、疾病活動(dòng)度及判斷患者預(yù)后。
[1] Harrington LE, Mangan PR, Weaver CT, et al. Expanding the effector CD4 T-cell repertoire: the Th17 lineage[J]. Curr Opin immunol, 2006,3(18):349-356.
[2] Lubberts E. Th17 cytokines and arthritis[J]. Semin Immunopathol, 2010,32(1):43-53.
[3] Lowesl MA, Kikuchil T, Fuentes-Duculanl J, et al. Psoriasis vulgaris lesions contain discrete populations of Th1 and Th17 T cells[J]. J Invest Dermatol, 2008,5(128):1207-1211.
[4] 武樹(shù)朋.血清GM-CSF、TNF-α及IL-17在類風(fēng)濕關(guān)節(jié)炎中的表達(dá)及相關(guān)性[J].中華風(fēng)濕病學(xué)雜志,2017,12(37):3041-3042.
[5] 白雪,高美華,王好玉等.TH17細(xì)胞相關(guān)細(xì)胞因子IL-17和IL-23在系統(tǒng)性紅斑狼瘡中的表達(dá)及其意義[J].現(xiàn)代生物醫(yī)學(xué)進(jìn)展,2013,10(13):1937-1940.
[6] Agarwal S, Misra R, Aggarwal A. Interleukin 17 levels are increased in juvenile idiopathic arthritis synovial fluid and induce synovial fibroblasts to produce proinflammatory cytokines and matrix metalloproteinases[J]. J Rheumatol, 2008,3(35):515-519.
[7] Koenders MI, Lubberts E, Opper Walgreen B, et al. Blocking of
IL-17 during reactivation of experimental arthritis prevent joint inflammation and bone erosion by decreasing RANKL and IL-1[J]. Am J Pathol, 2005,167(1):141-149.
[8] Mcinnes IB, Liew FY. Cytokine networks-towards new therapies for rheumatoid arthritis[J]. Nat Rev Rhrumatol, 2005,1(1):31-39.
[9] Koenders MI, Lubberts E, Van de Loo FA, et al. Interleukin-17 acts independently of TNF-alpha under arthritic conditions[J]. J Immunol, 2006,176(10):626-629.
[10] Benedetti G, Miossec P. Interleukin 17 contributes to the chronicity of inflammatory diseases such as rheumatoid arthritis[J]. Eur J Immunol, 2014,2(44):339-347.
[11] Lubberts E. IL-17/Th17 targeting: on the road to prevent chronic destructive arthritis[J]. Cytokine, 2008,41(2):84-91.
[12] 劉秀娟,黃勝起,王阿妮,等.白細(xì)胞介素-17與細(xì)胞核因子-κB受體活化因子配體在強(qiáng)直性脊柱炎患者血清中表達(dá)的研究[J].中華風(fēng)濕病學(xué)雜志,2013,11(17):769-771.
[13] Chen WS, Chang YS, Lin KC, et al. Association of serum interleukin-17 and interleukin-23 leves with disease activity in Chinese patients with ankylosing spondylitis[J]. J Chin Med Assoc, 2012,75(7):303-308.
[14] Sarah EW, Danielle D, Taher E, et al. Targeted delivery of cytokine therapy to rheumatoid tissue by a synovial targeting peptide[J]. Ann Rheum Dis, 2013,1(72):129-135.
[15] Lubberts E, Joosten LA, van Den Bersselaar L, et al. Adenoviral vector-mediated overexpression of IL-4 in the knee joint of mice with collagen-induced arthritis prevents cartilage destruction[J]. J Immunol, 1999,163(8):4546-4556.
[16] Joosten LA, Lubberts E, Helsen MM, et al. Protection against cartilage and bone destruction by systemic interleukin-4 treatment in established murine type Ⅱ collagen-induced arthritis[J]. Arthritis Res, 1999,1(1):1.
[17] CaoY, Brombacher F, Tunyoqi-Csapo M, et al. Interleukin-4 regulates proteoglycan-induced arthritis by specifically suppressing the innate immune response[J]. Arthritis Rheum, 2007,3(56):861-870.
[18] Wang J, Zhao Q, Wang G, et al. Circulating levels of Th1 and Th2 chemokines in patients with ankylosing spondylitis[J]. Cytokine, 2016(81):4-10.
[19] Morita Y, Yang J, Gupta R, et al. Dendritic cells genetically engineered to express IL-4 inhibit murine collagen-induced arthritis[J]. J Clin Invest, 2001,107(10):1275-1284.
[20] Sarkar S, Tesmer LA, Hindnavis V, et al. Interleukin-17 as a molecular target in immune-mediated arthritis: immunoregulatory properties of genetically modifed murine dendritic cells that secrete interleukin-4[J]. Arthritis Rheum, 2007,56(1):89-100.
[21] Miossec P, Kolls JK. Targeting IL-17 and T (H)17 cells in chronic inflammation[J]. Nat Rev Drug Discov, 2012,10(11):763-776.
河北省醫(yī)學(xué)科學(xué)研究重點(diǎn)課題計(jì)劃(20130222)。
趙海濤(E-mail: 38558956@qq.com)
10.3969/j.issn.1002-266X.2017.48.016
R593.23
B
1002-266X(2017)48-0051-03
2017-07-12)
- 山東醫(yī)藥的其它文章
- 聲觸診定量技術(shù)與聲觸診成像定量技術(shù)對(duì)甲狀腺結(jié)節(jié)性質(zhì)的判斷價(jià)值比較
- 卡維地洛聯(lián)合螺內(nèi)酯對(duì)慢性心力衰竭患者心肌重塑的影響及機(jī)制
- 口腔鱗狀細(xì)胞癌組織miRNA-222表達(dá)及其意義
- 血清ALP、ICTP、sTf水平及癌組織BMP表達(dá)對(duì)前列腺癌骨轉(zhuǎn)移的預(yù)測(cè)價(jià)值
- 冠心病患者血清hs-CRP、Lp-PLA2水平與冠脈脂質(zhì)斑塊纖維帽厚度的關(guān)系
- 踝關(guān)節(jié)韌帶損傷及修復(fù)對(duì)關(guān)節(jié)面受力面積及應(yīng)力的影響

