海洋貝類腸道弧菌21Z1堿性蛋白酶的分離純化及酶學性質
, ,
(1. 濟南大學 生物科學與技術學院, 山東 濟南 250022; 2. 濟南大學 醫學與生命科學學院, 山東 濟南 250002)
海洋貝類腸道弧菌21Z1堿性蛋白酶的分離純化及酶學性質
胡志恒1,2,李玉梅1,李強1
(1.濟南大學生物科學與技術學院,山東濟南250022; 2.濟南大學醫學與生命科學學院,山東濟南250002)
由威海海域貝類腸道中分離出一株產胞外堿性蛋白酶的細菌,經16S rDNA分析鑒定為弧菌21Z1。該菌發酵液上清經60%飽和度的硫酸銨溶液沉淀、透析、Sephadex-G100分子篩層析等步驟,獲得電泳純的21Z1堿性蛋白酶,聚丙烯酰胺凝膠電泳(SDS-PAGE)顯示其分子量約為31 kDa。酶學性質測定結果顯示:該酶最適反應溫度為40 ℃,在20~40 ℃穩定;最適反應pH為8.5,在pH=8.5~11.0間穩定;Na+、K+、Ca2+、Mn2+對該酶具有激活作用,Fe2+、Fe3+、Zn2+及Cu2+則不同程度地抑制其活性;該酶的耐鹽性檢測結果顯示,在Na+濃度為4 mol/L時, 殘余酶活在62%以上,表明21Z1堿性蛋白酶具有較強的耐鹽性。
弧菌;堿性蛋白酶;純化;酶學性質;耐鹽性
堿性蛋白酶(alkaien protease)是指在堿性環境下具有較高酶活力和穩定性的酶,用于水解蛋白質或多肽[1],其適宜pH在8.0~11.0,廣泛存在于動、植物及微生物中。微生物堿性蛋白酶大多為胞外酶,具有成本低、容易制備、適合大規模生產等優勢,備受研究者關注。堿性蛋白酶廣泛應用于多個領域,如在水產養殖業中可用于飼料中蛋白質分子的分解[2]; 在皮革業中,堿性蛋白酶可用于脫毛,同時可減小物理、化學處理對皮革的損害,減少環境污染[3-4]。此外,堿性蛋白酶在食品、洗滌劑、醫藥等行業也具有非常重要的作用。
近年來,海洋微生物堿性蛋白酶引起了人們的極大關注[5-9],國內外研究者相繼開發出多種新型海洋微生物蛋白酶。由于海洋環境條件特殊,海洋微生物具有多樣性[10],因此研究發現海洋微生物所產堿性蛋白酶也具有一定的獨特性與復雜性[11]。已報道的海洋微生物堿性蛋白酶耐鹽性并不好,限制了該酶在高鹽度加工行業中的應用,如咸味動植物蛋白風味食品加工,因此,開發可用于食品加工的耐鹽蛋白酶非常必要。本文中從威海海域可食性貝類腸道中分離出一株產堿性蛋白酶的菌株21Z1,對該菌株進行了初步鑒定,分離純化了21Z1堿性蛋白酶,并測定了其酶學性質,為進一步開發該酶的商業應用價值提供參考。
1 材料與方法
1.1 菌株與培養基
海洋細菌Vibriosp.21Z1,分離自威海海域,由濟南大學生物科學與技術學院特殊生境微生物實驗室篩選及保藏。
產酶培養基:蔗糖的質量濃度為10 g/L,胰蛋白胨的質量濃度為5 g/L,酵母提取物的質量濃度為1 g/L, 磷酸氫二鉀(K2HPO4)的質量濃度為3 g/L,磷酸二氫鉀(KH2PO4)的質量濃度為1 g/L,硫酸鎂(MgSO4·7H2O)的質量濃度為0.5 g/L,人工海水配制,pH=7.5。
人工海水: 33 g人工海鹽用去離子水定容至1 L,室溫放置3~5 d后使用。
1.2 方法
1.2.1 菌株鑒定
16S rDNA多聚酶鏈式反應(PCR)擴增通用引物為 27F:5′-AGAGTTTGATCCTGGTCAG-3′和1492R:5′-CGGCTACCTTGTTACGAC-3′。PCR反應條件為:94 ℃預變性5 min; 94 ℃變性1 min,54 ℃ 退火30 s,72 ℃延伸30 s,循環35次;最后72 ℃延伸5 min。擴增PCR產物送往上海生物工程有限公司進行測序。利用MEGA4.1軟件鄰接(NJ)法構建系統發育樹。
1.2.2 粗酶液制備
將菌株21Z1按質量分數1%接種量接種于產酶培養基, 轉速180 r/min離心分離, 溫度28 ℃, 培養48 h。 發酵液于4 ℃、 12 000 r/min離心分離20 min, 上清液即為粗酶液。
1.2.3 酶活力測定
根據Folin-酚試劑法[12]測定酶活力。 取1 mL酶液, 40 ℃水浴預熱3 min, 再加入5 mL質量分數2%酪氨酸溶液, 混勻, 放入40 ℃水浴20 min, 加入1 mL濃度為0.4 mol/L的三氯乙酸溶液,轉速10 000 r/min離心分離5 min, 取1 mL上清液,加入5 mL濃度為0.4 mol/L的碳酸鈉溶液,再加入1 mL福林試劑, 40 ℃水浴顯色20 min。對照組先加三氯乙酸溶液,再加入酪氨酸溶液,其他步驟相同。測定波長為660 nm的吸光度值λ660,以每分鐘產生1 μg酪氨酸所需的酶量為一個酶活力單位。
1.2.4 硫酸銨沉淀、透析
將粗酶液分別按質量分數為40%、 50%、 60%、 70%、 80%的飽和硫酸銨溶液的濃度,緩慢加入已稱好的硫酸銨粉末,磁力攪拌至全部溶解,4 ℃過夜。轉速10 000 r/min離心分離20 min, 分別檢測沉淀和上清的酶活,確定蛋白酶沉淀的最適硫酸銨濃度。用最適濃度的硫酸銨進行沉淀,將沉淀溶于濃度為0.05 mol/L磷酸鹽緩沖液(pH=7.5),透析過夜,每4 h更換一次透析液,透析后將酶液冷凍干燥。
1.2.5 分子篩層析以及聚丙烯酰胺凝膠電泳
冷凍干燥后的樣品溶解于濃度為0.2 mol/L的磷酸鹽緩沖液,并利用Sephadex G-100(1.5 cm×100 cm)進行分子篩凝膠層析,樣品總蛋白質量濃度為1 g/L,洗脫液濃度為0.05 mol/L的磷酸鹽緩沖液 (pH=7.5),流速為0.5 mL/min,收集洗脫液并測定酶活力,聚丙烯酰胺凝膠電泳(SDS-PAGE)檢測其純度。
1.3 酶學性質的測定
1.3.1 酪氨酸底物濃度對酶活力的影響
將酪氨酸底物用濃度為0.05 mol/L的磷酸鹽緩沖液(pH=7.5)配制成質量濃度分別為5、 10、 15、 20、 25、 30、 40、 50 g/L的蛋白溶液, 然后根據國際Folin-酚試劑法[12]測定不同底物濃度下的酶活力大小。
1.3.2 溫度對酶活性和穩定性的影響
將酶液分別在20、 30、 40、 50、 60、 70、 80 ℃的反應溫度下進行酶活性測定, 檢測不同溫度對酶活性大小的影響; 將酶液分別在以上溫度下預熱30 min后, 在40 ℃的反應溫度條件下測定酶活性, 檢測溫度穩定性對酶活力的影響。
1.3.3 pH對酶活力和穩定性的影響
將酶液在不同pH的酪蛋白溶液中測定酶活力,不同pH的緩沖液為:濃度為0.2 mol/L磷酸氫二鉀-磷酸二氫鉀緩沖液(pH=6.0~7.5);濃度為0.2 mol/L Tris-鹽酸緩沖液(pH=8.0~8.5);濃度為0.2 mol/L甘氨酸-氫氧化鈉緩沖液(pH=9.0~10.0); 濃度為0.2 mol/L磷酸氫二鈉-氫氧化鈉緩沖液(pH=11.0~13.0)。用以上不同pH的緩沖液稀釋酶液,放置6 h后,在40 ℃條件下進行測定酶活力。
1.3.4 Na+濃度對酶活力的影響
分別配制濃度為0.04、0.4、2、4、6、8、10 mol/L的NaCl溶液,每100 μL酶液中分別加入100 μL上述濃度的Na+溶液,其他測定酶活性的條件不變,分別測定不同Na+濃度對酶活力的影響。
1.3.5 金屬離子以及SDS對酶活力的影響
選取Na+、K+、Cu2+、Ca2+、Mg2+、Mn2+、Zn2+、Fe2+、Fe3+共9種離子化合物,配成濃度為1 mol/L的溶液,與酶液等體積混合,以不加金屬離子的酶液作為空白對照,測定不同金屬離子對酶活力影響;分別配制質量分數為0.5%、1%的SDS溶液,等體積與酶液混合,并以不加SDS的酶液作為空白對照,測定相對酶活力。
2 結果與分析
2.1 菌株21Z1 16S rDNA測序以及系統發育樹的構建
菌株21Z1 經測定后的16S rDNA基因序列已經在GenBank中登錄,其登錄號為KT963026。利用BLAST軟件在NCBI網站上進行序列比對分析,結果表明,菌株21Z1與海洋弧菌Vibriosp.的同源相似性達到97%。利用MEGA4.1軟件鄰接(NJ)法構建系統發育樹,如圖1所示。可以看出,菌株21Z1與弧菌屬為同一分支,在系統進化中親緣關系最相近,因此,初步鑒定海洋菌21Z1為海洋弧菌屬(Vibriosp.)。
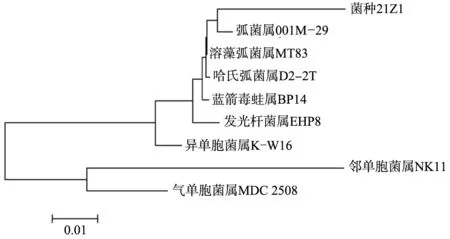
圖1 菌株21Z1及其相關菌株的16S rDNA序列的系統發育樹
2.2 硫酸銨沉淀
硫酸銨沉淀后沉淀與上清液的酶活力如圖2所示。由圖可以看出:粗酶液經過硫酸銨沉淀后, 蛋白酶大多都已經被沉淀下來, 上清液只含有少量的酶; 而且, 通過比較粗酶液在質量分數為40%、 50%、 60%、 70%、 80%的飽和硫酸銨溶液中的酶活力, 發現硫酸銨質量分數為60%的飽和溶液中沉淀蛋白酶效果最好,因此粗酶液選用硫酸銨質量分數為60%的飽和溶液進行沉淀。

圖2 硫酸銨沉淀后沉淀與上清液的酶活力
2.3 分子篩層析和SDS-PAGE電泳檢測
樣品經Sephadex G-100 Fast Flow層析,59號管收集液蛋白酶活性最高。利用SDS-PAGE檢測其純度, 結果如圖3所示, 其中的蛋白酶只有1條帶,其分子量約為31 kDa。
2.4 菌株21Z1蛋白酶的酶學性質
2.4.1 底物濃度對酶活力的影響
通過酪氨酸底物濃度影響實驗得知, 該酶在酪氨酸底物質量濃度為20 g/L時, 酶活力最大, 在20 g/L范圍內, 酶活力隨著底物質量濃度的增加而增加;在超過20 g/L后,酶活力隨著底物質量濃度增加而減少并趨于平衡(圖4),因此,該酶的最適底物質量濃度為20 g/L。

圖3 聚丙烯酰胺凝膠電泳檢測圖

圖4 酪氨酸底物質量濃度對酶活力的影響
2.4.2 溫度對酶活力的影響
蛋白酶受溫度影響及其穩定性曲線如圖5所示。 由圖5(a)可以看出: 該酶在反應溫度為 40 ℃時, 相對酶活力值最大; 在20~50 ℃時有較高的活性, 相對酶活力值在36.5%以上; 在50~80 ℃時內, 活性隨著溫度的升高而減小, 在80 ℃時的相對酶活力值只達到7.63%。 圖5(b)可以看出, 該酶穩定性隨著溫度的升高而下降, 在20~40 ℃時穩定性較好, 其殘余酶活力值可達到60%以上, 而在50 ℃以上, 殘余酶活力值減小到20%以下。 綜上可以看出, 菌株21Z1產生的蛋白酶最適宜反應溫度為40 ℃。
2.4.3 pH對酶活力的影響
蛋白酶受pH影響及其穩定性曲線如圖6所示。由圖6(a)可看出,該酶在不同pH緩沖液體系中,酶活性波動較大,最適宜pH為8.5,且在pH為8.0~10.0時,相對酶活力值較大,在pH為12.0時依然有60%以上的酶活力,說明菌株21Z1產生的蛋白酶為堿性蛋白酶。如圖6(b)所示,該酶在不同pH緩沖液放置6 h后,在pH為8.5~11.0時仍可保持較好的穩定性,殘余酶活力值在80%以上,這些數據進一步證明該酶為堿性蛋白酶[13]。

(a)溫度
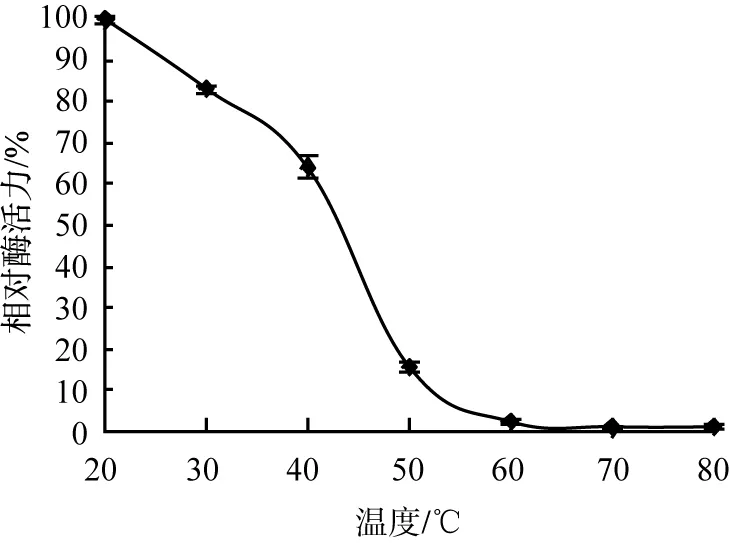
(b)溫度穩定性圖5 蛋白酶受溫度影響及其穩定性曲線
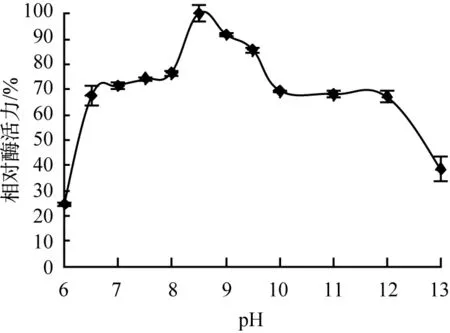
(a)pH
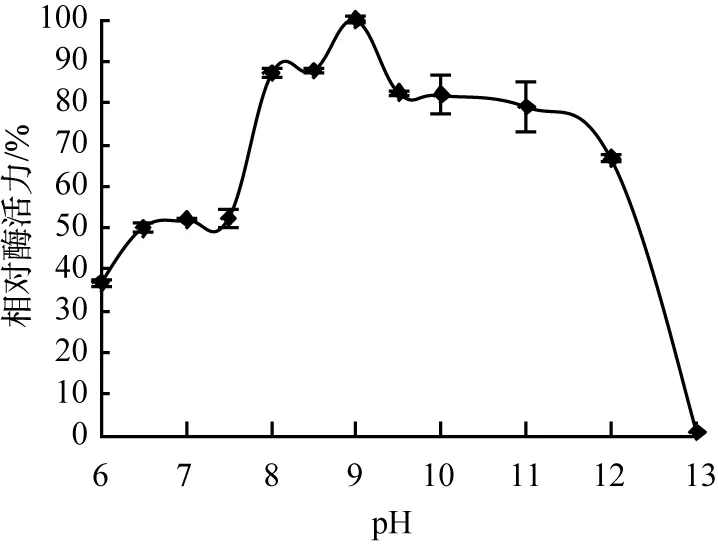
(b)pH穩定性圖6 蛋白酶受pH影響及其穩定性曲線
2.4.4 Na+濃度對酶活力的影響
NaCl濃度對酶活力的影響如圖7所示。由圖可以看出,Na+濃度在0.02~0.2 mol/L時,該酶活性隨Na+濃度的升高而增大;在濃度為0.2~4 mol/L時, 酶活性緩慢降低,在Na+濃度為4 mol/L時, 其殘余相對酶活力值大于60%,這說明21Z1堿性蛋白酶具有較強的耐鹽性,這一性質在相關文獻中未見報道。
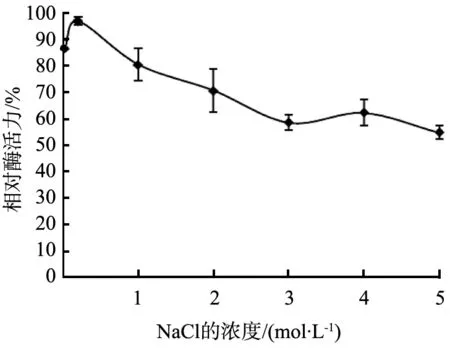
圖7 NaCl濃度對酶活力的影響
2.4.5 金屬離子以及SDS對酶活力的影響
經實驗驗證,Na+、K+、Ca2+、Mn2+等金屬離子對21Z1蛋白酶具有激活作用,其中Mn2+激活作用最強;Fe2+、Fe3+、Zn2+對該酶有不同程度的抑制作用,其中Cu2+強烈抑制酶活性;不同濃度SDS對該酶有一定的抑制作用,在低濃度下該酶還能保持較高的酶活力,而SDS濃度的升高對酶活力的抑制作用也逐漸增強。
3 結論
從威海海域貝類腸道中分離出一株產堿性蛋酶的菌株21Z1, 經其16S rDNA序列分析鑒定為弧菌(Vibriosp.), 且已經在GenBank中登錄, 其登錄號為KT963026。 菌株21Z1分泌的堿性蛋白酶, 經硫酸銨沉淀、 透析、 分子篩層析等步驟, 獲得電泳純, 其分子量在31 kDa左右。 酶學性質檢測顯示: 該酶最適宜反應溫度為40 ℃, 最適宜pH為8.5, 在pH為8.5~11.0時可保持較好的穩定性,相對酶活力值在80%以上, 屬于堿性蛋白酶的范疇; Na+、K+、Ca2+、 Mn2+等金屬離子對該酶起到激活作用, 以Mn2+的激活作用最為顯著; Fe2+、 Fe3+、 Zn2+對該酶有不同程度的抑制作用, 而Cu2+強烈抑制該酶活性, 可能是抑制了該酶的活性中心位點; SDS對該酶也有抑制作用, 且SDS濃度越高, 抑制作用逐漸增強。
21Z1蛋白酶具有很好的耐鹽析性,低濃度的Na+對該酶有一定的激活作用。當Na+濃度小于4 mol/L時, 其殘余酶活力值在60%以上。根據文獻報道,高濃度的鹽離子能夠導致酶鹽析沉淀[14-15],而21Z1蛋白酶是生長于貝類腸道中,因此在高鹽度下仍可穩定存在于溶液中,并保持較高的酶活性,這一強耐鹽性在相關中文獻中未見報道[16-18]。
綜上所述, 21Z1堿性蛋白酶可解決部分高鹽食品加工過程中蛋白酶失活問題。 在制作魚露等水產品的過程中, 發酵的同時需要加入蛋白酶進行水解, 形成含有豐富氨基酸以及多肽的調味品, 且鹽度對產品口味起到關鍵的影響, 降低鹽度會產生異味[19-20]。 大部分商業蛋白酶在高鹽度下容易失活, 因此能夠在高鹽的環境中依然保持較好的酶活力的蛋白酶, 對于食品以及水產品的生產至關重要。 21Z1堿性蛋白酶因來源于可食性海洋貝類, 可以很好地解決以上風味蛋白類食品加工中存在的問題, 同時, 其來源安全環保, 因而具有較好的應用前景。
[1] SHARAN A, DARMWALl N S. Improved production of alkaline protease from a mutant of alkalophilicBacilluspantotheneticususing molasses as a substrate[J]. Bioresource Technology, 2007, 98(4): 881-885.
[2] JSALEEM M, REHMAN A, YASMIN R, et al. Biochemical analysis and investigation on the prospective applications of alkaline protease from aBacilluscereusstrain[J]. Molecular Biology Reports, 2012, 39(6): 6399-6408.
[3] RAJKUMAR R, KOTHILMOZIAN J, RAMASAMY R. Production and characterization of a novel protease fromBacillussp. RRM1 under solid state fermentation[J]. Journal of Microbiology and Biotechnology, 2011, 21(6): 627-636.
[4] DENG A, WU J, ZHANG Y, et al. Purification and characterization of a surfactant-stable high-alkaline protease fromBacillussp. B001[J]. Bioresource Technology, 2010, 101(18): 7111-7117.
[5] 路炳聲, 黃志強, 林白雪, 等. 海洋氧化短桿菌15E產堿性蛋白酶的發酵條件[J]. 福建農林大學學報(自然科學版), 2007, 26(6): 591-595.
[6] 楊冠東, 杜少平, 楊礎華, 等. 產堿性蛋白酶的嗜熱菌株篩選及發酵條件研究[J]. 蘭州大學學報(自然科學版), 2001, 27(6): 80-84.
[7] 孫謐, 王躍軍, 張云波, 等. 一株產低溫堿性蛋白酶嗜冷海洋細菌YS-9412-130的分離和培養條件研究[J]. 海洋水產研究, 2000, 21(4): 1-5.
[8] 梅承芳, 江曉路, 牟海津,等. 堿湖高產堿性蛋白酶菌的選育和產酶條件研究[J]. 中國海洋大學學報,2005,35(4): 613-617.
[9] 馮靜, 荊谷, 謝慧君, 等. 海洋細菌Pseudomnassp.7-11產堿性蛋白酶的研究[J]. 山東大學學報(理學版), 2002, 37(3): 264-267.
[10] 肖峰,張浩,王斌等.一株產中性蛋白酶海洋細菌的篩選與初步鑒定[J].食品與藥品,2011,13(3): 89-93.
[11] SALEEM M, REHMAN A, YASMIN R, et al. Biochemical analysis and investigation on the prospective applications of alkaline protease from aBacilluscereusstrain[J]. Molecular Biology Reports, 2012, 39(4): 6399-6408.
[12] SUNDARARAJAN S, KANNAN C N, CHITTIBABU S. Alkaline protease fromBacilluscereusVITSN04: potential application as a dehairing agent[J]. Journal of Bioscience and Bioengineering, 2011, 111(2): 128-133.
[13] ELIBOL M, MOREIRA A R. Optimizing some factors affecting alkaline protease production by a marine bacteriumTeredinobacterturniraeunder solid substrate fermentation[J]. Process Biochemstry, 2005, 40(5): 1951-1956.
[14] SCHILDKRAUT C, LIFSON S. Dependence of the melting temperature of DNA on salt concentration[J]. Biopolymers, 1965, 3(2): 195-208.
[15] GUEST S, NGO V, HEFFORD M. Circular dichroism reveals sensitivity of glucagon solution structure to fluoroalcohols, pH and ionic strength[J]. Protein Peptide Lett, 2008, 15(8): 811-817.
[16] LEE S K, HWANG J Y, CHOI S H, et al. Purification and characterization ofAspergillusoryzaeLK-101 salt-tolerant acid protease isolated from soybean paste[J]. Food Sci Biotech, 2010, 19(2): 327-334.
[17] FENG Y Z, CAI Y, SU G W, et al. Evaluation of aroma differences between high-salt liquid-state fermentation and low-salt solid-state fermentation soy sauces from China[J]. Food Chemistry, 2014, 145(7): 126-134.
[18] 馮瀅瀅, 段杉, 李遠志. 食鹽濃度對蝦油風味成分形成的影響研究[J]. 現代食品科技, 2013, 2(3): 269-273.
[19] KIM Sang-moo. Accelerating effect of squid viscera on the fermention of Alaska Pollack scraps sauce[J]. Food Science and Nutrition, 2000, 4(2): 103-106.
[20] JOO H S, CHANG C S. Oxidant and SDS-stable alkaline protease from a halo-tolerantBacillusclausiiI-52: enhanced production and simple purification[J]. J Appl Microbiol, 2005, 98(2): 491-497.
PurificationandCharacterizationofAlkakineProteasefromMarineShelfishVibriosp. 21Z1
HUZhiheng1, 2,LIYumei1,LIQiang1
(1.Schoolof Biological Science and Biotechnology, University of Jinan, Jinan 250022, China;2.Shandong Academy of Medical Sciences, University of Jinan, Jinan 250002, China)
A strain was isolated from intestinal of shellfish in Weihai waters which could produce extracellular alkaine protease, and was identified asVibriosp. 21Z1 by 16S rDNA analysis.The purified alkaine enzyme 21Z1 was obtained through ammonium sulfate precipitation, dialysed and Sephadex-G100 column chromatography. Its molecular weight was determined as about 31 kDa by sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE)analysis. The results show that the optimal temperature of this enzyme is 40 ℃, and it is stable at 20~40 ℃. The optimal pH of this enzyme is 8.5, and it is stable at pH ranging from 8.5~11.0. Na+, K+, Ca2+, and Mn2+have effect on its enzyme activity while Fe2+, Fe3+, Zn2+and Cu2+have various degrees of inhibition effect upon this enzyme. The salt tolerance test of enzyme 21Z1 exhibits the residual protease activity remains more than 62% at 4 mol/L concentration of Na+, so alkaine protease 21Z1 has good salt resistance.
Vibriosp.;alkaline protease; purification; enzymatic characteristics; salt resistance
2016-12-27 < class="emphasis_bold">網絡出版時間
時間:2017-12-13 16:49
新疆生產建設兵團塔里木盆地生物資源保護利用重點實驗室開放課題(BRBY1405)
胡志恒(1991—),男,山東濟寧人。碩士研究生,研究方向為微生物與生化藥學。電話:15063375930,E-mail:672312326@qq.com。
李玉梅(1980—),女,吉林省松原人。 副教授,博士,碩士生導師,研究方向為放線菌次生代謝。E-mail:mls_liym@ujn.edu.cn。
http://kns.cnki.net/kcms/detail/37.1378.N.20171212.1637.022.html
1671-3559(2018)01-0077-06
10.13349/j.cnki.jdxbn.2018.01.011
TS254
A
(責任編輯:于海琴)

