光學適體傳感器在醫學檢測中的應用研究
姚繼陽,劉盛平,李 楠,曾祥楷
(重慶理工大學 a.藥學與生物工程學院;b.電氣與電子工程學院, 重慶 400054)
光學適體傳感器在醫學檢測中的應用研究
姚繼陽a,劉盛平a,李 楠a,曾祥楷b
(重慶理工大學 a.藥學與生物工程學院;b.電氣與電子工程學院, 重慶 400054)
綜述了近些年基于固定化核酸適體的光學傳感器的開發與應用進展;闡述了光學適體傳感器在構建過程中涉及到的核酸適體的篩選以及光纖、電極、石墨烯等載體的表面修飾、適體分子的固定等關鍵技術;歸納總結了一些典型光學適體傳感器在生物小分子、大分子以及腫瘤標志物檢測中的應用實例,對該類傳感器未來的應用領域及發展趨勢進行了展望。
光學適體傳感;醫學檢測;核酸適體;腫瘤標志物
光學適體傳感器是將核酸適體篩選技術與光學傳感技術結合起來的一種新型生物傳感器,通過分析核酸適體分子與待檢測物質(如離子、分子、細胞等)接觸后引起的光學性質(如波長、強度、折射率、反射率)的變化來判斷物質的種類及濃度。光學適體傳感技術是20世紀90年代隨著核酸適體技術的出現而逐漸發展起來的,隨后在醫學檢測領域得到了越來越廣泛的應用。Ohk[1]通過前期的細菌培養、適體分子定向篩選、抗體與光纖的修飾制備等步驟,制作了抗體-適體功能化的光學生物傳感器,實現了對食物中李斯特菌的檢測,其最低檢測極限達到了1×103CFUmL-1。Wang等[2]將篩選的適體與咪唑緩沖液和羧基混合起來,制成磁珠-適體,然后將其綁定于帶有氨基的光纖表面,構建了基于適體的漸逝波全光纖生物傳感器,通過檢測漸逝波光學信號強度(電壓形式)來表征赭曲霉素A的濃度。實驗結果顯示:該傳感器檢測線性范圍為6~500 nm,最低檢測限為3nm。Raji[3]采用基于適體的檢測系統來檢測結腸癌細胞表面的標志物癌胚抗原(CEA)。該系統將金納米粒子(GuNPs)通過電沉積的方法固定在氧化銦錫(ITO)基板表面,然后將能特異性結合CEA的適體在含有氨基與羥基溶液的作用下自組裝在金納米膜表面,最后根據檢測電流與細胞的線性關系來判斷HCT116(一種能夠表達CEA的癌細胞)細胞濃度,該系統對結腸癌細胞最低檢測限為6 cell/mL。
光學適體傳感器主要包括敏感元件(核酸適體)與光學信號轉換元件2個部分。核酸適體能特異性結合待檢測物從而引起載體表面光學信號的變化,然后通過光電轉換器件將變化的光學信號轉化為變化的電信號,通過對電信號的解析實現對待測物的分析。圖1為典型的光學適體傳感器的作用過程[4]。與傳統的電化學適體傳感器相比較,光學適體傳感器具有抗干擾能力強、特異性強、親和力高、可重復性強、制備容易等優點。因此,光學適體傳感技術的發展和應用對疾病診斷、分子生物學檢測等具有重要的意義。
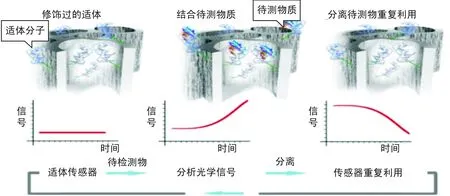
圖1 光學適體傳感器的作用過程
1 光學適體傳感器
光學適體傳感器的構建主要包括核酸適體篩選、載體表面修飾處理、核酸適體分子固定3個部分。
1.1 核酸適體技術
核酸適體是指通過配體指數富集系統進化技術(SELEX)在體外篩選得到的一小段寡核苷酸序列。1990年Szostak等[5]篩選出能特異性結合小分子的RNA片段,并將這些核酸片段命名為核酸適體。
核酸適體主要采用SELEX技術篩選獲得,圖2是核酸適體的具體篩選過程。通過該技術篩選可得到能識別不同生物分子的核酸適體。為了提高適體分子的篩選效率與特異性,近年來發展了多種新型的SELEX技術:
1) 細胞-SELEX技術。該技術采用完整的細胞直接與核酸文庫作用,這樣可以避免抗原的純化過程,并保持細胞表面抗原的天然構象。但是由于細胞表面含有多種靶物質,因此后期需要去除非特異性核酸鏈[6]。
2) 毛細管電泳SELEX技術。這種技術利用了毛細管電泳的微量流體技術,提高了篩選速度。徐華等[7]采用該技術以表達有綠色熒光蛋白的HepG2細胞作為靶細胞,僅經過一輪篩選就得到了較好的富集效果,大大提高了篩選效率(圖2)。但毛細管電泳所需儀器價格昂貴,限制了該技術的推廣普及。
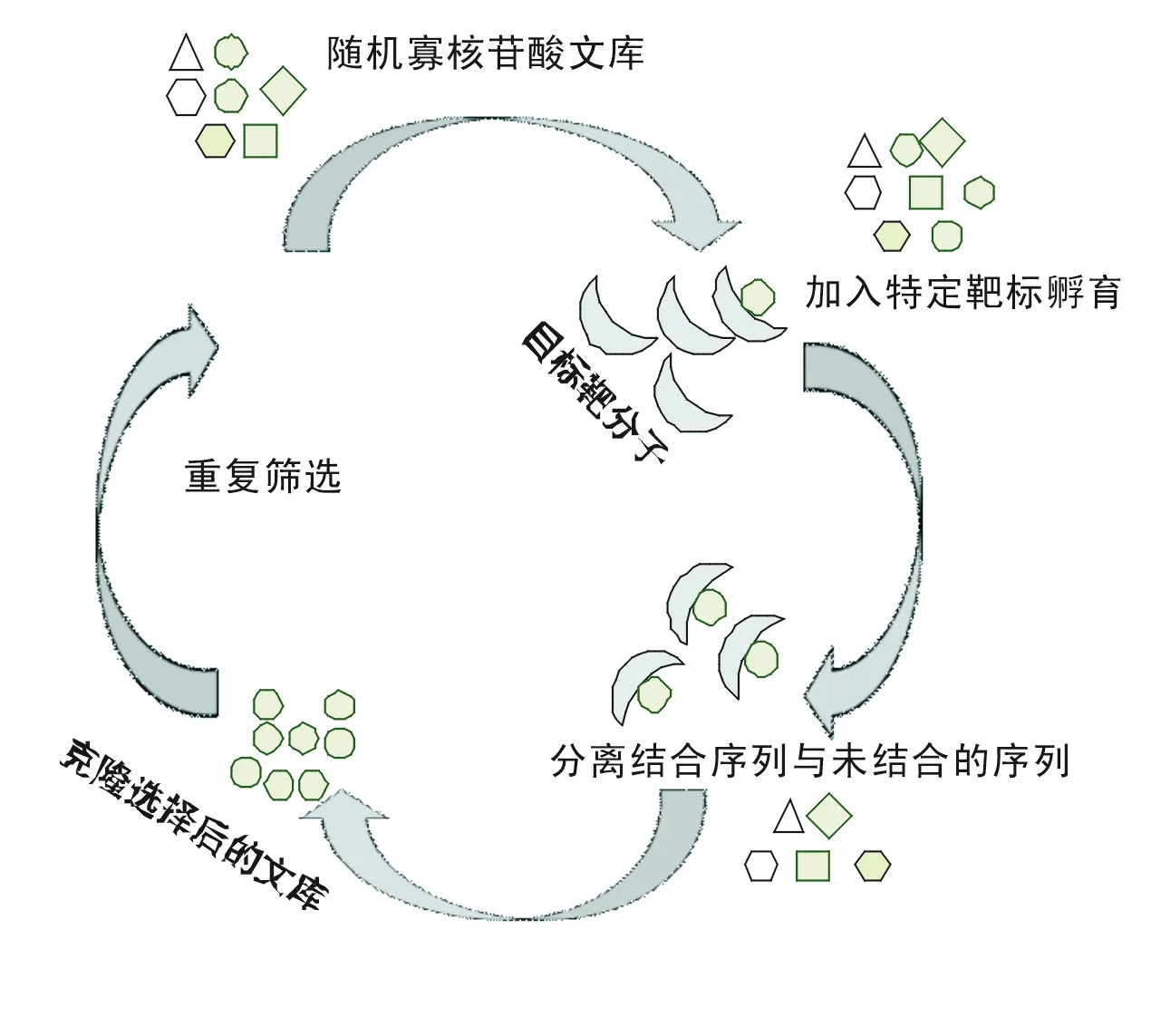
圖2 SELEX篩選過程
表1例舉了幾種常用的核酸適體及其相應的新型篩選技術[8-16]。

表1 核酸適體及其新型SELEX技術
1.2 載體表面修飾處理
為了提高載體表面的活化能,增強對適體分子的固定能力,需要對載體表面進行活化處理。目前主要的處理方法有:
1) 化學反應法,如羧基化、氨基化、巰基化處理等。其原理就是通過固定特定的化學基團來增加載體表面活性。Granville等[17]通過將硫醇和胺官能團引入到光纖表面,使其表面帶有氨基,以便于下一步與金納米粒子的結合。
2) 表面涂覆層處理法。該類方法主要通過電沉積、自組裝等方法將貴金屬納米粒子于光纖表面形成金屬膜。劉等[18]為了提高光纖載體表面Ag膜的抗氧化能力,將Au鍍于Ag膜表面。仿真結果表明:Au膜的引入對共振吸收峰反射率影響不大,不同厚度的Au-Ag復合膜的SPR(表面等離子體共振)共振波長隨Au膜厚度的增大而增大。Delport等[19]采用Au納米粒子來修飾待檢測的DNA,以此來增強金光纖表面信號變化的強度。試驗證明:該方法可以提高DNA檢測的特異性,并有效提高了檢測的靈敏度與實時性。
此外,也可以利用光纖制成光纖光柵傳感器或在光纖表面刻蝕微納米陣列,這兩種方案都可以提高光纖表面的有效接觸面積,從而提高傳感器的靈敏度,并且通過微納米陣列可以實現同時檢測多種物質的功能。Baliyan等[20]采用脈沖準分子激光器通過點對點的方法在光敏硼-鍺共摻雜光纖表面刻蝕長周期光纖光柵,然后將脂肪酶(生物識別層)固定在光柵表面,最終實現對三酰甘油酯的檢測。左則文[21]發明了一種在光纖表面制備一維硅納米結構陣列的方法。該方法采用具有柱狀微結構的多晶硅薄膜進行化學刻蝕。這種硅納米結構在生物醫學傳感器、光電子器件等方面有巨大的應用前景。張等[22]利用單層膠體模板的可轉移性與濺射沉積技術在光纖端面制備了LSPR金納米半球殼陣列。實驗結果表明:該納米結構具有良好的穩定性,在新型的光纖生物傳感器及一些光譜分析領域具有良好的發展應用空間。
1.3 適體分子的固定
如何實現適體分子與載體表面的有效結合是光學適體傳感器制作過程中的關鍵之一。目前主要采用的適體分子固定方法有自組裝膜法、共價鍵合法、生物素-親和素法、互補核苷酸鏈連接法等。其中自組裝膜法是比較常用的方法,它主要就是利用含有特定官能團的基團(如巰基、羧基等)化合物在一些貴金屬及一些氧化物上的化學吸附性或者利用Au-S(金-硫)鍵成鍵驅動力將適體有序吸附在傳感器金載體表面[23]。張等[24]運用自組裝法將核酸適體固定在石墨烯/金納米上制成復合膜,可用于對凝血酶的檢測。表2列出了幾種典型的核酸適體固定方法及其應用于不同生化檢測時的檢測極限。不同的固定方法有各自的優缺點,在研究和應用開發過程中應根據實際情況選擇不同的方法[25-30]。

表2 核酸適體常見固定方案及檢測結果
2 光學適體傳感器的應用
目前通過新型的SELEX技術可以篩選出的適體分子種類越來越多,所有能用抗原抗體反應進行診斷的技術都可以用核酸適體替代。結合核酸適體的識別功能及光學信號特殊的轉導機制,光學適體傳感器在生物醫學檢測領域正發揮著越來越重要的作用。
2.1 離子、生物小分子檢測
光學適體傳感器利用核酸適體的特殊識別能力及光學信號快速傳導機制可以用于無機離子與生物小分子的快速檢測。Leclerc等[31]利用帶正電荷的共軛高分子作為熒光基團設計了一種光學適體傳感器,該傳感器可以實現對堿金屬離子的快速檢測,其原理是通過K+可以影響核酸適體與高分子鏈形成的結構,進而影響熒光信號的猝滅與恢復。Tang等[32]基于漸逝波原理,以帶有氨基的適體分子作為雜交探針,將其固定在經過丙基三乙氧基硅烷(APTES)與戊二醛溶液處理過的光纖表面,通過檢測與待測物接觸后引起的熒光信號的變化來判斷可卡因的濃度,構建了用來檢測人體血清中可卡因濃度的光學生物傳感器。實驗結果表明:該傳感器可以在450 s內完成檢測,最低檢測限為165.2 nmol/L。Tran等[33]基于光學表面等離子體共振(FO-SPR)原理,采用CE-SELEX技術篩選出能特異性識別Ara h1的核酸適體,并通過金納米粒子(AuNPs)來增強信號響應效果,通過檢測SPR的變化成功實現了在緩沖液及食物基質中Ara h1的濃度檢測。
2.2 生物大分子檢測
生物酶、抗原抗體等生物大分子是醫學檢測的重要指標。傳統的蛋白質檢測一般利用抗原-抗體免疫分析方法,這種檢測方法受抗體性質影響較大。核酸適體與傳統的抗體相比具有高度的特異性和親和力,并且易于合成與修飾,因此將光學適體傳感器應用于蛋白質檢測備受關注。Wang等[34]設計了一種基于適體的熒光傳感器用于PKA(蛋白激酶)檢測。其原理是利用ATP(三磷酸腺苷)適體與ATP之間的相互作用,當ATP增加時,由于缺乏有效的酶作用物使得Cu(銅)納米團熒光效果下降,當加入PKA后,PKA將ATP轉化成ADP(二磷酸腺苷),使其無法與ATP適體結合,Cu納米團熒光效果得到恢復。實驗得到PKA的檢測范圍為0.1~1 000 mU/μL,最低檢測限為0.041 mU/μL。該方法還可以用來檢測蛋白質激酶抑制劑H-89。Queiro’s等[35]設計的基于長周期光柵的漸逝波DNA適體生物傳感器可用于特異性識別大腸桿菌外膜蛋白(EcOMPs)。該傳感器通過電弧加工的方法在光纖表面刻蝕長周期光柵,然后用自組裝的方法將DNA適體固定在經過修飾的光柵表面,然后檢測不同EcOMPs 濃度下的波長變化。實驗結果表明:在EcOMPs 濃度為0.1~10 nmol/L范圍內表現出較好的線性關系。
2.3 腫瘤標志物檢測
腫瘤標志物檢測是腫瘤和癌癥早期診斷的重要依據之一,多種腫瘤標志物的聯合檢測對癌癥的早期診斷具有非常重要的意義,它能從分子水平實現對早期癌細胞的檢測,因此設計與開發光學適體傳感器成為癌細胞早期檢測的關鍵之一。Hwang等[36]設計了一種可以檢測與癌癥轉移表達有關的外源性上皮細胞粘附分子(Ep-CAM)/mucin1的光學適體傳感器。該儀器利用量子點適體信標,在Ep-CAM 不存在的情況下,適體信標會保持猝滅狀態,若存在Ep-CAM,由于癌細胞表面的Ep-CAM與Ep-CAM適體序列的結合導致猝滅劑的解離,從而產生可以檢測的熒光信號。Hashemian等[37]研究了基于熒光共振能量轉移的適體傳感器,將其用于對肺癌患者尿液中腺苷含量的分析。該適體傳感器以CdS(蛋白質編碼區)作為供體,以聚吡咯(Ppy)作為受體。當量子點與腺苷適體共價結合時,CdS量子點被Ppy猝滅,當用腺苷代替Ppy時,CdS量子點熒光恢復,熒光強度與腺苷的濃度成比例關系。該儀器的線性檢測范圍為23~146 nmol/L,最低檢測限為9.3 nmol/L。
3 總結與展望
近些年來,光學適體傳感技術發展步伐逐漸加快,該領域關鍵技術水平不斷提高,在分子檢測、臨床診斷、藥物篩選、食品安全、環境檢測、基因測定等諸多領域展示了廣闊的應用前景,特別是在腫瘤標志物的檢測方面取得了令人鼓舞的成功。作為一種新型的檢測工具,對早期癌細胞和腫瘤標志物的檢測有著非常重要的意義。
目前光學適體傳感技術主要研究發展方向是各種生物分子特別是疾病標志物分子的快速、準確及無創檢測技術的實現,以及光學適體傳感系統的集成化、微型化和智能化等研究和應用。鑒于目前一些光學適體傳感器存在穩定性差、靈敏度低等問題,在適體分子的篩選及其在載體的表面修飾技術等方面還需要投入更多的研究。相信隨著光學適體傳感技術自身的發展以及綜合納米技術、無線傳感技術和智能化傳感技術等相關領域新技術的應用,光學適體傳感器在醫學檢測領域會有更大的發展空間,將會為人類提供豐富的、更加便捷、快速和精準的醫學檢測技術和方法。
[1] OHK S H,KOO O K,SEN T,et al.Antibody-aptamer functionalized fiber optic bios-biosensor for specific detection of Listeria monocytogenes from food[J].Journal of Applied Microbiology ISSN,2010,109:808-817.
[2] WANG R Y,XIANG Y,ZHOU X H,et al.A reusable aptamer-based evanescent wave all-fiber biosensor for highly sensitive detection of ochratoxin A[J].Biosensors and Bioelectronics,2015,66:11-18.
[3] RAJI A M,ZADEH E G,AMOABEDINY G.An optically-transparent aptamer-based detection system for colon cancer applications using gold nanoparticles electrodeposited on indium tin oxide[J].Seneors,2016,16(7):1071-1082.
[4] URMANN K,WALTER J G,SCHEPER T,et al.Label-free optical biosensors based on aptamer-functio-nalized porous silicon scaffolds[J].Analytical Chemistry,2015,87:1999-2006.
[5] ELLINGTON A E,SZOSTAK J W.In vitro selections of RNA melcules that bind specific ligands[J].Nature,1990,346:818-822.
[6] 詹少兵,曾毅.SELEX技術及近年研究進展[J].病毒學報,2013,29(5):573-577.
[7] 徐華,李少華,郭磊,等.基于毛細管電泳的細胞SELEX方法的初步建立[J].軍事醫學科學院院刊,2009,33(5):461-464.
[8] YANG J,BOWSER M T.Capillary Electrophoresis-SELEX selection of catalytic DNA aptamers for a Small-Molecule porphyrin target[J].Analytical chemistry,2013,85(3):1525-1530.
[9] XU S M,YUAN H,CHEN S P,et a1.Selection of DNA aptamers against polychlorinated biphenyls as potential biorecognition elements for environmental analysis[J].Anal Biochem,2012,423(2):195-201.
[10] LI H,DING X H,PENG Z H,et al.Aptamer selection for the detection of escherichia coli K88[J]. Canadina J Microbiol,2011,57(6):453-459.
[11] GRAHAM J C,ZARBL H.Use of cell-SELEX to generate DNA aptamers as molecular probes of HPV-associated cervical cancer cells[J].PLoS One,2012,7(4):e36103.
[12] WANG C,HU D,LIU J,et al.Selection and identification of ss-DNA aptamers specific to clinical isolates of Streptococus mutans strains with different cariogenicity[J].J Southern Med University,2013,33(5):738-741.
[13] VATER A,JAROSCH F,BUCHNER K,et al.Short bioactive spiegelmers to migraine-associated calciton in gene-related peptide rapidly identified by a novel approach:tailored-SELEX[J].Nucleic Acids Res,2003,3l(21):el30.
[14] ZHANG X M,SHI Y S,LI X W,et al.Screening and preliminary deteetion of aptamers against C-terminal peptide of prominin-l[J].J Pract Med,2013,29(4):520-522.
[15] 葸玉琴,趙運旺,馬梅蘭,等.瓊脂磁珠消減SELEX技術篩選HIV P24抗原適配體[J].西北師范大學學報,2016,52(5):79-84.
[16] PANIEL N,ISTAMBOULIé,TRIKI A,et al.Selection of DNA aptamers against penicillinGusing Capture-SELEX for the development of an impedimetric sensor[J].Talanta,2016,162:232-240.
[17] GRANVILLE A M,JIN Y,WONG K H.Developing localized surface plasmon resonance biosensor chips andfiber optics via direct surface modification of PMMA opticalwaveguides[J].Colloids & Surfaces A Physicochemical & Engineering Aspects,2016,492:100-109.
[18] 劉超,張坤,孫琪,等.基于Au-Ag復合膜的光學表面等離子體共振傳感器理論仿真研究[J].光學儀器,2012,34(3):91-94.
[19] DELPORT F,KNEZ K,JANSSEN K,et al.Aptamer and DNA hybridization assays on gold fiber opticsensors with nanoparticle signal enhancement[J].OSA Publishing,2014,7:27-31.
[20] BALIYAN A,SITAL S,TIWARI U,et al.Long period fiber grating based sensor for the detection of triacylglycerides[J].Biosensors & Bioelectronics,2016,79:693-700.
[21] 左則文.一種在光學表面制備一維硅納米結構陣列的方法.CN103708413A[P].2014.
[22] 張臘梅,廖艷林,范群芳,等.光學端面可調LSPR金納米半球殼陣列的制備[J].納米技術與精密工程,2012,10(4):302-306.
[23] 袁亞利.凝血酶電化學適體傳感器研究[D].重慶:西南大學,2013.
[24] 張治紅,劉順利,康萌萌,等.核酸適體在自組裝法制備石墨烯/金納米復合薄膜上的固定及凝血酶的檢測[J].功能材料,2014,45(9):70-74.
[25] BAI J G,WEI H,LI B L,,et al.Labeling/Aptamer-Based Biosensor for the Detection of Lysozyme by Increasing Sensitivity with Gold Nanoparticle Amplification[J].Chem Asian,2008,3(11):1935-1941.
[26] 趙秋伶,劉玲玲,楊麗娜.基于核酸適體檢測 ATP 的酶聯分析新方法[J].高等學校化學學報,2014,35(6):1161-1165.
[27] ZHANG Z X,YANG W,WANG J,et al.A sensitive impedimetric thrombin aptasensor based on polyamido-aminedendrimer[J].Taianta.2009,78(4/5):1240-1245.
[28] PENG Y,ZHANG D D,LI Y,et al.Label-free and sensitive faradic impedance aptasensor for the determination of lysozyme based on target-induced aptamer displacement[J].Biosensors and Bioele-ctronics,2009,25(1):94-99.
[29] 劉景榮,潘云苓,趙燕蘋,等.基于核酸適體的比色技術檢測腫瘤標志物血管內皮生長因子[J].南方醫科大學學報,2017,37(2):210-215.
[30] 匡紅,曾琳,劉書蓉,等.納米金信號放大的SPR適配體生物傳感器快速檢測血小板源性生長因子的研究[J].檢驗醫學與臨床,2015(1):16-18.
[31] HO H A,LECLERC M.Optical sensors based on hybrid aptamer/conjugated polymer complexes[J].Journal of the American Chemical Society,2005,11(6):1384-1387.
[32] TANG Y F,LONG F,GU C M,et al.Reusable split-aptamer-based biosensor for rapid detection of cocaine in serum by using an all-fiber vanescent wave optical biosensing platform[J].Analytica Chimica Acta,2016,933:182-188.
[33] TRAN D T,KNEZ K, JANSSEN K P,et al.Selection of aptamers against Ara h 1 protein for FO-SPR biosensing of peanut allergens in food matrices[J]. Biosens Bioelectron,2013,43(1):245-251.
[34] WANG L,WANG M,SHI F,et al.Aptamer based fluorescence biosensor for protein kinase activity detection and inhibitor screening[J].Sensors & Actuators B Chemical,2017,252:209-214.
[36] HWANG J Y,KIM S T,HAN S H,et al.Optical aptamer probes of fluorescent imaging to rapidmonitoring of circulating tumor cell[J].Sensors,2016,16(11):1909-1921.
[37] HASHEMIAN Z,KHAYAMIAN T,SARAJI M,et al.Aptasensor based on fluorescence resonance energy transfer for the analysis of adenosine in urine samples of lung cancer patients[J].Biosensors & Bioelectronics,2016,79:334-340.
ApplicationsofOpticalAptamerSensorinMedicalDetection
YAO Jiyanga, LIU Shengpinga, LI Nana, ZENG Xiangkaib
(a. School of Pharmacy and Biological Engineering; b. School of Electrical and Electronics Engineering, Chongqing University of Technology, Chongqing 40054, China)
This paper reviewed the development and the application of optical biosensor systems based on immobilized aptamers in the past several years, and presented the key technologies for the fabrication of optical aptamer sensors(OTS), involving in the screening of the aptamers, the modification of the surface of the sensor substrates (fiber, electrode, graphene and other materials etc.) and the immobilization of aptamers etc. Also, there enumerated some specific applications of OTS for the detection of biological small molecules, macro-molecules and tumor biomarkers. Finally, the prospects of application areas and development trends of OTS were analyzed.
optical aptamer sensing; medical detection; aptamers; tumor biomarkers
2017-09-20
國家自然科學基金資助項目(61575035)
姚繼陽(1988—),男,碩士研究生,主要從事生物醫學檢測技術及傳感器研究,E-mail:jiyangyao@qq.com。
姚繼陽,劉盛平,李楠,等.光學適體傳感器在醫學檢測中的應用研究[J].重慶理工大學學報(自然科學),2017(12):130-135,139.
formatYAO Jiyang,LIU Shengping,LI Nan,et al.Applications of Optical Aptamer Sensor in Medical Detection[J].Journal of Chongqing University of Technology(Natural Science),2017(12):130-135,139.
10.3969/j.issn.1674-8425(z).2017.12.022
R392
A
1674-8425(2017)12-0130-06
(責任編輯劉 舸)

