漂洗次數對鳊魚魚糜風味物質的影響
,,
(上海海洋大學食品學院,上海 201306)
中國淡水資源豐富,是水產養殖大國。2015年中國淡水養殖總量為3062.27萬t,比上年增長4.31%。其中魚類產量2715.01萬t,比上年增加112.04萬t,增長4.30%[1]。鳊魚產量為79.68萬t,比上年增長了1.76%[1]。長期以來,中國淡水產品由于其結構特點和消費習慣,加工比例僅為15%左右,遠低于海產品加工。而國內外研究學者普遍認為魚糜制品加工是中國淡水魚加工業發展的重要方向之一。
漂洗是魚糜制作過程中一道非常重要的工序,漂洗一方面使肌原纖維蛋白濃度得到相對提高,增強魚糜凝膠形成能力,去除魚肉腥味,改善魚糜品質,另一方面則會降低一些呈味核苷酸類物質和水溶性游離氨基酸的含量,影響魚糜產品的風味。施文正等[3]研究了漂洗過程對草魚魚糜揮發性成分變化的影響,結果表明隨著漂洗次數的增加,揮發性成分的數量及揮發物總量減少,經過一次漂洗和兩次漂洗后魚糜的揮發性成分均有顯著改變,而經過兩次漂洗和三次漂洗后的魚糜揮發性成分無顯著改變。馬海建等[2]研究了漂洗過程中白鰱魚風味物質的變化,結果表明一次漂洗和二次漂洗后魚糜中IMP含量顯著減少(p<0.05),三次漂洗后AMP含量顯著減少(p<0.05);游離氨基酸總量和鮮、甜味氨基酸總量均隨漂洗次數的增加而顯著減少(p<0.05)。
本文以鳊魚為原料,研究了漂洗次數對鳊魚魚糜的主要呈味核苷酸類物質和游離氨基酸含量的影響,通過電子舌分析了其滋味的變化,用氣相色譜聯用儀(GC-MS)分析了其揮發性成分的變化,旨在進一步研究漂洗次數在魚糜生產過程中對其風味物質的影響,為脫除淡水魚腥味和生產優質魚糜制品提供理論依據。
1 材料與方法
1.1材料與儀器
鳊魚 2016年10月購買于上海市古棕路農貿市場,體重(1.0~1.5 kg)/尾;標準品三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)、肌苷酸(IMP)、次黃嘌呤核苷(HxR)、次黃嘌呤(Hx) Sigma公司;甲醇、磷酸二氫鈉和磷酸氫二鈉(色譜純)、氫氧化鉀、氫氧化鈉、氯化鈉、高氯酸、三氯乙酸、磷酸(分析純) 國藥集團。
滾筒采肉機、JL-200自動精濾機、LC-2010CHT高效液相色譜儀 日本島津公司;L-8800氨基酸全自動分析儀 日本Hitachi公司;ASTREE電子舌 法國Alpha M.O.S 公司;7890A-5975C氣相色譜-質譜聯用儀 美國Agilent公司;固相萃取整體捕集劑MonoTrap RCC18(2.9 mm×5 mm,孔徑1 mm) 日本GL sciences公司。
1.2實驗方法
1.2.1 樣品準備 鳊魚經去頭、尾及內臟后洗凈剖片,放入采肉機進行采肉,然后精濾,再用魚肉質量五倍的低溫清水(范圍采用0~10 ℃)漂洗三次,每次漂洗時間均為10 min。分別取精濾后未漂洗、一次漂洗、兩次漂洗和三次漂洗后的鳊魚魚糜樣品進行各項指標的測定。
1.2.2 ATP關聯物的測定
1.2.2.1 樣品處理 參考Yokoyama[4]和馬海建[2]的方法。分別稱取魚肉樣品5 g,加高氯酸勻漿,取上清液,沉淀用5 mL 5%的高氯酸洗滌、10000 r/min離心15 min后取上清液,重復操作兩次,合并上清液,用KOH溶液調節pH至6.5,靜置30 min后取上清液定容至50 mL,搖勻,過0.45 μm膜后待測。
1.2.2.2 高效液相色譜儀(HPLC)條件 GL Sciences公司Inertsil ODS-SP C18(4.6 mm×250 mm,5 μm)液相色譜柱;保護柱柱芯Inertsil ODS-SP(4 mm×10 mm,5 μm);流動相:A為0.05 mol/L磷酸二氫鉀和磷酸氫二鉀(1∶1)溶液,用磷酸調節pH至6.5,B為甲醇溶液,A∶B=95∶5,等度洗脫;流速:1 mL/min;柱溫:28 ℃;進樣量:10 μL;檢驗波長:254 nm。
1.2.3 游離氨基酸的測定
1.2.3.1 樣品處理 參考姚志勇[5]和馬海建[2]方法。分別稱取魚糜樣品2 g,加入三氯乙酸勻漿,靜置沉淀,然后用冷凍離心機離心,取上清液,用NaOH溶液調節pH至2.0,定容,搖勻,過0.22 μm膜后待測。
1.2.3.2 氨基酸自動分析儀條件 分離柱:4.6 mm I.D.×60 mm,分離樹脂為陽離子交換樹脂;分離柱溫度:57 ℃;檢測波長:570 nm(脯氨酸為440 nm);緩沖溶液流速:0.40 mL/min;反應液:茚三酮試劑;反應液流量:0.35 mL/min;反應單元溫度:135 ℃;進樣量20 μL。
1.2.4 電子舌分析
1.2.4.1 樣品處理 準確稱取2 g魚肉,經前處理后取其上清液進行過濾,定容待測。
1.2.4.2 電子舌條件 平衡溶液為去離子水,樣品體積80 mL,分析時間180 s,采集時間120 s,傳感器每秒采集一個數據,選取第120 s的響應值作為原始數據信號進行分析[6]。
1.2.5 揮發性成分的分析
1.2.5.1 固相微萃取(SPME)條件 稱取魚糜樣品3 g,置于20 mL頂空瓶內,將3個固相萃取整體捕集劑MonoTrapRCC18(下文以MTRCC18表示)用固定裝置串連,置于頂空瓶中樣品上方[7]。50 ℃水浴45 min,萃取完全后取出,迅速裝入熱脫附管中,由進樣器轉移至熱脫附器(TDU)中進行熱脫附。
1.2.5.2 TDU條件 不分流模式,起始溫度50 ℃,以180 ℃/min升至250 ℃,保留10 min。
1.2.5.3 CIS條件 起始溫度55 ℃,平衡60 s,以12 ℃/s升至270 ℃,保留2 min。
1.2.5.4 色譜條件 DB-5MS彈性毛細管柱(60 m×0.32 mm×1 μm),不分流模式,程序升溫。
1.2.5.5 質譜條件 傳輸線溫度280 ℃;離子源溫度230 ℃;四極桿溫度150 ℃;電子能量70 eV;質量掃描范圍m/z:35~350。
1.2.5.6 定性及定量分析 將檢測到的揮發性成分通過系統自帶NIST 02和Wiley質譜數據庫進行定性確認,通過面積歸一化法求得各成分在各組揮發性成分中的相對含量。
1.2.5.7 關鍵風味化合物的確定 采用相對氣味活度值(relative odor activity value,ROAV)法[8],定義對樣品總體風味貢獻最大的組分:ROAVstan=100,對其他揮發性物質則按下面的公式計算:
式中:Cri、Ti是各揮發性物質的相對含量和相應的感覺閾值;Crstan、Tstan分別是對樣品總體風味貢獻最大的組分的相對含量和相應的感覺閾值。
1.3數據處理
實驗數據均由Excel、SPSS 17.0等軟件進行分析處理。
2 結果與分析
2.1漂洗次數對鳊魚魚糜呈味核苷酸含量的影響
ATP及其降解產物是影響魚肉風味的重要因素之一,其體內降解途徑如圖1所示[9]:
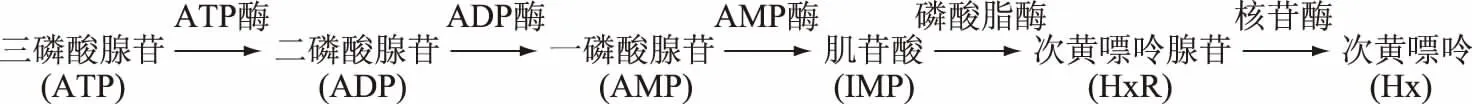
圖1 ATP降解途徑
Fig.1 Degradation pathway of ATP
在ATP降解產物中,對其風味有主要貢獻的是IMP和AMP[2]。AMP有著壓抑苦味的特性,能使食品產生理想的咸味和甜味,是水產食品中良好的風味增強劑[9]。IMP是主要的呈味核苷酸,與谷氨酸共存時對風味有顯著的協同作用[4],作為一種重要的呈味物質,已逐漸廣泛應用于食品調味中。
圖2為漂洗次數對鳊魚魚糜ATP、AMP、IMP含量的影響。由圖2可見,未漂洗魚糜組中IMP含量為1536.84 μg/g,相對于未漂洗組,一次漂洗后為250.87 μg/g,降幅達到83.67%,二次漂洗后為69.82 μg/g,降幅為95.46%,三次漂洗后為59.47 μg/g,降幅為96.13%,均差異顯著(p<0.05)。漂洗過程中ATP和AMP含量的變化較為平緩。未漂洗魚糜組中ATP含量為38.34 μg/g,經一至三次漂洗后分別下降了56%、66.01%和71.65%。未漂洗魚糜組中AMP含量為31.86 μg/g,一次漂洗后為10.39 μg/g,降幅達到67.39%,差異顯著(p<0.05),兩次和三次漂洗后分別為10.20 μg/g和9.89 μg/g,變化不顯著(p>0.05)。三次漂洗后AMP含量相對于未漂洗組減少了68.96%。
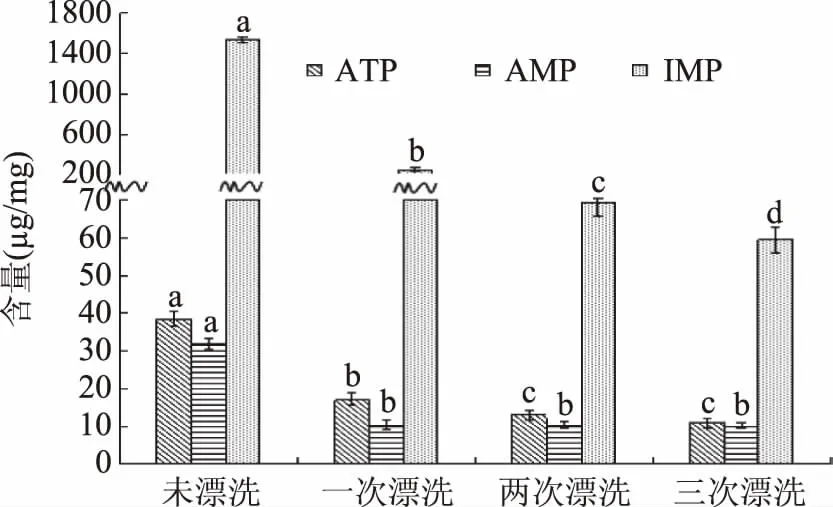
圖2 不同漂洗次數鳊魚魚糜ATP、AMP和IMP含量的變化Fig.2 Changes of ATP、AMP and IMP content in Bream surimi at different rinsing times注:不同字母表示同一組間有顯著性差異(p<0.05)。
因此,漂洗次數對鳊魚魚糜核苷酸物質的含量有明顯影響。一次漂洗對鳊魚魚糜中ATP、AMP和IMP的損失影響最為嚴重,一次漂洗后ATP、AMP和IMP的含量均顯著減少(p<0.05)。兩次和三次漂洗后IMP的含量顯著減少(p<0.05),而ATP和AMP的含量變化不顯著(p>0.05)。馬海建[2]等人對漂洗過程中白鰱魚糜呈味核苷酸變化的研究結果也呈現相同規律。
2.2漂洗次數對鳊魚魚糜游離氨基酸含量的影響
游離氨基酸也是水產品中一類重要的呈味物質,它對滋味的影響不僅和種類及含量相關,還與各種氨基酸本身的閾值以及相互作用有關。經過對各組魚糜樣品中游離氨基酸含量的測定,結果發現在未漂洗魚糜組中甘氨酸(Gly)、丙氨酸(Ala)、賴氨酸(Lys)、組氨酸(His)和脯氨酸(Pro)含量較高。Gly對魚肉的甜味有貢獻,His也是呈甜味的特征氨基酸,使某些水產品呈現“肉香”特征[11],Ala是略帶苦味的甜味氨基酸,與谷氨酸、鳥苷酸、肌苷酸等配伍能產生鮮味相乘作用[12],Lys是人體第一必需氨基酸,能在體內發生轉氨基反應,在營養學上意義重要[13]。
由表1可知,漂洗次數對鳊魚魚糜游離氨基酸總量有明顯的影響。未漂洗魚糜組中游離氨基酸總量為2754.93 μg/g,經一到三次漂洗后,游離氨基酸總量均顯著性減少(p<0.05),分別下降了72.80%、81.45%和86.29%,一次漂洗后損失最為嚴重。
鮮、甜味氨基酸主要包括Asp、Thr、Ser、Glu、Gly、Ala、Pro七種,其中Asp和Glu是呈鮮味的特征性氨基酸,其他五種氨基酸和甜味有關[13]。未漂洗魚糜組中的鮮、甜味氨基酸總量為945.53 μg/g,相比未漂洗組,一次、兩次和三次漂洗后的魚糜鮮、甜味氨基酸總量降幅分別為73.39%、87.57和93.66%,可知一次漂洗后鮮、甜味氨基酸的損失最大,隨著漂洗次數增加,鮮、甜味氨基酸損失增加。其中Gly、Ala和Pro的含量變化比較明顯。相對于未漂洗魚糜組,三次漂洗后Gly、Ala降幅分別為95.72%、92.91%,兩次和三次漂洗后的魚糜組中未檢測出Pro。
呈苦味特征的氨基酸主要包括Val、Met、Ile、Leu、Tyr、Phe、Lys、His和Arg。漂洗次數對苦味氨基酸總量損失有顯著影響(p<0.05)。未漂洗魚糜組中苦味氨基酸總量為1675.81 μg/g,一到三次漂洗后,苦味氨基酸總量降幅分別為71.85%、77.99%和81.34%。其中Lys和His的含量變化最為明顯。相對于未漂洗魚糜組,三次漂洗后Lys和His降幅分別為84.18%和92.22%。
值得關注的是,每一次漂洗,鮮、甜味氨基酸的損失量均大于苦味氨基酸。
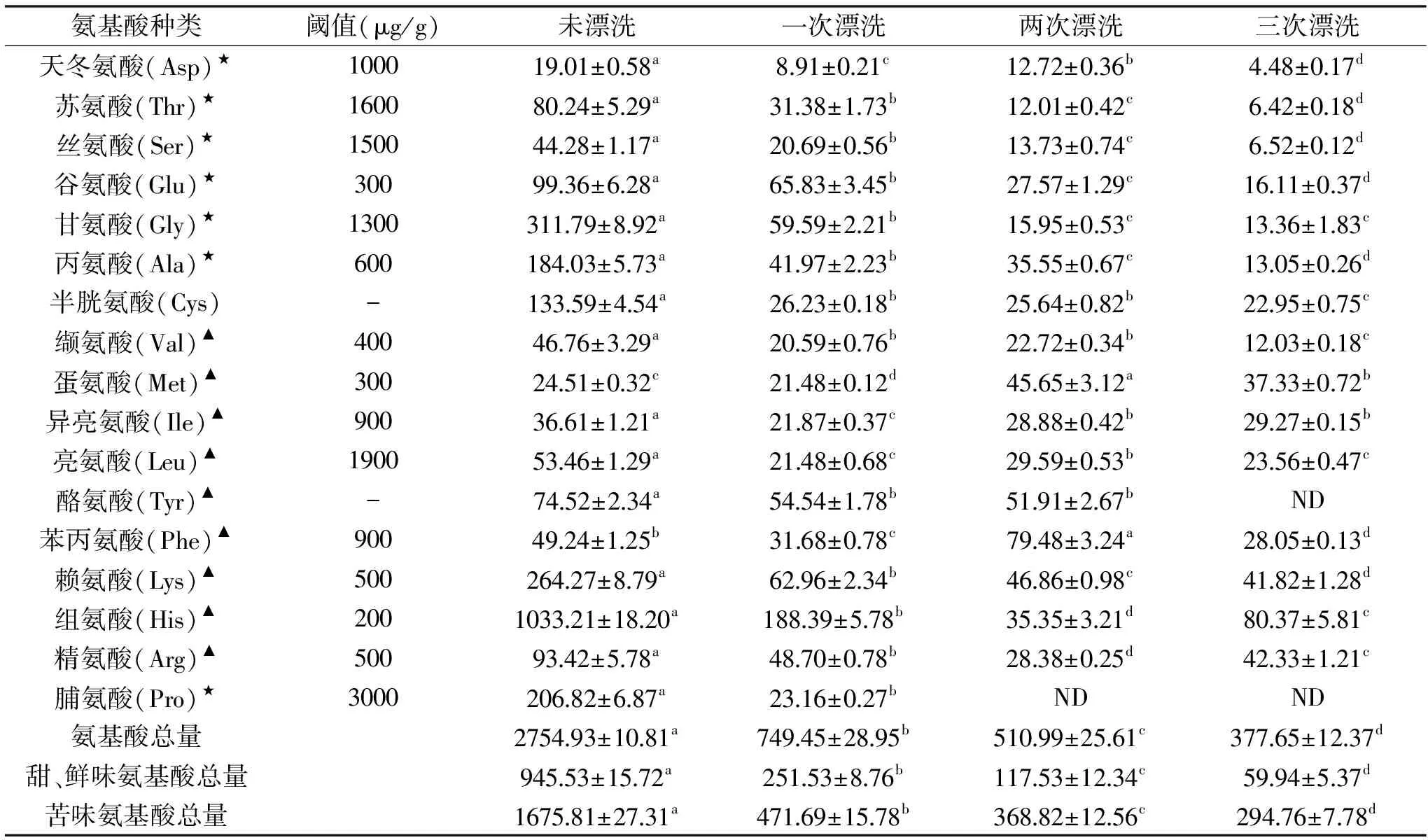
表1 不同漂洗次數鳊魚魚糜游離氨基酸含量的變化(μg/g)Table 1 Changes of free amino acid content in Bream surimi at different rinsing times(μg/g)
注:表中數據均已換算到相同水分含量(80%);★為鮮、甜味氨基酸,▲表示苦味氨基酸。不同字母表示同一行間有顯著性差異(p<0.05),“-”表示未查到,ND 表示未測出。
2.3 不同漂洗次數處理的鳊魚魚糜電子舌數據主成分分析
電子舌是模擬生物味覺模式建立起來的基于化學傳感器和模式識別的液體分析儀器。作為一種快速檢測食品滋味品質的新技術,通過檢測樣品中水溶性物質從而達到快速區別食品滋味差別,具有高靈敏度、可靠性、重復性的特點。
如圖3所示,PC1和PC2的貢獻率分別為58.1%和33.0%,累積貢獻率為91.1%,說明該圖基本能夠反映樣本整體差異性信息在主成分平面上的完整程度。從圖3可以看出,每一組樣品的三個點離散度較小且相互之間無干擾,說明四組樣品的滋味可以被電子舌很好區分。其中未漂洗組和其他三組樣品間間隔較遠,而兩次和三次漂洗組間隔較小,說明漂洗次數對鳊魚魚糜的整體滋味輪廓有影響,一次漂洗對滋味輪廓影響最大,兩次和三次漂洗的滋味輪廓接近。這與呈味核苷酸以及游離氨基酸的分析結果一致。

圖3 各組樣品的電子舌數據主成分分析(PCA)圖Fig.3 PCA analysis of E-nose for each samples
2.4漂洗次數對鳊魚魚糜揮發性物質的影響
采用3個串聯的新型固相萃取整體捕集劑作為吸附介質,結合兩級熱脫附技術,利用GC-MS對各組魚糜樣品的揮發性成分進行測定。
經過NIST圖庫檢索和文獻參考確認,未漂洗、一次、兩次和三次漂洗后的魚糜樣品中分別檢測出38、25、22和21種揮發性成分,主要為醛酮類、醇類、烷烴烯烴類和芳香族類化合物。未漂洗組中,檢測到的醛酮類化合物16種,相對含量占49.36%,醇類物質8種,相對含量占30.01%,其他三組和未漂洗組一樣,醛酮類和醇類化合物在種類和數量上均占有最大優勢,共同作用形成魚肉的氣味。一次漂洗后,醛酮類的2-甲基丁醛、2-庚酮、2-癸酮、苯丙酮和十一醛未在樣品中檢出,醇類中的3-甲基戊醇和1.3-甲基-4-戊烯醇也未被檢出;兩次漂洗后,3-甲基戊醛、2-己酮、2,3-辛二酮和2-壬醇未被檢出,三次漂洗后與兩次漂洗后的揮發性物質種類差別很小。這些未被檢出的揮發性化合物可能是導致鳊魚肉魚腥味的主要原因。隨著漂洗次數的增加,甲苯、2-甲基萘、聯苯、2-甲基聯苯和苯乙烯等含苯化合物逐漸被洗脫而未被檢出。含苯化合物的存在,說明魚體被環境在一定程度上被污染,漂洗可以去除一些環境污染物,增加魚糜的衛生安全性。
1~3次漂洗后,醛酮類物質的總相對含量分別增加到61.15%、61.29%和73.79%,而對于醇類物質總相對含量,一次漂洗對其影響小,兩次和三次漂洗后分別減少為21.82%和14.77%。對魚肉氣味形成貢獻較大的醛酮類和醇類物質的總相對含量在未漂洗、一次、兩次和三次漂洗后分別為79.37%、92.11%、83.79%和88.56%。隨著漂洗次數的增加,烷烴類化合物總相對含量減少,由于烷烴類化合物的閾值較高,對鳊魚魚糜的風味形成影響較小,而芳香族化合物總相對含量略有增加。由此可見漂洗次數對鳊魚魚糜揮發性物質含量有明顯的影響,一次漂洗對鳊魚魚糜揮發性成分相對含量影響最大,其次是兩次漂洗,三次漂洗影響最小。這和施文正[3]對草魚魚糜以及馬海建[2]對白鰱魚魚糜在漂洗過程中的揮發性成分變化研究結果基本一致。
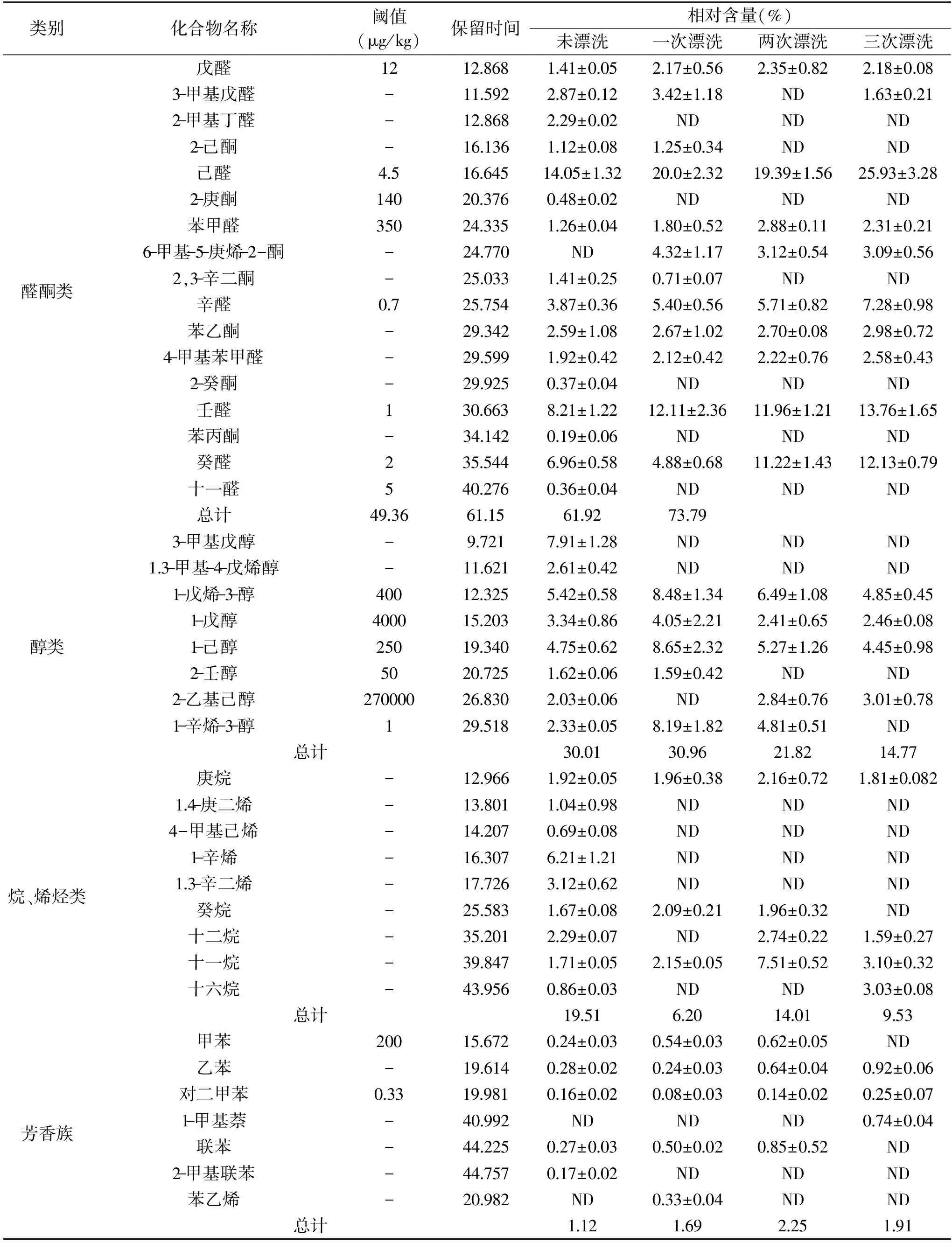
表2 不同漂洗次數鳊魚魚糜揮發性成分含量的變化Table 2 Changes of content of volatile compounds in Bream surimi at different rinsing times
注:-表示閾值未查到,ND 表示未測出。
各種揮發性物質對樣品總體風味的貢獻,不僅與其在樣品中的相對含量有關,還與其感覺閾值有關。為進一步確定不同漂洗次數下各組樣品的關鍵風味化合物,結合表2中各種揮發性物質的相對含量和感覺閾值,根據公式(1)計算各揮發性物質的相對氣味活度值(ROVA值)。其中壬醛在各組樣品中的相對含量均較高,且其閾值較低,為1 μg/kg,所以壬醛對各自所在樣品的總體氣味貢獻最大,確定壬醛在各組樣品的ROAVstan=100,其他各揮發性物質的ROVA值見表3。顯然,所有組分0≤ROAV≤100,而且ROAV 值越大的組分對樣品總體風味的貢獻也越大。一般認為ROAV≥1 的物質為所分析樣品的關鍵風味化合物,0.1≤ROAV<1的物質對樣品的總體風味具有重要的影響[15]。

表3 不同漂洗次數下鳊魚魚糜揮發性成分的相對氣味活度值Table 3 Relative odor activity values of bream surimi at different rinsing times
注:ND表示無法計算出。
由表3可以看出,醛酮類化合物中,戊醛、己醛、辛醛、壬醛和癸醛均為四組樣品中的關鍵風味化合物。不同的醛類具有不同的氣味特征,C5-C9醛具有清香、油蠟和油膩味;C10-C12醛具有桔皮和檸檬味[16]。其中己醛普遍存在于淡水魚及海水魚中,具有清香或青草氣味,常常會與八碳或九碳揮發性物質混合在一起共同對其香味產生貢獻[17]。壬醛有青草味和脂香[18]。隨著漂洗次數的增加,戊醛、己醛、辛醛和癸醛對魚糜氣味的貢獻在增加。這可能是因為隨著漂洗次數的增加,那些易溶于水的揮發性物質被洗去,保留下來的都是一些不易溶于水且含量較高的物質,這些揮發性物質的相對含量在增加,對氣味的貢獻也在增大。醇類化合物中,1-辛烯-3-醇是未漂洗、一次和兩次漂洗組的關鍵風味化合物,它是一種亞油酸的氫過氧化物的降解物,具有類似蘑菇的氣味[19]。1-辛烯-3-醇在三次漂洗組中未檢測到,可能是由于隨著漂洗次數的增加,其相對含量略有增加,但其絕對含量卻在降低,以至于低于儀器的檢測限而未被檢出。1-己醇在各組的相對含量較高,在新鮮淡水魚肉中呈現青草味[20],但由于其氣味閾值太高,其在各組中的ROVA值均小于1,所以它并不是鳊魚魚糜的關鍵風味化合物。芳香族化合物中對二甲苯均為四組樣品的關鍵風味化合物,它會使魚肉產生令人不愉快的氣味[3],說明魚體在一定程度上被污染。在以上檢測出的關鍵風味化合物,隨著漂洗次數的增加,它們對魚糜氣味的貢獻也在一定程度的增加,說明漂洗次數對魚糜氣味有顯著影響。
3 結論
3.1通過對各組魚糜呈味核苷酸和游離氨基酸的測定,結果表明漂洗次數對鳊魚魚糜的滋味有明顯的影響。一次漂洗對魚糜樣品中ATP、AMP和IMP的損失影響最為嚴重。兩次和三次漂洗對IMP含量有顯著影響(p<0.05),對ATP和AMP含量的影響不顯著(p>0.05);一次漂洗使游離氨基酸含量降低最顯著(p<0.05),兩次和三次漂洗使游離氨基酸含量進一步降低,但降低幅度減緩。
3.2通過GC-MS分析,結果表明漂洗次數對鳊魚魚糜氣味有所影響。鳊魚魚糜的揮發性成分以醛酮類和醇類為主,其中關鍵風味化合物有6種,分別為戊醛、己醛、辛醛、壬醛、癸醛和1-辛烯-3-醇。一次漂洗對揮發性成分的影響最大,兩次漂洗次之,三次漂洗影響最小。隨著漂洗次數的增加,這6種關鍵風味化合物對魚糜風味的貢獻在增加。
3.3綜合以上兩點,隨著漂洗次數的增加,鳊魚魚糜中的呈味核苷酸和游離氨基酸會逐漸流失,導致風味下降,但漂洗可以一定程度上去除魚糜中的魚腥味,所以鳊魚魚糜的生產過程中采用兩次漂洗效果最佳。
[1]農業部漁業局.中國漁業統計年鑒 2016[M].北京:中國農業出版社,2016.
[2]馬海建,施文正,付強,等. 漂洗過程中白鰱魚糜風味物質變化的分析[J].現代食品科技,2015(7):354-360.
[3]施文正,汪之和,朱耀周,等. 漂洗過程中草魚魚糜揮發性成分變化的研究[J]. 食品工業科技,2009,12:376-379,384.
[4]Yokoyama Y,Sakaguchi M,Kawai F,et al. Change in concentration of ATP-related compounds in various tissues of oyster during ice storage[J]. Nippon Suisan Gakkaishi,1992,58(11):2125-2136.
[5]姚志勇,萬金慶,龐文燕,等. 真空冷誘導對冰溫貯藏羅非魚片鮮度和滋味的影響[J].現代食品科技,2014,30(2):198-203.
[6]劉源,仇春泱,王錫昌,等. 養殖暗紋東方鲀肌肉中呈味肽的分離鑒定[J].現代食品科技,2014,30(8):38-42.
[7]顧賽麒,吳浩,張晶晶,等. 固相萃取整體捕集劑-氣相色譜-質譜聯用技術分析中華絨螯蟹性腺中揮發性成分[J].現代食品科技,2013,29(12):3019-3025.
[8]劉登勇,周光宏,徐幸蓮. 確定食品關鍵風味化合物的一種新方法:“ROAV”法[J].食品科學,2008,29(7):370-374.
[9]湯辰婧,王錫昌,劉源,等. 水產品滋味成分研究及開發利用進展[J].水產科技情報,2013,40(3):164-168.
[10]鄧捷春,王錫昌,劉源. 魚肉風味研究進展[J]. 食品工業科技,2010(6):375-378.
[11]須山二千三,鴻巢章二. 水產食品學[M]. 東京:恒星社厚
生閣,1987.
[12]楊晉,陶寧萍,王錫昌. 文蛤的營養成分及其對風味的影響[J]. 中國食物與營養,2007(5):43-45.
[13]葉鴿,郝淑賢,李來好,等. 不同養殖模式羅非魚品質的比較[J]. 食品科學,2014,35(2):196-200.
[14]田曉靜. 基于電子鼻和電子舌的羊肉品質檢測[D].杭州:浙江大學,2014:9-15.
[15]劉登勇,周光宏,徐幸蓮. 確定食品關鍵風味化合物的一種新方法:“ROAV”法[J].食品科學,2008,29(7):370-374.
[16]Forss D A. Odor and flavor compounds from lipid[J]. Progress in the Chemistry of Fats & Other Lipids. 1972.13(4):181-258.
[17]Guillén M D,Errecalde M C,Salmerón J,et al. Headspace volatile components of smoked swordfish(Xiphias gladius)and cod(Gadus morhua)detected by means of solid phase microextraction and gas chromatography-mass spectrometry[J]. Food Chemistry,2006,94(1):151-156.
[18]Morales M T,Rios J J,Aparicio R. Changes in the volatile composition of virgin olive oil during oxidation:flavors and off-flavors[J]. Journal of Agricultural and Food Chemistry,1997,45(7):2666-2673.
[19]David B,Josephson D. Identification of comounds characterizing the aroma of fresh whitefish[J]. J Agric Food Chem,1983,31:326-330.
[20]Ogata M. Indenfication of substance in petroleum causing objectionable odors in fish[J].J Wat Res,1973(7):1493-1504.

