銅綠微囊藻與小球藻對低溫和黑暗的響應與恢復
岳 紅 李巧玉 喻 燚 張紅波 董聰聰 施軍瓊 吳忠興
(西南大學三峽庫區生態環境教育部重點實驗室, 重慶市三峽庫區植物生態與資源重點實驗室, 重慶 400715)
近年來, 水體富營養化導致的藍藻水華已在世界各地廣泛報道[1], 藍藻水華的發生, 不僅引起水質的惡化, 影響生態環境, 而且部分種類能夠釋放毒素影響了人類身體健康[2,3]。在已報道的藍藻水華中, 微囊藻水華最為普遍。研究表明池塘中微囊藻水華發生率為30%—50%, 主要是銅綠微囊藻與水華微囊藻[4], 而大中型水庫大部分水體優勢種主要是微囊藻, 占水華總數的75%以上[5,6]。因而, 研究微囊藻水華生態過程具有重要的現實意義。
先前的研究表明, 微囊藻通常在春末迅速生長,夏季進入穩定期并占據主體地位, 秋季、冬季進入水體底層或沉積物越冬, 到第二年的春天開始新一輪的循環[7]。許多藍藻形成休眠孢子或厚壁孢子來渡過冬季的逆境條件, 而微囊藻仍以營養細胞形式來應對冬季低溫黑暗條件[8]。休眠孢子具有休眠和極強的抗逆性特征, 因此, 它具有很好的抵御冬季脅迫環境的能力, 然而, 微囊藻營養細胞如何適應冬季逆境條件, 其作用機理尚不明確, 這也是揭示微囊藻水華形成過程的重要生態問題。因此, 本實驗中以銅綠微囊藻(Microcystis aeruginosa PCC 7806)為研究對象, 將其與小球藻(Chlorella sp.FACHB-31)進行對比實驗, 探究其在低溫黑暗條件下它們的響應機制, 為揭示藍藻水華形成提供重要的依據。
1 材料與方法
1.1 藻種及培養條件
實驗所采用的銅綠微囊藻和小球藻均由中國科學院水生生物研究所淡水藻種庫提供。采用MA培養基在(25±1)℃, 光照強度為25 μE/(m2·s) (光暗比12h鯰12h)交替培養[9]。當2種藻生長到對數期后, 對其進行離心, 并用新鮮的MA培養基進行清洗3次, 清洗后的藻樣接種到250 mL錐形瓶中(細胞密度為1.0×106cells/mL)。用黑布和錫箔紙將錐形瓶包扎且不透光后, 放置4℃的冷柜中, 保持低溫黑暗培養。平均每5天取樣1次進行測定, 持續30d。
1.2 恢復培養
在適應實驗進行30d后, 將培養條件恢復到正常情況[溫度為(25±1)℃, 光照強度為25 μE/(m2·s)],再平均2d取樣一次進行測定, 實驗持續10d。
1.3 生物量及色素含量測定
細胞數量采用浮游植物計數法進行測定[10]。樣品中葉綠素a與胡蘿卜素含量測定采用90%的丙酮過夜提取, 離心, 取上清液于663、645和450 nm處測定吸收值[11]。葉綠素含量采用Chl.a(mg/L)=12.72×A663[10]; 而類胡蘿卜素含量Carotenoids(mg/L)=4.1×A450-0.0435×Chl.a[12]。
1.4 最大可變熒光(Fv/Fm)測定
利用Phyto-PAM(Phyto-PAM, ED, Walz, Effeltrich, Germany)測定, 具體測定方法參見吳曉東等[13]研究。
1.5 丙二醛(MDA)含量及過氧化氫酶活性(CAT)測定
脂質過氧化產物丙二醛(MDA)含量采用硫代巴比妥酸比色法進行測定[14], 過氧化氫酶(CAT)采用比色法在240 nm處進行測定[15]。
1.6 細胞存活率
所有處理30d的樣品通過FDA (Fluorescein diacetate)染料染色。FDA熒光用Epics Altra流式細胞儀(Coulter, Beckman, USA)進行檢測。FCM輸出功率為15 mW, 激發光為488 nm。FDA染色的細胞所發出的熒光在505—545 nm被檢測, 根據熒光點的位置和密度判斷細胞存活率[16]。
1.7 統計方法
所有實驗數據均設置3個重復。Control(對照)表示正常處理30d的各項指標, 而低溫+黑暗表示在低溫黑暗處理條件下的各項指標, 數據表達形式均為Means±SD, 并采用ANOVA進行顯著性分析, 顯著性水平設置為P<0.05。統計分析應用SPSS22.0軟件, 圖形采用Origin8.6軟件繪制。
2 結果
2.1 葉綠素濃度
低溫黑暗培養30d后, 銅綠微囊藻PCC 7806的葉綠素a濃度下降了55.88%, 小球藻FACHB-31的葉綠素a濃度下降52.07%。在低溫黑暗條件下, 類胡蘿卜素與葉綠素的比值(Car/Chl.a)均高于對照組,微囊藻PCC 7806增加了0.61倍, 小球藻FACHB-31增加了3.23倍(圖1)。然而, 在正常條件培養下, 微囊藻和小球藻的葉綠素1.48倍和3.58倍。
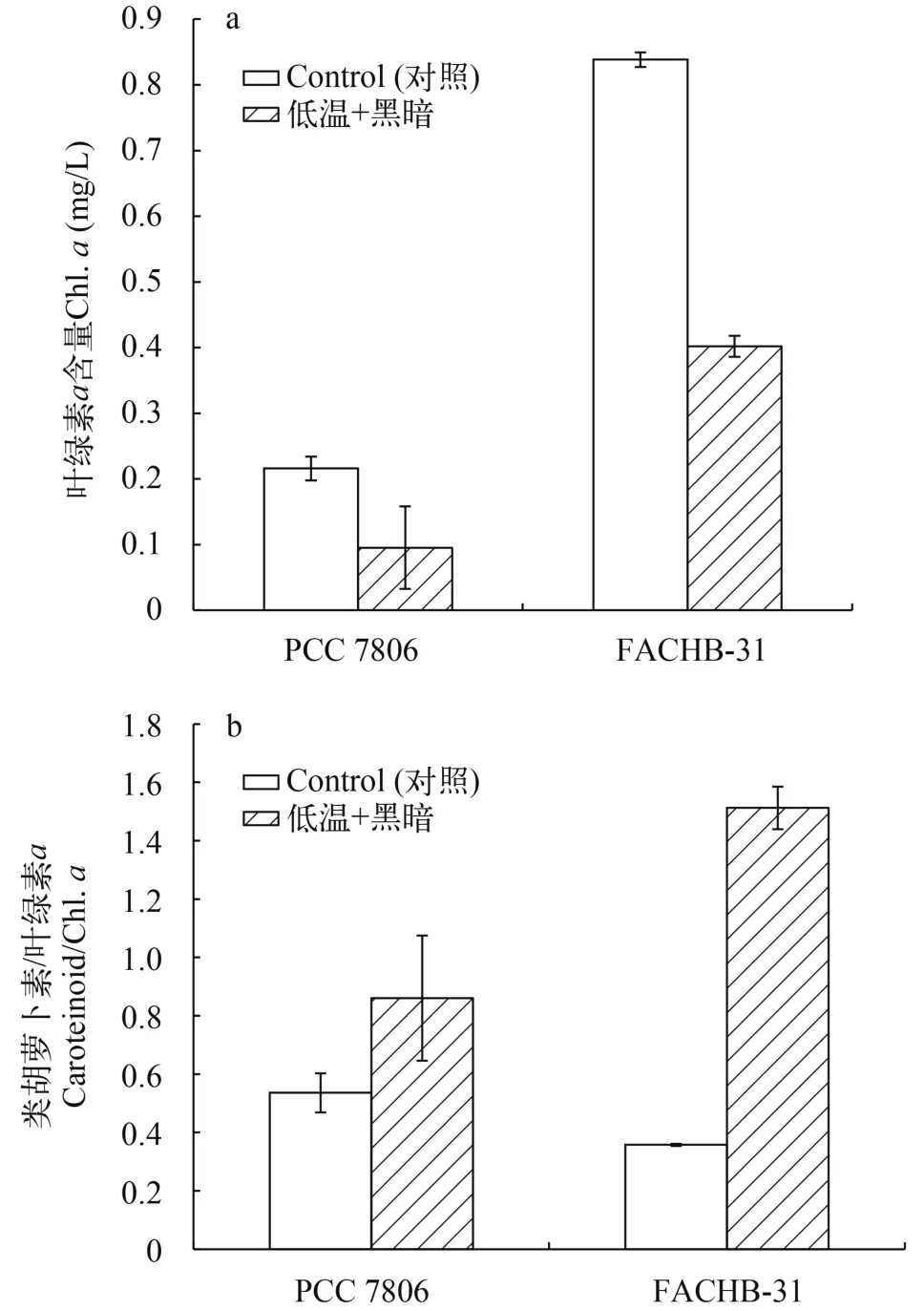
圖1 銅綠微囊藻與小球藻的葉綠素a及類胡蘿卜素相對含量Fig. 1 Chlorophyll a contents and the relative contents of carotenoids in Microcystis aeruginosa PCC 7806 and Chlorella sp.FACHB-31 after 30 days under darkness and low temperature incubation
2.2 最大光化學效率(Fv/Fm)
低溫黑暗培養30d后, 2種藻的最大光化學效率(Fv/Fm)均呈現下降的趨勢, 微囊藻PCC 7806的對照處理組差異不顯著, 小球藻FACHB-31對照組在15d增加到0.67后, 開始緩慢下降, 但整體均高于低溫黑暗處理組(圖2)。
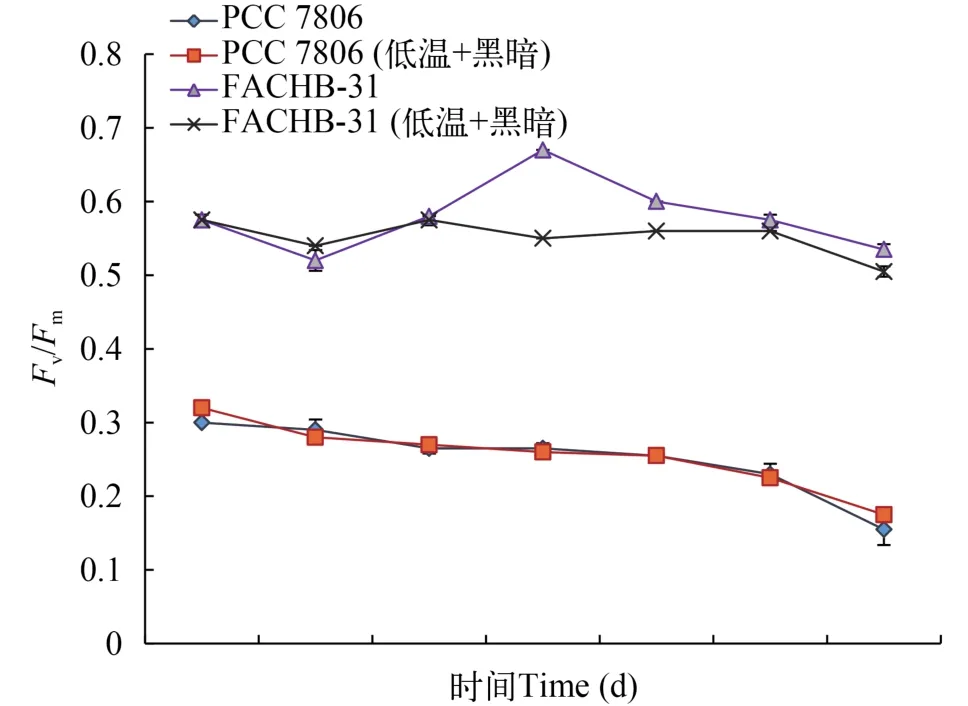
圖2 低溫低光對微囊藻PCC 7806和小球藻FACHB-31 Fv/Fm的影響Fig. 2 Effects of darkness and low-temperature on Fv/Fm of Microcystis aeruginosa PCC 7806 and Chlorella sp. FACHB-31 during 30 days incubation
2.3 存活率比較
低溫和黑暗抑制了兩種藻的生長(圖3), 在正常培養和低溫黑暗條件下培養30d后, 銅綠微囊藻存活率分別為(81.6±0.04)%和(54.6±2.9)%, 降幅為33.09%; 而小球藻分別為(74.5±0.04)%和(31.3±1.2)%, 降幅為57.99%。與對照相比, 2種藻存活率均顯著降低(P<0.05, ANOVA)。
2.4 丙二醛含量(MDA)及過氧化氫酶(CAT)活性
在30d正常和低溫黑暗條件下培養, 銅綠微囊藻的丙二醛(MDA)含量(圖4a)分別為4.7和37.5 μmol/mg protein, 與正常對照組相比, 在低溫黑暗條件培養下MDA具有顯著變化(P<0.05, ANOVA); 而小球藻MDA含量分別為0.5和2.5 μmol/mg protein, 變化顯著(P<0.05, ANOVA)。PCC 7806及FACHB-31的過氧化氫酶(CAT)在低溫黑暗培養過程分別上升44.8%和5.5%(圖4b)。銅綠微囊藻在培養前后差異顯著(P<0.05, ANOVA), 且2種藻之間具有顯著性差異(P<0.05, ANOVA)。然而, 在正常對照培養條件下, 微囊藻和小球藻的MDA含量和CAT活性均未顯著性變化。
2.5 恢復實驗
在30d的低溫黑暗培養后, 將2種藻放置正常溫度及正常光照條件繼續培養10d, 研究2種藻的生長恢復能力。結果表明2種藻均能迅速恢復生長(圖5),銅綠微囊藻PCC 7806細胞數由原來的0.1195(×107/mL)增加到0.55 (×107cell/mL), 上升6.5倍, 變化顯著(P<0.05, ANOVA)。小球藻FACHB-31細胞數則上升8.6倍, 達到0.6365 (×107/mL), 顯著增加(P<0.05, ANOVA), 而2種藻之間差異不顯著(P>0.05, ANOVA)。
3 討論
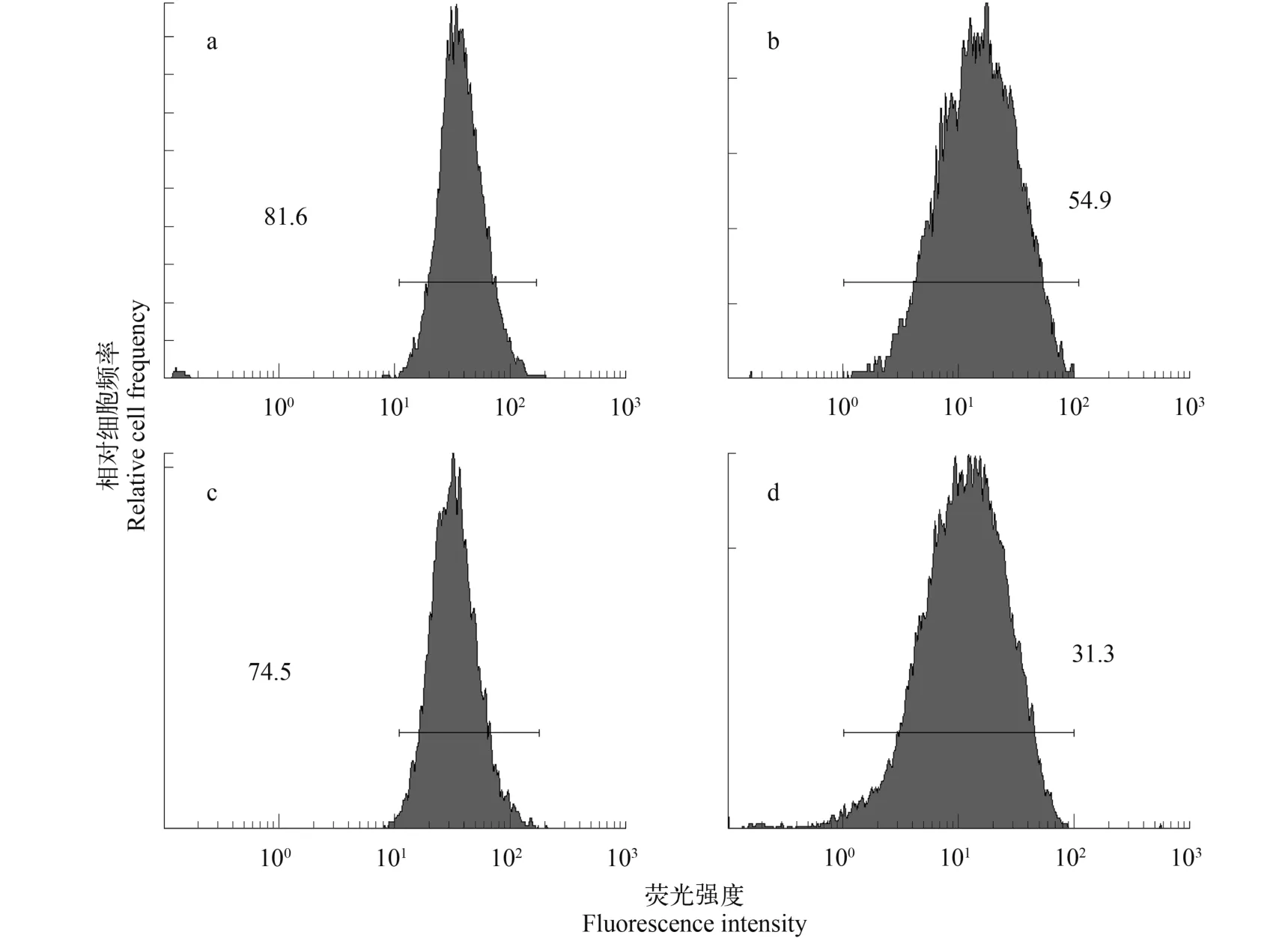
圖3 銅綠微囊藻(PCC 7806)與小球藻(FACHB-31)存活率Fig. 3 Comparison of metabolic activities between Microcystis aeruginosa PCC 7806 and Chlorella sp. FACHB-31 by flow cytometry(FCM) after 30 days of darkness and low-temperature incubation
在自然水體中, 浮游植物必須面對晝夜和季節交替的過程, 這使得它們可能會長期或周期性地處于一個不利的環境中, 在這種情況下, 藻類需要具備能夠長期耐受不利條件并能在有利條件下及時恢復的能力。對藍藻生活史的研究發現, 一部分時間是以休眠的形式存在于底泥中, 剩余的時間是以漂浮狀態存在[17]。這種底棲-漂浮的生活史不僅影響不同浮游植物種類的演替[18], 也直接影響了水體某些種類的優勢度[19]。然而, 藻類如何應對底棲中的低溫、黑暗條件以及它們的機制研究甚少。Wu等[8]研究發現與柵藻相比, 銅綠微囊藻在低溫黑暗條件下培養30d后, 細胞數量及葉綠素a含量變化不顯著, 表現出更強的適應能力, 使得其能在這樣的逆境條件下生存更長的時間。謝曉玲等[20]研究也表明, 當氣溫較低時, 藍藻較綠藻更占優勢。本研究結果也發現了低溫黑暗培養下銅綠微囊藻葉綠素a含量變化不顯著(圖1a), 表明銅綠微囊藻能夠適應低溫黑暗條件并保持色素的穩定性。然而,與微囊藻相比, 本研究發現小球藻的葉綠素a含量經過低溫黑暗培養呈顯著降低(圖1b), Zhang等[21]對黑暗處理條件下小球藻(Chlorella pyrenodosa)的研究也獲得了類似的結果, 即黑暗條件對小球藻細胞色素的合成有顯著影響。
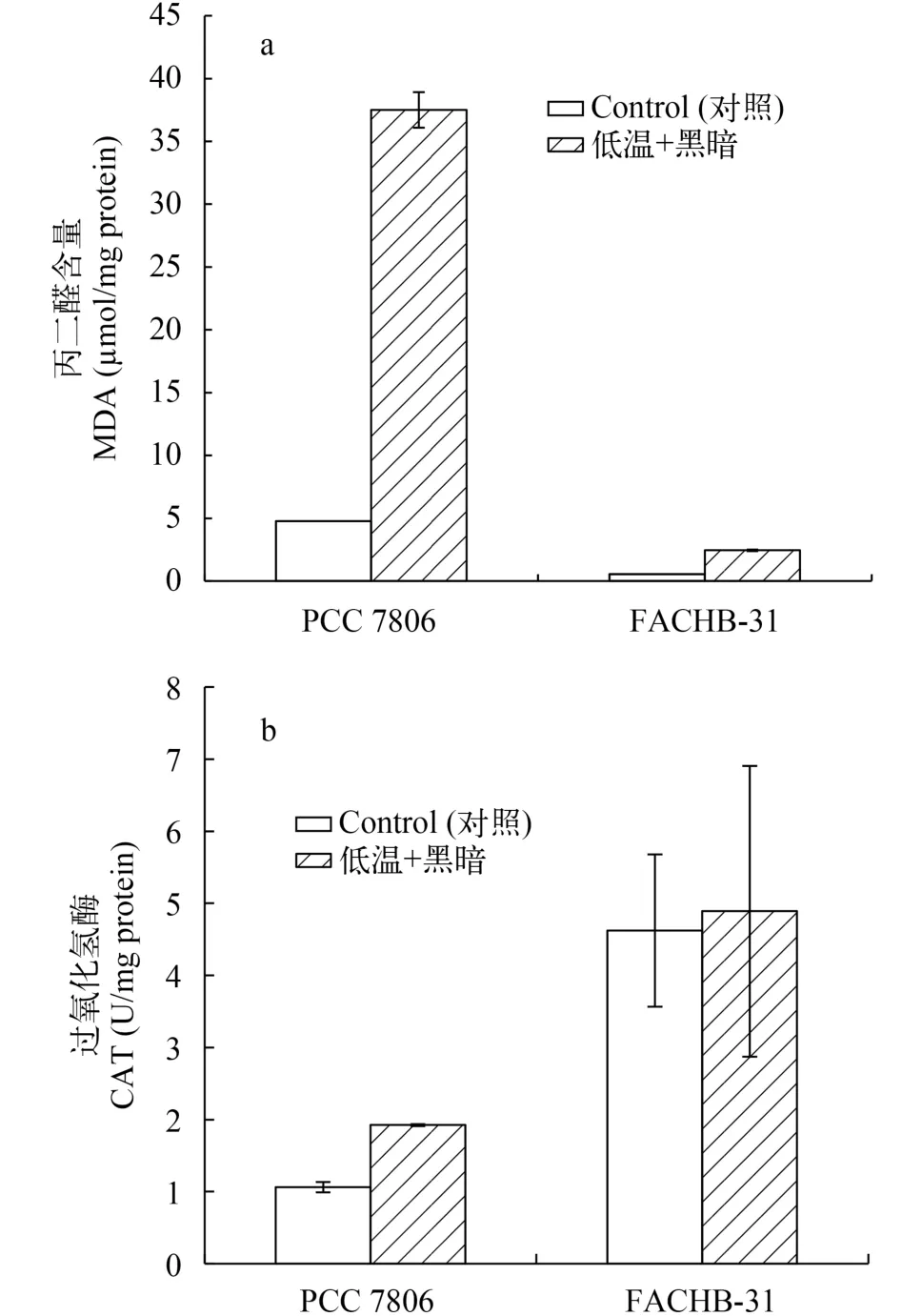
圖4 銅綠微囊藻與小球藻的丙二醛含量和過氧化氫酶活性Fig. 4 Effects of darkness and low-temperature on Malodialdehyde content (MDA) and catalase activity (CAT) in Microcystis aeruginosa PCC 7806 and Chlorella sp. FACHB-31 after 30 days incubation
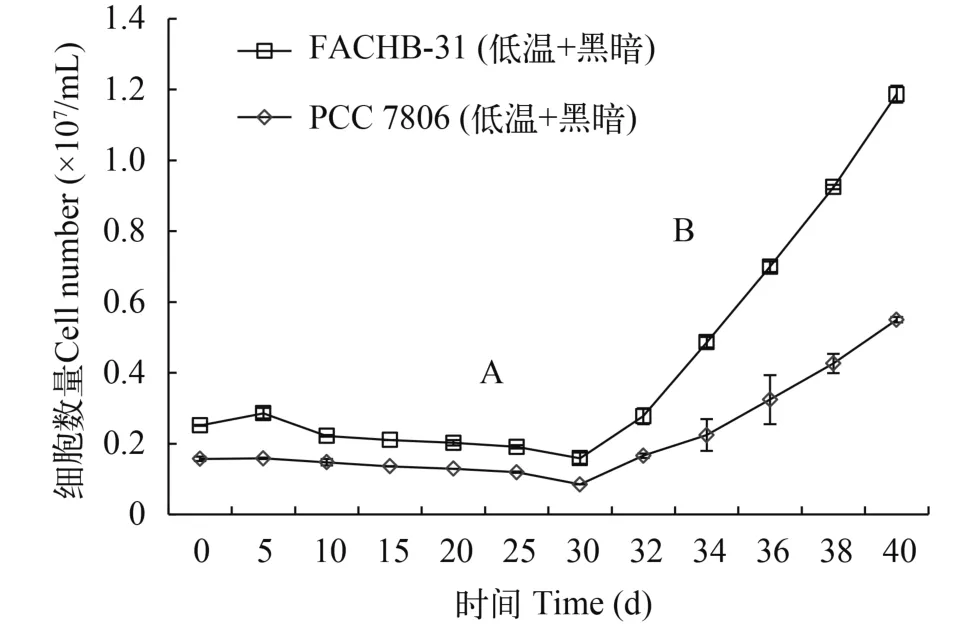
圖5 適應期(黑暗低溫)與恢復期(正常條件)細胞數量Fig. 5 Change of cell numbers in Microcystis aeruginosa PCC 7806 and Chlorella sp. FACHB-31 in response to darkness and low-temperature conditions
最大可變熒光(Fv/Fm)是衡量光化學效率的重要參數, 常用來表征PSⅡ反應中心內稟光能轉換效率。在正常生理狀態下,Fv/Fm處于穩定狀態[22]。本研究發現銅綠微囊藻與小球藻在低溫黑暗條件下培養Fv/Fm呈現逐步下降趨勢(圖2), 表明2種藻隨著低溫黑暗培養時間的增加, 最大可變熒光均受到影響。然而, 相比于小球藻, 銅綠微囊藻下降更加明顯。Wu等[8]對微囊藻和柵藻的研究也發現類似的結論。Jochem[23]研究發現, 在面對著黑暗脅迫下, 不同的浮游植物呈現可能呈現出2種不同的機制, 即減少代謝活性或仍保持穩定的代謝活性。本研究發現小球藻Fv/Fm值一直維持在一個穩定的水平, 這表明當遭受低溫、黑暗脅迫時, 微囊藻和小球藻表現出不同的機制來應對脅迫, 即微囊藻可能通過降低自身的光合活性, 而小球藻則保持較高的、穩定的光合活性。
丙二醛(MDA)是膜質過氧化的產物, 是表征膜受損程度及抗逆性的重要參數, MDA含量越高則表示細胞受損程度越大[24]。過氧化氫酶是細胞內分解有害產物過氧化氫重要的酶類。本研究發現銅綠微囊藻MDA含量高于小球藻(圖3a), 表明與小球藻相比, 銅綠微囊藻受到更大的氧化損傷。類胡蘿卜素是一種廣泛存在于生物的天然色素, 更是1種保護細胞免受活性氧, 強光等有害因素影響的天然抗氧化劑[25]。它是植物光合作用的輔助色素,具有捕獲光能并將其傳遞到葉綠素a的功能[26], 小球藻單位類胡蘿卜素含量的增加(圖1b), 表明類胡蘿卜素參與保護小球藻使其免受氧化損傷。過氧化氫酶(CAT)通過將H2O2歧化為H2O和O2的方式來維持生物體內的氧化還原平衡[27]。本研究發現與小球藻相比, 銅綠微囊藻CAT顯著增加(圖3b), 表明銅綠微囊藻通過CAT清除氧化損傷。由于抗氧化系統酶對于機體內活性氧自由基及過氧化氫的清除存在1個閾值, 當細胞內氧自由基濃度超過一定范圍, 抗氧化體系酶不能及時清除, 導致細胞進一步受到損傷[28]。因此, 本研究發現低溫黑暗培養30d后, 銅綠微囊藻與小球藻的存活率分別為54.9%和31.3% (圖4b、圖4d)。這表明2種藻均受到細胞的損傷。Wu等[8]表明銅綠微囊藻通過降低自身的代謝活性, 降低了細胞的死亡率。相比銅綠微囊藻,由于小球藻一直保持較高的光合活性, 導致存活率降低。當恢復光照與溫度后, 2種藻細胞數量增加,銅綠微囊藻與小球藻均顯著增加(P<0.05, ANOVA,圖5)。然而, 小球藻則表現出較快的生長恢復。陳曦等[29]研究提出小球藻對溫度具有極強的適應能力, 且在富含有機質的水域中生活良好, 因此在恢復溫度和光照的后便能更快的進行生長。
綜上所述, 低溫黑暗培養, 銅綠微囊藻存活率高于小球藻, 2種藻細胞數量差異顯著; 為了應對外界脅迫環境, 2種藻采用不同的代謝策略, 即銅綠微囊藻通過降低代謝活性, 而小球藻則采取保持較高代謝活性來應對不良環境。
[1]Qin B Q, Yang G J, Ma J R,et al. Dynamics of variability and mechanism of harmful cyanobacteria bloom in Lake Taihu, China [J].Chinese Science Bulletin, 2016,61(7): 759—770 [秦伯強, 楊桂軍, 馬健榮, 等. 太湖藍藻水華“暴發”的動態特征及其機制. 科學通報, 2016,61(7): 759—770]
[2]Codd G A, Metcalf J S, Morrison L F,et al. Susceptibility of flamingos to cyanobacterial toxins via feeding [J].Veterinary Record, 2003, 152(23): 722—723
[3]Ding Y, Gan N Q, Liu J,et al. Survival, recovery and microcystin release ofMicrocystis aeruginosain cold or dark condition [J].Chinese Journal of Oceanology and Limnology, 2017, 35(2): 313—323
[4]Paerl H W, Fulton R S, Moisander P H,et al. Harmful freshwater algal blooms, with an emphasis on cyanobacteria [J].The Scientific World Journal, 2001, 1(1): 76—113
[5]Dong J, Gao Y N, Li G B. A review: responses of phytoplankton communities to eutrophication and climate warming in freshwater lakes [J].Acta Hydrobiologica Sinica, 2016, 40(3): 615—625 [董靜, 高云霓, 李根保. 淡水湖泊浮游藻類對富營養化和氣候變暖的響應. 水生生物學報, 2016, 40(3): 615—625]
[6]Wang C H, Lin S J, Han B P,et al. Distribution ofMicrocytinsin typical water supply reservoirs and lakes in Guangdong province [J].Acta Hydrobiologica Sinica,2007, 13(3): 307—311 [王朝暉, 林少君, 韓博平, 等. 廣東省典型大中型供水水庫和湖泊微囊藻毒素分布. 水生生物學報, 2007, 13(3): 307—311]
[7]Lewis J, Jones K J, Edmonds R L,et al. Long-term survival of marine planktonic diatoms and dinoflagellates in stored sediment samples [J].Journal of Plankton Research, 1999, 21(2): 343—354
[8]Wu Z X, Song L R. Different tolerances and responses to low temperature and darkness between waterbloom forming cyanobacteriumMicrocystisand a green algaScenedesmus[J].Hydrobiologia, 2008, 596(1): 47—55
[9]Watanabe M M, Hiroki M. NIES-collection. List of strains, fifth edition [M]. Tsukuba, Japan. National Institute for Environmental Studies. 1997, 140
[10]Zhou B, Bi Y H, Hu Z Y,et al. Effects of temperature on the buoyancy ofMicrocystis aeruginosa[J].China Environmental Science, 2014, 34(7): 1847—1854 [周貝, 畢永紅, 胡征宇, 等. 溫度對銅綠微囊藻細胞浮力調控機制.中國環境科學, 2014, 34(7): 1847—1854]
[11]Xie L J, Yu D Z, Zeng C,et al. The response of bacterial community composition to the decomposition ofMicrocystisblooms [J].Journal of Lake Sciences, 2016, 28(1):22—30 [謝麗娟, 余得昭, 曾誠, 等. 細菌群落組成對微囊藻水華分解過程的響應. 湖泊科學, 2016, 28(1):22—30]
[12]Nusch E A. Comparison of different methods for chlorophyll and phaeopigment determination [J].Archiv fur Hydrobiologie Beiheft Ergebnisse der Limnologie, 1980, 14:14—36
[13]Wu X D, Kong F X, Cao H S,et al.In situstudy on the photochemical vitality of overwintering phytoplankton[J].Journal of Lake Sciences, 2007, 19(2): 139—145 [吳曉東, 孔繁翔, 曹煥生, 等. 越冬浮游植物光合作用活性的原位研究. 湖泊科學, 2007, 19(2): 139—145]
[14]Choo K S, Snoeijs P, Pedersén M. Oxidative stress tolerance in the filamentous green algaeCladophora glomerataandEnteromorpha ahlneriana[J].Journal of Experimental Marine Biology and Ecology, 2004, 298(1):111—123
[15]Uchimaya M, Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test [J].Analytical Biochemistry, 1978, 86(86): 271—278
[16]Endo H, Nakayama J, Hayashi T. Application of flow cytometry to environmental control in marine aquaculture [J].Materials Science and Engineering C, 2000,12(1—2): 83—88
[17]Cirés S, W?rmer L, Agha R,et al. Overwintering populations ofAnabaena,AphanizomenonandMicrocystisas potential inocula for summer blooms [J].Journal of Plankton Research, 2013, 35(6): 1254—1266
[18]Misson B, Latour D. Influence of light, sediment mixing,temperature and duration of the benthic life phase on the benthic recruitment ofMicrocystis[J].Journal of Plankton Research, 2012, 34(2): 113—119
[19]Head A M, Jones R I, Bailey-Watts A E. An assessment of the influence of recruitment from the sediment on the development of planktonic populations of cyanobacteria in a temperate mesotrophic lake [J].Freshwater Biology,1999, 41: 759—769
[20]Xie X L, Zhou R, Deng Z F,et al. Overcompensation and competitive effects ofMicrocystis aeruginosaandScenedesmus obliquusafter low temperature and light stresses[J].Acta Ecologica Sinica, 2014, 34(5): 1224—1234 [謝曉玲, 周蓉, 鄧自發. 光、溫限制后銅綠微囊藻和斜生柵藻的超補償生長和競爭效應. 生態學報, 2014, 34(5):1224—1234]
[21]Zhang M, Kong F X, Shi X L,et al. Differences in responses to darkness betweenMicrocystis aeruginosaandChlorella pyrenoidosa[J].Journal of Freshwater Ecology, 2007, 22(1): 93—99
[22]Tang J, Song L R, Zhang S S,et al. Recruitment ability ofMicrocystis aeruginosaunder low light-low temperature combination [J].Environmental Science, 2012, 12(31):2932—2937 [湯俊, 宋立榮, 張松松, 等. 低光低溫聯合作用對銅綠微囊藻復蘇能力的影響. 環境科學, 2012,12(31): 2932—2937]
[23]Jochem F J. Dark survival strategies in marine phytoplankton assessed by cytometric measurement of metabolic activity with fluorescein diacetate [J].Marine Biology, 1999, 135(4): 721—728
[24]Liu H, Chen X Q, Pei Y S. Acute toxic effects of boron compounds onChlorella vulgaris[J].Research of Environmental Sciences, 2015, 28(12): 1887—1894 [劉歡, 陳雪晴, 裴元生. 硼彭化合物對普通小球藻的急性毒性效應. 環境科學研究, 2015, 28(12): 1887—1894]
[25]Liu R, Bai F, Ran X F,et al. Effect ofN-phenyl-2-Naphthylamine on the growth, antioxidative enzyme and PSⅡinCylindrospermopsis raciborskii[J].Acta Hydrobiologica Sinica, 2015, 39(4): 774—781 [劉瑞, 白芳, 冉小飛,等. N-苯基-2-萘胺對擬柱胞藻生長、抗氧化酶及光合系統Ⅱ的影響. 水生生物學報, 2015, 39(4): 774—781]
[26]Wan L, Shao L L, Lu K H,et al. Effects of ultrasound wave on the ultrastructure and physiological characteristics of blue-green algae (Microcystis aeruginosa) [J].Acta Hydrobiologica Sinica, 2014, 38(3): 516—524 [萬莉, 邵路路, 陸開宏, 等. 超聲波對銅綠微囊藻超微結構和生理特性的影響. 水生生物學報, 2014, 38(3): 516—524]
[27]Deng S P, Zhao Y T, Zhu C H,et al. Effect of cadmium on the antioxidant enzyme activity and lipid peroxidation inSanguinolaria acuta[J].Acta Hydrobiologica Sinica,2012, 36(4): 689—695 [鄧思平, 趙云濤, 朱春華, 等. 鎘對尖紫蛤抗氧化酶活性及脂質過氧化的影響. 水生生物學報, 2012, 36(4): 689—695]
[28]Liu L, Yan H, Xia W T,et al. Toxic effect of cadmium onMicrocysis aeruginosaandScenedesmus obliquus[J].China Environmental Science, 2014, 34(2): 478—484 [劉璐, 閆浩, 夏文彤, 等. 鎘對銅綠微囊藻和斜生柵藻的毒性效應. 中國環境科學, 2014, 34(2): 478—484]
[29]Chen X, Liu R Y, Wang Y F,et al. Research on algal diversity in Zoige Alpine Wetland [J].Environmental Science, 2012, 33(3): 201—209 [陳曦, 劉如銦, 王艷芬, 等.若爾蓋高原濕地藻類多樣性研究. 環境科學, 2012,33(3): 201—209]

