Ⅰ型鴨甲型肝炎病毒3C基因在昆蟲細(xì)胞的表達(dá)與檢測
吳植+顧玲玲+朱善元+王安平
摘要:利用桿狀病毒表達(dá)系統(tǒng)進(jìn)行Ⅰ型鴨甲型肝炎病毒蛋白水解酶3C基因的表達(dá)研究。首先通過PCR方法擴(kuò)增出3C基因,亞克隆至桿狀病毒轉(zhuǎn)移載體pFastBac1中,獲得重組轉(zhuǎn)座載體pFB-3C,隨后將該重組質(zhì)粒轉(zhuǎn)化感受態(tài)細(xì)胞DH10Bac進(jìn)行同源重組,經(jīng)藍(lán)白斑篩選及PCR鑒定后,獲得重組桿狀病毒穿梭質(zhì)粒rBacmid-3C,將其在脂質(zhì)體介導(dǎo)下轉(zhuǎn)染sf9昆蟲細(xì)胞,獲得重組桿狀病毒rBac-3C,并進(jìn)行重組蛋白表達(dá)的檢測。間接免疫熒光結(jié)果,鴨抗全病毒陽性血清能夠與重組蛋白發(fā)生特異性結(jié)合。結(jié)果表明,DHAV-Ⅰ 3C蛋白在sf9昆蟲細(xì)胞中獲得了成功表達(dá)。
關(guān)鍵詞:Ⅰ型鴨甲型肝炎病毒;3C基因;昆蟲細(xì)胞;表達(dá)
中圖分類號: S858.32文獻(xiàn)標(biāo)志碼: A文章編號:1002-1302(2017)23-0033-02
鴨甲型肝炎病毒(duck hepatitis A virus,DHAV)主要侵害4周齡之內(nèi)雛鴨,引起一種急性高度接觸致死性烈性傳染病,以角弓反張和肝臟病變?yōu)橹饕卣鳎?周齡以內(nèi)的雛鴨病死率接近100%,嚴(yán)重危害我國養(yǎng)鴨業(yè)。DHAV可分為3種血清型,分別為DHAV-Ⅰ(經(jīng)典的DHV-Ⅰ)[1]、DHAV-Ⅱ(新發(fā)現(xiàn)于臺灣的血清型)[2]、DHAV-Ⅲ(新發(fā)現(xiàn)于中國和韓國的血清型)[3-4],3個(gè)血清型之間存在明顯的差異,無交叉免疫性。目前,我國DHAV-Ⅰ流行較普遍,對養(yǎng)鴨業(yè)危害最大。
DHAV-Ⅰ為小RNA病毒科的成員,具有小RNA病毒的基本結(jié)構(gòu),整個(gè)基因組分為3個(gè)部分:5′非編碼區(qū)(untranslated region,UTR),1個(gè)編碼多聚蛋白的開放閱讀框(Open Reading Frame,ORF)和3′非編碼區(qū)(3′UTR),3′UTR之后是poly(A)尾。ORF編碼的聚合蛋白分為1個(gè)結(jié)構(gòu)蛋白區(qū)(P1)和2個(gè)非結(jié)構(gòu)蛋白區(qū)(P2、P3),結(jié)構(gòu)蛋白P1在病毒自身編碼的蛋白酶的作用下可以水解成VP0、VP1、VP3 3種衣殼蛋白;P2區(qū)可以裂解為2A1、2A2(2A3)、2B、2C 4種或5種非結(jié)構(gòu)蛋白;P3區(qū)又可以裂解為3A、3B、3C、3D 4種非結(jié)構(gòu)蛋白。其中3C蛋白是一種蛋白水解酶,在多聚蛋白的水解以及病毒的復(fù)制、形成過程中發(fā)揮重要作用[5-6]。本研究利用桿狀病毒/昆蟲細(xì)胞系統(tǒng)表達(dá)DHAV-Ⅰ 3C基因,為3C蛋白的開發(fā)應(yīng)用奠定了基礎(chǔ)。
1材料與方法
1.1載體、菌株和毒株
DHAV-Ⅰ SH株由中國農(nóng)業(yè)科學(xué)院上海獸醫(yī)研究所惠贈(zèng);感受態(tài)細(xì)胞DH10Bac、DH5α、桿狀病毒轉(zhuǎn)移載體pFastBac1、含有目的基因的重組質(zhì)粒pET-3C均由江蘇省獸用生物制藥高技術(shù)研究重點(diǎn)實(shí)驗(yàn)室制備并保存。
1.2工具酶和試劑
轉(zhuǎn)染試劑Cellfectin Ⅱ Reagent購自Invitrogen公司;限制性內(nèi)切酶、T4 DNA連接酶、pfu DNA聚合酶購自Fermentas公司;FITC標(biāo)記的羊抗鴨IgG購自KPL公司;異丙基硫代-β-D-半乳糖苷(IPTG)、氨芐青霉素(Amp)、卡那青霉素(Kan)、四環(huán)霉素(Tet)、慶大霉素(Gen)購自Sigma公司;昆蟲細(xì)胞培養(yǎng)基Sf-900 Ⅱ SFM(serum free medium)購自GBICO公司;其他試劑均為國產(chǎn)分析純級。
1.3引物的合成
根據(jù)GenBank中DHAV-1 SH株病毒全基因組序列(登錄號FJ157178),設(shè)計(jì)1對特異性引物以擴(kuò)增其開放閱讀框,并在上下游引物5′端分別引入BamHⅠ、XhoⅠ酶切位點(diǎn),3C-F:5′-TATGGATCCATGAGCGGGCGGGTGAATTTCAGAC-3′(BamHⅠ酶切位點(diǎn)),3C-R:5′-CGCCTCGAGTTATTGG TTAAAAACTGGAAAAACC-3′(XhoⅠ酶切位點(diǎn)),通用引物M13序列參照桿狀病毒表達(dá)系統(tǒng)操作說明書設(shè)計(jì)。引物均由上海生工生物工程技術(shù)有限公司合成。
1.43C基因的擴(kuò)增
以含有目的基因的重組質(zhì)粒pET-3C為模板高保真PCR擴(kuò)增3C基因。50 μL擴(kuò)增體系:pfu DNA Polymerase 1 μL、10×Buffer 5 μL、Primer F 1 μL、Primer R 1 μL、dNTP(2 mmol/L)5 μL、DNA 1 μL、DDW 36 μL。反應(yīng)程序?yàn)?94 ℃ 預(yù)變性5 min;94 ℃變性 20 s,52 ℃退火20 s,72 ℃延伸 90 s,30個(gè)循環(huán);72 ℃延伸5 min。PCR產(chǎn)物用0.8%瓊脂糖凝膠電泳檢測。
1.5重組轉(zhuǎn)座載體pFB-3C的構(gòu)建
將回收的PCR產(chǎn)物及桿狀病毒載體pFastBac1分別用XhoⅠ和BamHⅠ雙酶切后,回收3C基因片段及線性化的載體,T4連接酶連接,連接產(chǎn)物轉(zhuǎn)化感受態(tài)細(xì)胞E.coli DH5α。挑取單菌落,提取質(zhì)粒,XhoⅠ和BamHⅠ雙酶切鑒定。重組子命名為pFB-3C。
1.6質(zhì)粒DNA的轉(zhuǎn)座
參照Invitrogen公司的桿狀病毒操作流程說明書,將重組質(zhì)粒pFB-3C轉(zhuǎn)化感受態(tài)細(xì)胞DH10Bac,均勻涂布于含有IPTG、X-Gal的LB平板上(含慶大霉素、卡那霉素和四環(huán)素),37 ℃培養(yǎng)箱內(nèi)培養(yǎng),直至藍(lán)白斑出現(xiàn)。隨機(jī)挑取數(shù)個(gè)白色菌落,堿裂法提取質(zhì)粒DNA,用引物M13進(jìn)行PCR鑒定。PCR產(chǎn)物用0.7%瓊脂糖凝膠電泳檢測。
1.7重組桿狀病毒rBac-3C的制備
將提取的重組桿粒rBacmid-3C和野生型Bacmid DNA參照轉(zhuǎn)染試劑說明書轉(zhuǎn)染昆蟲細(xì)胞sf9。轉(zhuǎn)染后約72 h,待細(xì)胞出現(xiàn)明顯病變、細(xì)胞變大時(shí),收集細(xì)胞上清,即為P1代 rBac-3C,4 ℃避光保存?zhèn)溆谩⒄誌nvitrogen公司的桿狀病毒操作流程說明書,將P1代重組桿狀病毒在sf9昆蟲細(xì)胞上進(jìn)行擴(kuò)增,直至P3代,并利用空斑試驗(yàn)測定P3代rBac-3C的病毒滴度。endprint
1.8表達(dá)產(chǎn)物的間接免疫熒光鑒定
將P3代rBac-3C按MOI為5感染24孔板中處于對數(shù)生長期的sf9細(xì)胞,72 h后,棄去上清,用預(yù)冷的冷丙酮固定20 min,PBS洗滌3次,用5% BSA室溫封閉1 h,加入鴨抗全病毒血清(1 ∶100),37 ℃孵育2 h后,PBST洗滌3次后,加入FITC標(biāo)記的羊抗鴨IgG(1 ∶100),37 ℃孵育30 min,PBST洗滌3次后,在熒光倒置顯微鏡下觀察特異性熒光。
2結(jié)果與分析
2.1目的基因的克隆
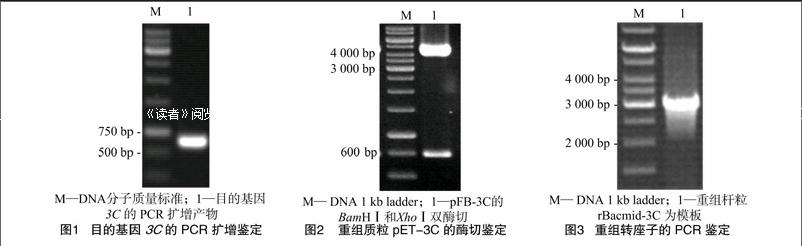
高保真PCR擴(kuò)增產(chǎn)物經(jīng)瓊脂糖凝膠電泳檢測,可見1條大小約為580 bp的目的條帶(圖1),與預(yù)期值一致。
2.2重組轉(zhuǎn)座載體pFB-3C的構(gòu)建與鑒定
3C基因經(jīng)XhoⅠ和BamHⅠ酶切后插入經(jīng)同樣酶切的pFastBac1,XhoⅠ和BamHⅠ雙酶切鑒定,結(jié)果出現(xiàn)約580 bp和4 800 bp的2條條帶(圖2),與預(yù)期結(jié)果相符。
2.3重組Bacmid的篩選與鑒定
用M13引物對重組Bacmid進(jìn)行PCR鑒定,結(jié)果rBacmid-3C的擴(kuò)增條帶大小約為2 900 bp,與預(yù)期片段大小相符(圖3),說明3C基因轉(zhuǎn)座成功。
2.4表達(dá)產(chǎn)物的間接免疫熒光檢測
以鴨抗全病毒血清為一抗對昆蟲細(xì)胞內(nèi)的表達(dá)產(chǎn)物進(jìn)行間接免疫熒光檢測,從圖4可以看出,rBac-3C感染的昆蟲細(xì)胞胞漿內(nèi)有大量特異性熒光出現(xiàn),而野生型桿狀病毒感染的細(xì)胞內(nèi)則未觀察到。
3討論
鴨甲型肝炎病毒屬于小RNA病毒科禽肝炎病毒屬。3C蛋白是小RNA病毒的自身蛋白水解酶之一,能夠正確水解多種前體蛋白,從而保證了衣殼的形成。3C蛋白酶不但能夠水解自身的前體多聚蛋白,還能水解宿主細(xì)胞內(nèi)的蛋白,包括一些細(xì)胞的骨架蛋白、翻譯因子、固有免疫信號分子等,從而抑制宿主蛋白的功能發(fā)揮,保證了病毒蛋白有效逃避固有免疫的監(jiān)控,在病毒顆粒的穿入和釋放中發(fā)揮重要的作用[7]。
Bac-to-Bac系統(tǒng)作為桿狀病毒表達(dá)系統(tǒng)己被廣泛使用,且己被商業(yè)化。Bac-to-Bac系統(tǒng)主要利用Luckow等研發(fā)的基因轉(zhuǎn)座技術(shù)而形成[8]。該系統(tǒng)優(yōu)點(diǎn)是可以高效獲得重組桿狀病毒,效率可達(dá)100%,避免了以前采用同源重組機(jī)制獲得重組桿狀病毒效率較低的問題。與原核表達(dá)系統(tǒng)相比,該系統(tǒng)具有蛋白質(zhì)翻譯后修飾所必需的酶系統(tǒng),能對外源蛋白進(jìn)行糖基化、磷酸化和信號肽切除等翻譯后加工修飾,從而保留表達(dá)蛋白的生物學(xué)活性[9]。
本研究利用桿狀病毒/昆蟲細(xì)胞表達(dá)系統(tǒng)成功制備了表達(dá)3C蛋白的重組桿狀病毒,間接免疫熒光結(jié)果顯示,陽性鴨抗全病毒血清能與重組蛋白3C發(fā)生特異性結(jié)合,說明重組蛋白3C具有良好的反應(yīng)原性,由于是首次利用該系統(tǒng)表達(dá)3C蛋白,后續(xù)將從優(yōu)化密碼子角度出發(fā)提高重組蛋白的表達(dá)量,為3C功能的進(jìn)一步研究奠定基礎(chǔ)。
參考文獻(xiàn):
[1]Wang L,Pan M,F(xiàn)u Y,et al. Classification of duck hepatitis virus into threegenotypesbased on molecular evolutionary analysis[J]. Virus
Genes,2008,37(1):52-59.
[2]Tseng C H,Knowles N J,Tsai H J. Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J]. Virus Research,2007,123(2):190-203.
[3]Kim M C,Kwon Y K,Joh S J,et al. Recent korean isolates of duck hepatitis virus reveal the presence of a new geno- and serotype when compared to duck hepatitis virus type 1 type strains[J]. Archives of Virology,2007,152(11):2059-2072.
[4]Kim M C,Kwon Y K,Joh S J,et al. Differential diagnosis between type-specific duck hepatitis virus type 1 (DHV-1) and recent Korean DHV-1-like isolates using a multiplex polymerase chain reaction[J]. Avian Pathology,2008,37(2):171-177.
[5]Ding C Y,Zhang D B. Molecular analysis of duck hepatitis virus type 1[J]. Virology,2007,361(1):9-17.
[6]張艷芳,羅薇,劉內(nèi)生,等. 鴨肝炎病毒的研究進(jìn)展[J]. 中國畜牧獸醫(yī),2011,38(7):171-175.
[7]劉艷,李冰清,孟紅. 小RNA病毒3C蛋白酶及其裂解底物[J]. 生物技術(shù)通報(bào),2014(8):46-51.
[8]Luckow V A,Lee S C,Barry G F,et al. Efficient generation of infectious recombinant baculoviruses by site-specific transposon-mediated insertion of foreign genes into a baculovirus genome propagated in Escherichia coli[J]. Journal of Virology,1993,67(8):4566-4579.
[9]Altmann F,Staudacher E,Wilson I B,et al. Insect cells as hosts for the expression of recombinant glycoproteins[J]. Glycoconjugate Journal,1999,16(2):109-123.江蘇農(nóng)業(yè)科學(xué)2017年第45卷第23期王蘭萍,崔悅,馬蕊,等. 灘羊群體產(chǎn)羔性狀相關(guān)基因位點(diǎn)的遺傳變異分析[J]. 江蘇農(nóng)業(yè)科學(xué),2017,45(23):35-37.endprint

