肺靜脈釋放法在單純超聲心動圖引導下經皮封堵治療房間隔缺損中的應用
歐陽文斌,郭改麗,胡盛壽,趙廣智,張鳳文,謝涌泉,劉垚,李慕子,邱旭,岳子祺,潘湘斌
房間隔缺損(ASD)是常見的先天性心臟病之一,由于無需外科開胸及體外循環,經皮介入封堵治療已成為繼發孔型ASD的主要治療方法[1,2]。但是,傳統經皮介入治療術中使用放射線對患者及醫生均有輻射損傷。為了克服上述缺點并充分發揮超聲心動圖的優勢,我院自2012年起開展超聲心動圖作為唯一影像學工具經股靜脈行ASD封堵術,取得了良好效果[3,4]。但是,部分患者由于ASD較大且主動脈側邊緣短小,使用常規釋放方法放置封堵器易脫入右心房而致封堵失敗[5,6],本研究針對此類患者采用肺靜脈釋放法治療,探討其安全性和有效性。
1 資料與方法
研究對象:2012-10至2016-09,選取我院由于常規釋放方法無法成功放置封堵器而接受肺靜脈釋放法的ASD患者38例,其中男性14例(36.8%),平均年齡(16.0±15.6)歲,平均體重(37.2±22.9)kg,ASD平均直徑(17.1±4.2)mm。入選標準:年齡≥2歲,缺損直徑≥5 mm且右心容量負荷增加的中央型ASD;缺損邊緣至上、下腔靜脈、冠狀靜脈竇及肺靜脈的距離≥5 mm,至房室瓣≥7 mm;房間隔的直徑大于所選封堵傘左心房側的直徑。排除標準:原發孔型ASD及靜脈竇型ASD,心內膜炎及出血性疾患,封堵器安置處有血栓存在,導管插入處有靜脈血栓形成,嚴重肺動脈高壓導致右向左分流,合并需要外科手術處理的疾病。所有患者術前均行心電圖、胸部X片和超聲心動圖等檢查,術中及術后使用超聲心動圖評價手術效果。
手術方法:患者在術前行經胸超聲心動圖檢查,測量ASD直徑并觀察其邊緣情況。局部麻醉或基礎麻醉下,患者取仰臥位,在臍部以下、膝蓋以上消毒鋪單。穿刺右側股靜脈,置入6 Fr血管鞘,經血管鞘送入6 Fr多功能導管及特硬導絲。在超聲引導下,將導絲及導管送過ASD。退出多功能導管及血管鞘。根據所選封堵器的直徑,選擇10~14 Fr 45度輸送鞘,沿特硬導絲送至左心房。退出導絲及輸送鞘內芯后,送入ASD封堵器(上海形狀記憶合金材料有限公司),在超聲心動圖監測下進行封堵。如果嘗試使用常規釋放方法放置封堵器兩次,封堵器仍脫入右心房而致封堵失敗者(圖1A),則改用肺靜脈釋放法。將封堵器左心房側傘盤部分釋放于左上肺靜脈內(圖1B),迅速后撤輸送鞘并在右心房內釋放封堵器右心房側傘盤,此時封堵器左上肺靜脈內傘盤會被牽引至左心房內自動展開,形成雙側傘盤夾住主動脈根部和房間隔的形態(圖1C、1D)。封堵器安置成功后,以超聲心動圖檢查有無殘余分流、二尖瓣和三尖瓣有無反流、冠狀靜脈竇有無受壓。確認封堵器位置、形態良好,封堵成功后,逆時針旋轉輸送桿,釋放封堵器。拔出輸送鞘并壓迫止血,繃帶加壓包扎。術后24 h皮下注射低分子肝素,術后半年內每日口服阿司匹林3~5 mg/kg。所有患者于1個月、3個月、6個月和12個月及每年在門診隨訪超聲心動圖及心電圖。
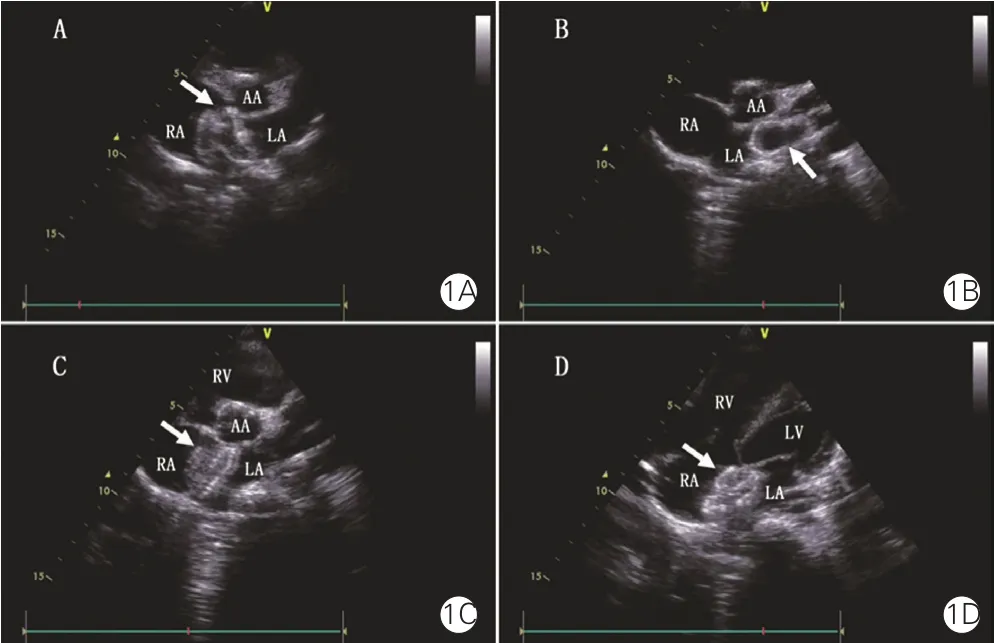
圖1 單純超聲心動圖引導下肺靜脈釋放法行經皮房間隔缺損封堵術
統計學方法:采用SPSS 20.0軟件包進行統計分析,計量資料以±s表示。
2 結果
38例患者的治療結果:37例(97.4%)患者在單純超聲心動圖引導下使用肺靜脈釋放法成功完成經皮ASD封堵術,1例患者改為在超聲心動圖引導下使用可調彎鞘經皮封堵成功。從穿刺至拔除動脈鞘管的操作時間為(25.2±5.1)min,ASD封堵器平均直徑為(22.9±5.6)mm,2例(5.2%)患者術后早期有微量殘余分流,無外周血管損傷、肺靜脈及心臟穿孔等并發癥。38例患者均康復出院,平均住院時間為(2.9±0.7)天。
隨訪結果:術后隨訪截止至2016-10,平均隨訪(23.9±15.4)個月。38例患者均無殘余分流、心包積液、主動脈瓣反流及肺靜脈狹窄等并發癥。
3 討論
隨著Amplatzer封堵器的廣泛應用和介入技術的快速發展,傳統放射線引導下經皮介入ASD封堵術已被證明是安全和有效的方法[1,2,7]。近年來,為避免患者及醫生的放射線損傷,使用超聲心動圖完全替代放射線進行介入治療成為改進傳統經皮介入技術的重要方法[8-11],目前,單純超聲心動圖引導經皮介入治療繼發孔型ASD的安全性和有效性已經獲得廣泛認同[3,4,12,13]。但是,部分缺損較大且主動脈側邊緣短小的患者,會出現使用常規釋放方法放置封堵器易脫入右心房而致封堵失敗的情況,即使在放射線引導下,目前這類患者也是ASD經皮介入治療的難點[5,6,14],更鮮有其在超聲心動圖引導下經皮介入治療的報道。本研究結果顯示,針對常規釋放方法放置封堵器失敗的ASD患者,在單純超聲心動圖引導下進行肺靜脈釋放法,在不使用放射線及對比劑的情況下,不但能有效地完成ASD經皮介入封堵,而且沒有出現嚴重并發癥,顯示該技術具有良好的安全性及有效性。
對于ASD較大且主動脈側邊緣短小的患者,由于封堵器釋放時左心房側傘盤與房間隔不平行,加之此類患者一般左心房較小,所以常規方法釋放封堵器易脫入右心房導致封堵失敗。在傳統放射線引導下,針對這種情況,常用的釋放方法有肺靜脈釋放法、球囊輔助技術和使用改良輸送鞘等[15]。但是,放射線是投影式探測,很容易判斷球囊、封堵器和導管的相對位置,而超聲心動圖卻是用切面的方式進行探測,往往不能同時準確顯示它們的相對位置和形態,所以球囊輔助技術在超聲心動圖引導下操作相對困難。另一方面,由于改良輸送鞘管徑較粗,一般較少應用于小兒患者,多在嘗試肺靜脈釋放法失敗后應用于大齡兒童或成人。而肺靜脈釋放法操作相對簡便,不需要特殊器材輔助,超聲心動圖監測下能清晰顯示雙側傘盤釋放過程,可作為超聲心動圖引導下常規放置方法失敗后首選的嘗試方法。
為了提高該技術的安全性和縮短學習曲線,我們總結經驗如下:(1)該技術應在封堵器常規放置方法失敗的基礎上選用,開展該技術應循序漸進,術者應該具有單純超聲心動圖引導下經皮介入治療的經驗,能夠在放射線引導下完成肺靜脈釋放法行經皮介入ASD封堵術。(2)定位準確。手術時在導管、導絲和輸送鞘上標記好工作距離[3],輸送鞘進入右心房后,一般選擇主動脈短軸切面,實時觀察輸送鞘的位置及封堵器的傘盤釋放情況。如無法判斷輸送鞘末端的位置,可以部分釋放封堵器左心房側傘盤進行確認。(3)輕柔操作。由于輸送鞘需要置入肺靜脈內,在輸送過程中需要結合超聲心動圖的圖像輕柔操作。如果該技術反復嘗試失敗三次,建議改用可調彎鞘進行封堵或改為經胸小切口微創封堵,切忌粗暴反復操作。(4)選擇合適的患者。初期開展該技術時,宜選擇ASD邊緣適合介入封堵的大齡兒童或聲窗條件較好的成人,相比小兒患者,這樣可增大操作空間,減少發生心臟和肺靜脈損傷等并發癥的概率。
綜上所述,使用肺靜脈釋放法進行單純超聲心動圖引導下經皮ASD封堵術安全、有效。該方法避免了放射線損傷,不增加醫療費用,同時保持了傳統經皮介入治療微創、安全的優點,為超聲心動圖引導下常規方法釋放封堵器失敗的ASD患者提供了一種簡便實用的治療方法。
[1]McElhinney DB, Quartermain MD, Kenny D, et al. Relative risk factors for cardiac erosion following transcatheter closure of atrial septal defects: a case-control study[J]. Circulation, 2016, 133 (18): 1738-1746. DOI: 10. 1161/CIRCULATIONAHA. 115. 019987.
[2]Tobis J, Shenoda M. Percutaneous treatment of patent foramen ovale and atrial septal defects[J]. J Am Coll Cardiol, 2012, 60 (18): 1722-1732. DOI: 10. 1016/j. jacc. 2012. 01. 086.
[3]潘湘斌, 李守軍, 胡盛壽, 等. 經胸超聲心動圖引導房間隔缺損封堵術的可行性[J]. 中華心血管病雜志, 2014, 42(9): 744-747. DOI:10. 3760/cma. j. issn. 0253-3758. 2014. 09. 008.
[4]Pan XB, Ou-Yang WB, Pang KJ, et al. Percutaneous closure of atrial septal defects under transthoracic echocardiography guidance without fluoroscopy or intubation in children[J]. J Interv Cardiol, 2015, 28 (4):390-395. DOI: 10. 1111/joic. 12214.
[5]Thanopoulos BD, Dardas P, Ninios V, et al. Transcatheter closure of large atrial septal defects with deficient aortic or posterior rims using the "Greek maneuver". A multicenter study[J]. Int J Cardiol, 2013, 168(4): 3643-3646. DOI: 10. 1016/j. ijcard. 2013. 05. 011.
[6]Dalvi BV, Pinto RJ, Gupta A. New technique for device closure of large atrial septal defects[J]. Catheter Cardiovasc Interv, 2005, 64(1): 102-107. DOI:10. 1002/ccd. 20248.
[7]Hoashi T, Yazaki S, Kagisaki K, et al. Management of ostium secundum atrial septal defect in the era of percutaneous trans-catheter device closure: 7-Year experience at a single institution[J]. J Cardiol,2015, 65 (5): 418-422. DOI: 10. 1016/j. jjcc. 2014. 07. 009.
[8]Wang SZ, Ou-Yang WB, Hu SS, et al. First-in-human percutaneous balloon pulmonary valvuloplasty under echocardiographic guidance only[J]. Congenit Heart Dis, 2016, 11: (6): 716-720. DOI: 10. 1111/chd. 12380.
[9]Pan XB, Ouyang WB, Wang SZ, et al. Transthoracic echocardiographyguided percutaneous patent ductus arteriosus occlusion: a new strategy for interventional treatment[J]. Echocardiography, 2016, 33 (7): 1040-1045. DOI: 10. 1111/echo. 13207.
[10]潘湘斌, 逄坤靜, 歐陽文斌, 等. 單純超聲引導下經皮室間隔缺損封堵術的應用研究[J]. 中國循環雜志, 2015, 30(8): 774-776 .DOI:10. 3969/j. issn. 1000-3614. 2015. 08. 014.
[11]潘湘斌, 歐陽文斌, 王首正, 等. 單純超聲引導下經頸靜脈室間隔缺損封堵術的探索研究[J]. 中國循環雜志, 2015, 30(12): 1204-1207. DOI: 10. 3969/j. issn. 1000-3614. 2015. 12. 017.
[12]Yang Y, Zhang W, Wu Q, et al. Transcatheter closure of atrial septal defects without fluoroscopy: a well-established procedure for alternative use in children[J]. EuroIntervention, 2016, 12 (5): e652-657. DOI: 10. 4244/EIJV12I5A106.
[13]Ewert P, Berger F, Daehnert I, et al. Transcatheter closure of atrial septal defects without fluoroscopy: feasibility of a new method[J].Circulation, 2000, 101(08): 847-849. DOI:10. 1161/01. CIR. 101. 8.847.
[14]Varma C, Benson LN, Silversides C, et al. Outcomes and alternative techniques for device closure of the large secundum atrial septal defect[J]. Catheter Cardiovasc Interv, 2004, 61(01) : 131-139. DOI:10.1002/ccd. 10700.
[15]Pillai AA, Satheesh S, Pakkirisamy G, et al. Techniques and outcomes of transcatheter closure of complex atrial septal defects - Single center experience[J]. Indian Heart J, 2014, 66 (1): 38-44. DOI: 10. 1016/j.ihj. 2013. 12. 016.

