咪唑并嘧啶類殺菌劑對大腸桿菌抑菌活性的QSAR研究
余訓爽
(長江大學化學與環境工程學院,湖北 荊州 434023)
余訓民
(武漢工程大學化學與環境工程學院,湖北 武漢 430073)
咪唑并嘧啶是一類非常重要的雜環化合物。大量研究表明該類化合物具有較好的生物活性,如殺蟲、殺菌、除草、抗病毒、抗癌等[1~6]。由于咪唑并嘧啶具有新型結構和獨特的作用機理,有廣譜的殺菌活性和低毒、高效等優點,因此在醫藥、農藥等領域備受關注[7]。因此,利用定量結構—活性關系(QSAR)方法研究與開發新穎咪唑并嘧啶類殺菌劑具有十分重要的意義。Sacchi等[8~9]報道了以2-甲基-咪唑并[1,2-a]嘧啶為母核,分別合成了3-位被不同的羧酸衍生物取代的一系列2-甲基-咪唑并[1,2-a]嘧啶類衍生物,此類化合物對抑制環氧化酶(COX)具有較好的抑制活性,但未見對環氧合酶-2(COX-2)的選擇性報道。戚繁等[10~14]在上述2類化合物結構的基礎上,對咪唑并[1,2-a]嘧啶的結構進行修飾,合成了2-位和3-位被不同的芳烴基和鹵代芳烴基取代的咪唑并[1,2-a]嘧啶類衍生物,并對所合成的化合物進行生物活性表征,實驗測試表明,該類化合物具有潛在藥理活性或生物活性,是一類選擇性良好的COX-2抑制劑。為了尋求更高生物活性的咪唑并嘧啶類殺菌劑,本研究對2,3-二氫咪唑并[1,2-c]嘧啶類化合物的抑菌活性進行了探討,以供咪唑并嘧啶類分子設計、合成與生物活性研究提供新的研究依據。
1 材料與方法
1.1 樣本來源與分類
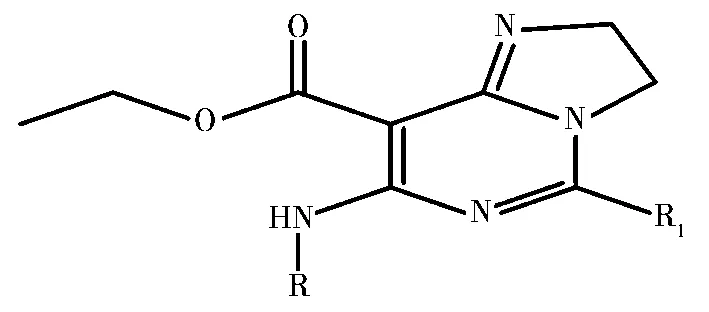
圖1 標題化合物的基本結構
此類抗菌劑的結構與活性來源于Jani 等[1]的研究。為了確保QSAR模型具有代表性和穩定的可靠性,共篩選26個化合物分子,其基本骨架見圖1。
根據隨機和活性梯度分布原則,將化合物分為2組,其中1~20作為訓練集,21~26作為測試集。所有化合物對大腸桿菌的抑制作用均以MIC/(μmol·dm-3)值表示,MIC值均轉換成PMIC值[1],見表1。
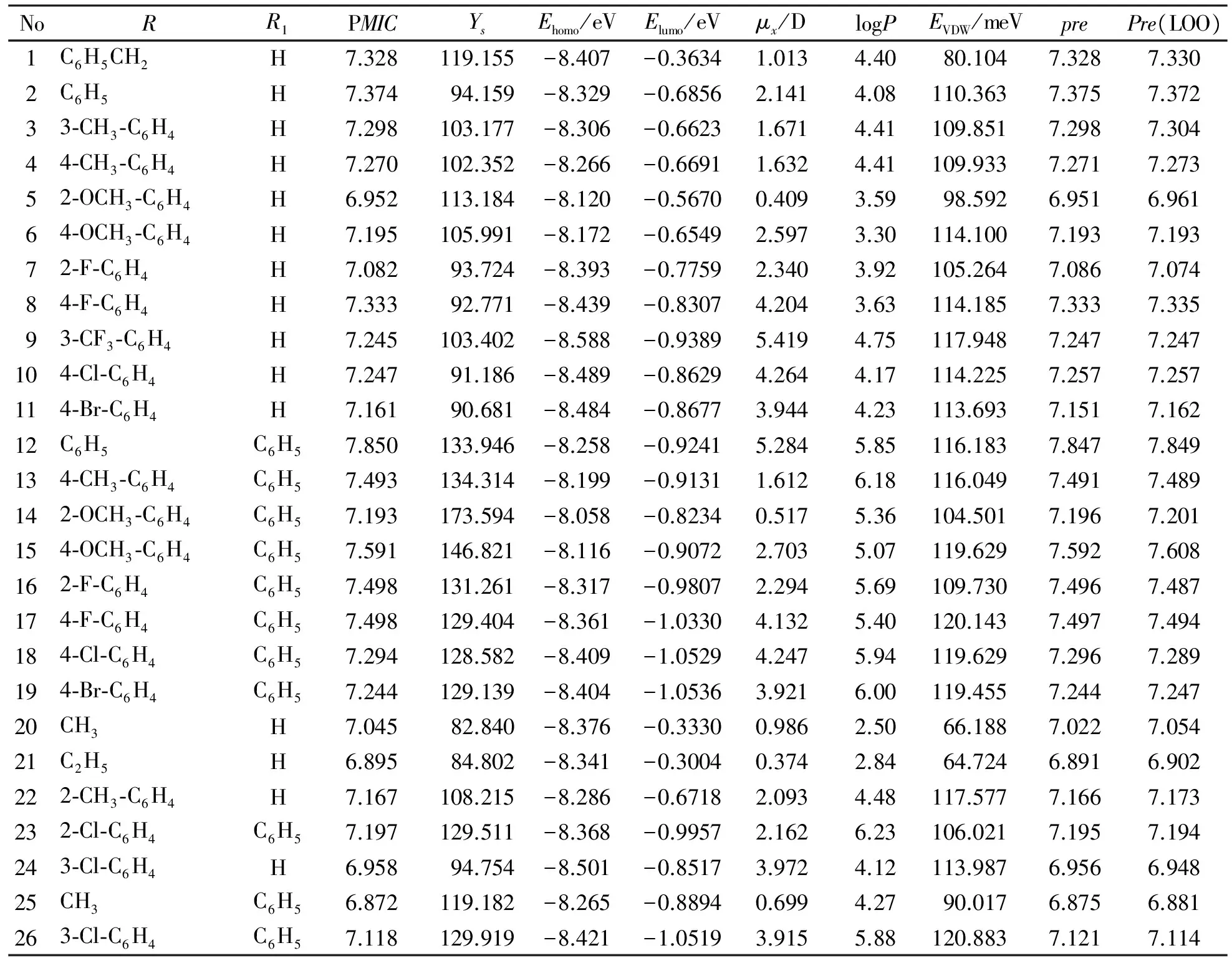
表1 大腸桿菌的訓練集和測試集化合物的生物學活性以及PMIC的預測結果
1.2 分子描述符的獲取的方法
采用Gaussian 09W程序在DFT-B3 LYP/ 6-311++G(d,p)水平上全優化計算26個咪唑并嘧啶類抗菌劑分子結構,經振動分析確認無虛頻,即勢能面上的極小點,得到化合物的結構參數:分子最高占用和最低空軌道能(Ehomo和Elumo)、分子次最高占用和次最低空軌道能(Enhomo和Enlumo)、范德瓦爾斯能(EVDW)、正辛醇/水分配系數(logP)、分子極化度(a)、分子偶極矩(μx)、三維空間拓撲指數(Ys)等20余個參數。
1.3 分子描述符的篩選
結合遺傳函數算法(GA)和主成分分析方法(PCA)在一定檢驗水平上挑選出的QSAR重要變量數作為輸入層節點數;輸出層神經元數對應于PMIC值。隱含層最佳節點數由訓練結果確定。根據網絡訓練中訓練集和預測集的均方根誤差(RMSE)變化情況確定訓練終止與否,為了避免過訓練,本研究在訓練過程中采用測試集進行監控,一旦測試集誤差明顯上升,則停止訓練。
2 結果與分析
2.1 分子描述符篩選的結果
將獲得的20余個參數用GFA-BPNN法找出與PMIC最密切相關的幾個自變量。因GA算法的結果具有隨機性,為此,設種群規模設定為30,交叉概率設定為0.8,變異概率設定為0.01,最大進化代數100。子代方程的優劣由復相相關系數來評價,子代的自適應性由Friedman的欠擬合函數LOF(lack-of-fit)來衡量[15]。若子代方程優于父代方程,保留子代方程,否則繼續雜交,直至達到設定的目標。GFA-BPNN程序運行100次后,選取復相相關系數較大且將出現頻率超過90%的結構參數用于建模。過多的描述符會導致模型的“過參數化”,為避免此情況發生,最終確定6個特征變量(表2)。由于結構描述符之間還存在一定的相關性,故用PCA法對原始數據進行降維,得到不相關的新變量,其結果見表2。
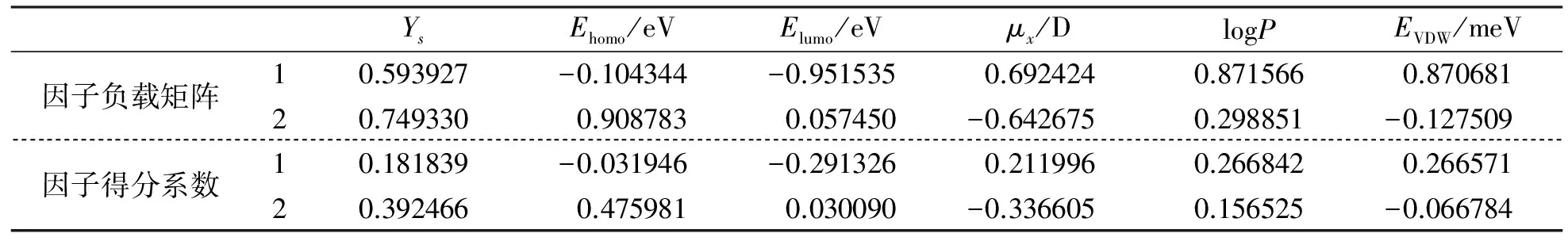
表2 主成分相關矩陣
經分析,前2個主成分因子的方差貢獻率之和為86.74%(表3),故可用前2個主成分因子代表原始數據的絕大部分信息作為人工神經網絡的輸入因子,從而達到簡化網絡結構的目的。
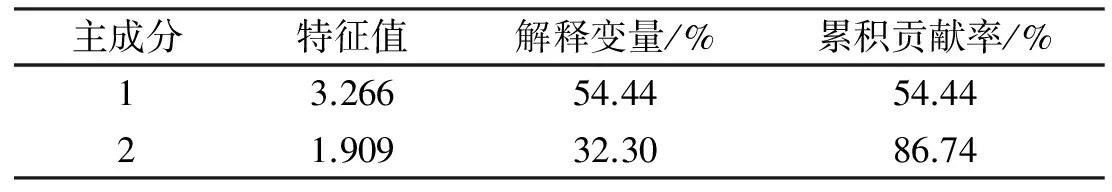
表3 主成分及方差貢獻
2.2 BPNN網絡結構中隱含層個數的確定
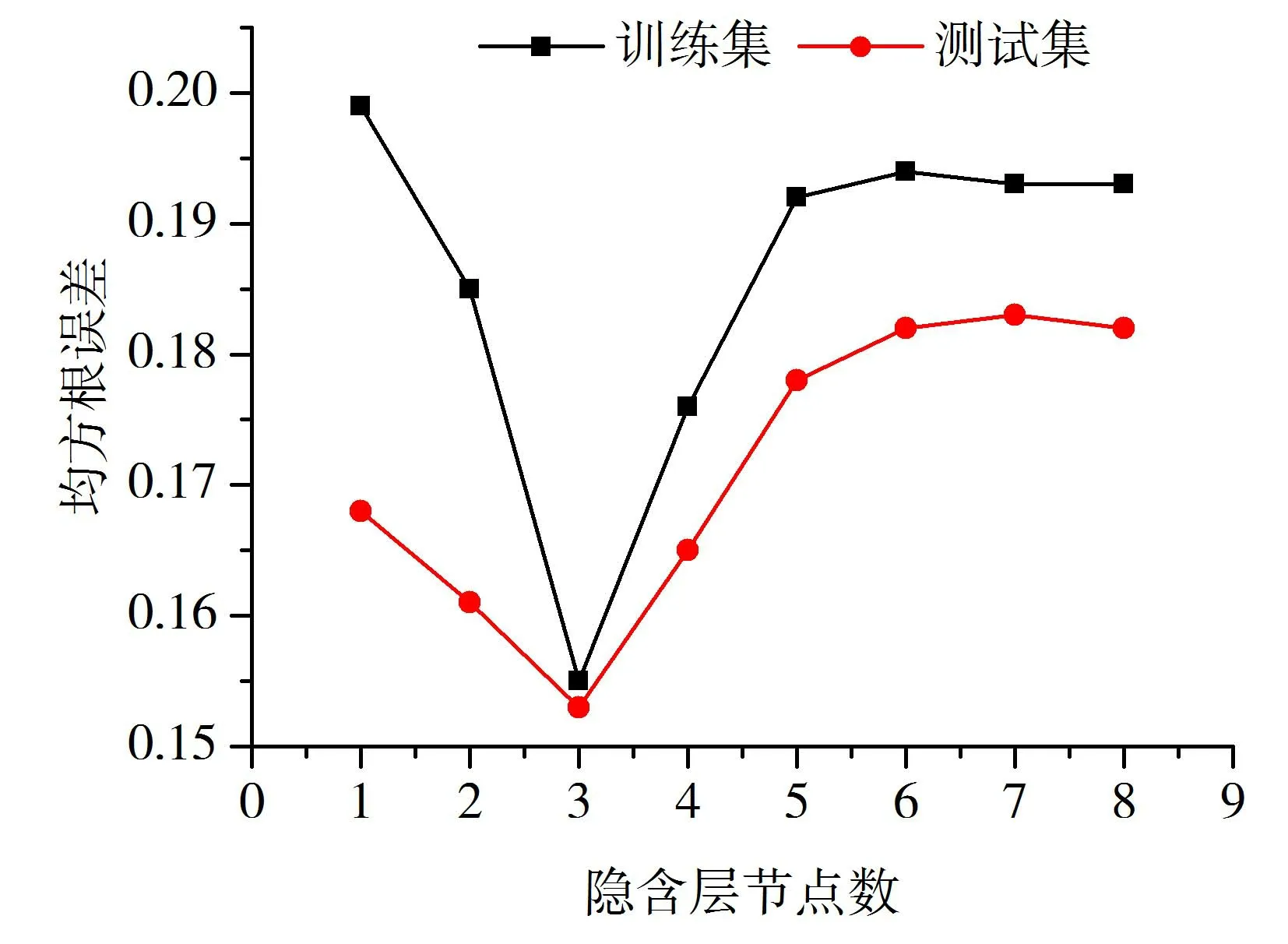
圖2 隱含層節點數與均方根誤差的關系
神經網絡的輸入節點為2個主成分因子,輸出節點為1個(PMIC),通過設定不同數目的隱含層節點數的網絡體系,以訓練10000次得到的訓練集與預測集樣本的均方根誤差(RMSE)作為評價指標,訓練結果見圖2。根據圖2,本研究選取2-3-1體系的網絡用于隨后的學習訓練和預測驗證。其他各參數如下:傳遞函數采用S型函數,訓練函數為雙曲正切(tansig)型函數,輸出函數為“pureiin”線性函數;網絡訓練精度為0.0001,學習的初始速率為0.4,動量常數為0.9,其他參數為默認值。其結果平均標準誤差為0.155,實驗值與預測值的相關系數R2=0.9991,其預測結果見表1。
2.3 模型的檢驗與評價
為了確保模型應用于實際之前有良好的可靠性和預測能力,必須對模型進行嚴格的檢驗與評價。
2.3.1 模型的內部檢驗
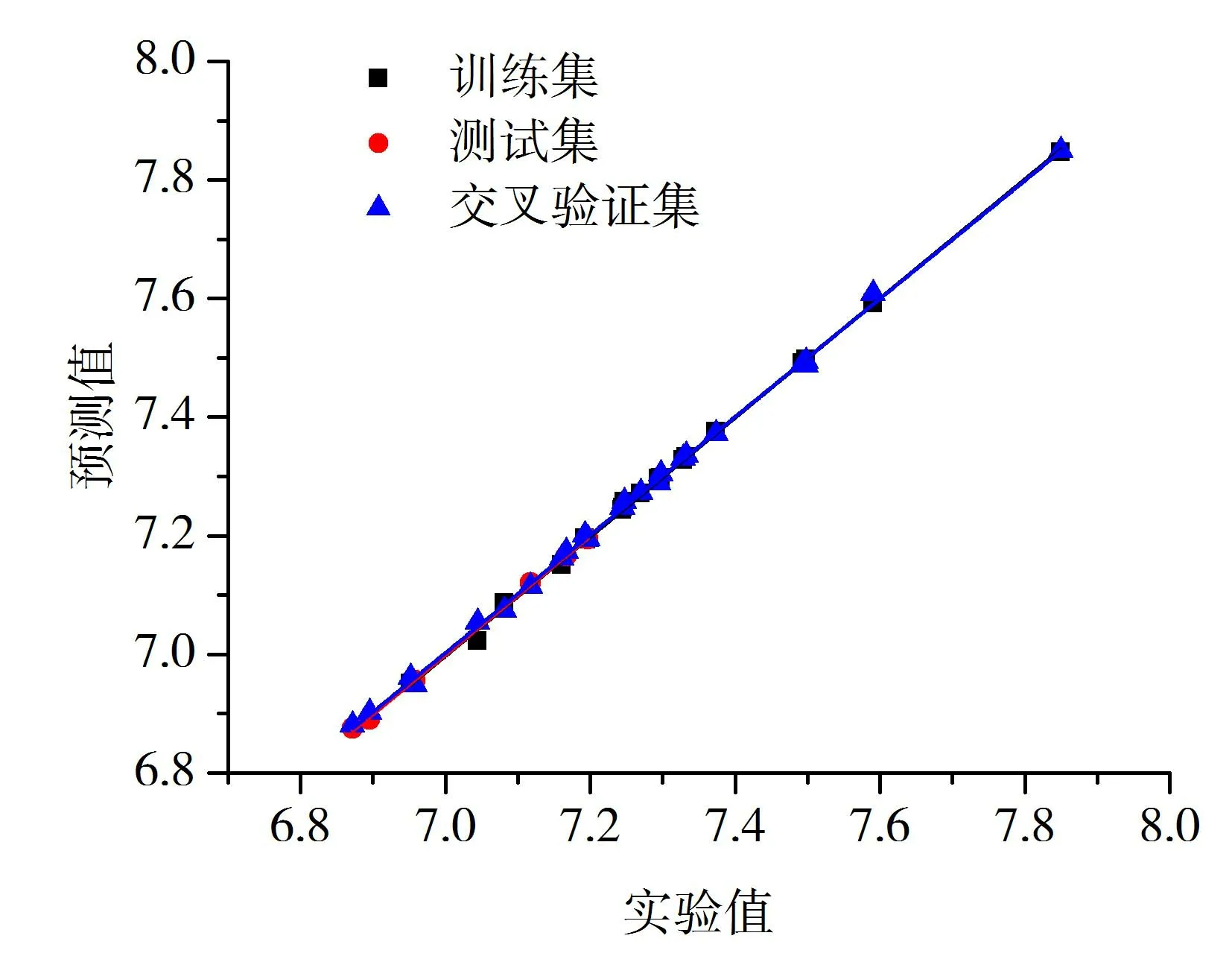
圖3 PMIC預測值與實驗值的線性關系圖
本研究用LOO法評價模型的內部預測能力和模型的穩健性,其檢驗統計參數見表4。
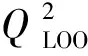
2.3.2 模型的外部檢驗
較強的內部預測能力不代表模型有較強的外部預測能力。為了確保模型的預測能力,將20個樣本作訓練集(Training set),6個樣本為測試集(Testing set),其外部檢驗統計參數見表4。
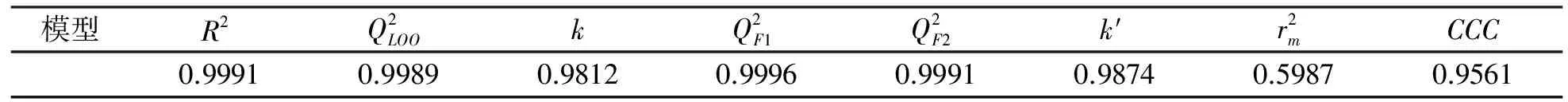
表4 模型的相關統計參數
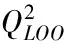
2.4 致毒機理探討
由表2因子負載矩陣值可知:Elumo和logP是影響咪唑并嘧啶類殺菌劑活性的主要因素。
1)Elumo作為一個重要的分子電性參數,反映了不同分子抑制反應的相對難易程度。
由第一主成分因子系數可知:咪唑并嘧啶類殺菌劑對大腸桿菌的毒性大小與Elumo呈負相關,說明其值越小,咪唑并嘧啶類殺菌劑的毒性愈大。由此可以推測咪唑并嘧啶類殺菌劑在生物體內的毒性作用以親電反應為主,咪唑并嘧啶類殺菌劑的Elumo愈低,親電性愈強,越易進攻生物大分子的巰基、活性氧等富電子原子或原子團,毒性愈大。故在R取代基團中的吸電子效應越強,其分子的毒性愈大,且對位>鄰位(表1)。
2)logP作為一個重要的熱力學參數,反映了不同分子在受體內富集的相對難易程度。
第一主成分因子系數中logP的系數表明它們對化合物毒性呈正貢獻,隨著R1取代基的引入,分子體積的增加不足以影響其通過細胞膜,因為體積增大,分子疏水性增強,導致其分子有很好的脂溶性,易于生物富集,有利于增加化合物的毒性,可見咪唑并嘧啶類抗菌劑分子在生物體內的富集能力是影響化合物對大腸桿菌抑制作用的另一個方面。
另外,由表2還可知,分子的活性與空間拓撲指數(Ys)和x軸方向的偶極距(μx)有一定的相關性,表明基團的空間效應對活性和選擇性均具有影響。
3 結論
研究結果表明,咪唑并嘧啶類分子對大腸桿菌的抑菌作用主要是通過在細胞膜內聚集(logP表征),進而與生物大分子發生電子轉移(Elumo表征)而完成的,且抑菌活性隨著取代基團中的吸電子效應的增強而增大。此結果可為設計新的此類藥物分子提供理論依據和研究思路。
[1]Duardo Bores de Melo,Márcia Miguel Castro Ferreira.Multivariate QSAR study of 4,5-dihydroxypyrimidine arboxamides as HIV-1 integrase Inhibitors[J].Eur J Med Chem,2009,44:3577~3583.
[2]Lee S,Park S B.An Efficient One-Step Synthesis of Heterobiaryl Pyrazolo [3,4-b]pyridines via Indole Ring Opening[J].Org Lett,2009,11:5214~5217.
[3]馬超,李坤,楊晨,等.吡唑衍生物合成研究進展[J].國外醫藥抗生素分冊,2011,32(5):211~218.
[4]蔡繼平,蔣華江,林顯明.3(5)-氨基毗吟的合成工藝改進[J].化工時刊,2005,20(5):15~19.
[5]Zhang X Y,Song Y P,Gao L,etal.Sythesis pyrazolopyrimidines from 1,2-allenic ketones and Aminopyrazoles [J].Synfacts,2014,10:362~370.
[6]Revathi A,Satish G,Kaskhedikar.Synthesis,antitubercular activity and QSAR analysis of substituted nitroaryl analogs chalcone,pyrazole,isoxazole,and pyrimidines[J].Med Chem Res,2013,22:3863~3880.
[7]吳琴,宋寶安,胡德禹,等.嘧啶類化合物的合成及抗菌活性研究進展[J].有機化學,2009,29(3):365~379.
[8]Sacchi A,Ablignente E,Rossi F,etal.Research on heterocyclic canpounds.lmidazo[1,2-a]pyrinidine 2-acetic derivatives synthesis and anti-inflanmatory activity[J].Eue J Med Chem,1997,32:677~682.
[9]Laneri S,Sacchi A,Rossi F,etal.Research on 2-Methylimidazo[1,2-a]pyrinidine-3-carboxylic derivatives synthesis and anti-inflanatory activity[J].Eue J Med Chem,1998,33:163~170.
[10]戚繁,周金培,丁一為,等.咪唑并[ 1,2-a ]嘧啶類化合物的合成和抗炎活性[J].中國藥科大學學報,2009,40(1):16~20.
[11]崔永濤,王建強,殷俊,等.以水作溶劑微波法合成 1,4-二氫苯并咪唑并[1,2-a]嘧啶類衍生物[J].應用化學,2010,27(1):53~57.
[12]阿布拉江·克依木.新型含三唑及噻唑環的腙類化合物的合成及生物活性研究[J].有機化學,2011,31(5):724~727.
[13]劉舉,薛其俊,王穎,等.新型咪唑并[ 1,2-a ]嘧啶類化合物的合成[J].合成化學,2016,21(6):679~682.
[14]Xue-Jie Fang,Ponmani Jeyakkumary,Srinivasa Rao Avula,etal.Design,synthesis and biological evaluation of 5- fluorouracil-derived benzimidazoles as novel type of potential antimicrobial agents[J].Bioorganic & Medicinal Chemis Try Letters,2016,26:2584~2588.
[15]李冀.QSPR/QSAR在有機物危險特性預測中的應用[D].長沙:中南大學,2012.
[16]覃禮堂,劉樹深,肖乾芬,等.QSAR模型內部和外部驗證方法綜述[J].環境化學,2013,32(7):2015~2010.
[17]Chirico N,Gramatica C.Real external predictivity of QSAR models:How to evaluate it comparison of different alidation criteria and the need for scatter plot inspectio[J].J Chem lnf Mode1,2012,52:2044~2058.
[18]Tropsha A,Gramatica P,Gombar V K.The importance of being earnest:Validation is the absolute essential for successful application and interpretation of QSPR models[J].QSAR Comb Sci,2003,22:69~77.
[編輯] 余文斌

