IVF助孕中卵母細胞成熟率對ICSI臨床結局的影響
付蕾,朱玉林,袁景川,周莉,劉俊山,羅紅,陶建芳,吳曉茜,孫梅
(石家莊市第四醫院,石家莊 050000)
在體外受精-胚胎移植(IVF-ET)或卵胞漿內單精子注射(ICSI)治療周期中,控制性促排卵(COH)使多個卵泡發育,目的是獲得適當的成熟卵母細胞(MⅡ卵母細胞),實際臨床工作中可能遇到卵母細胞成熟度不足或低下,直接關系到卵母細胞受精及胚胎發育,繼而導致可移植胚胎數目少或無,并可能影響臨床結局。因此尋找可能導致卵母細胞成熟度不足的因素,改善COH方案等可能有助于提高卵母細胞的質量及臨床妊娠率。本研究通過回顧性分析 2014年3月至 2015年4月在本院生殖中心接受 ICSI 治療的不孕患者 427例,探討 HCG日各種監測指標等對卵母細胞成熟度的預測價值,及卵母細胞成熟度對胚胎發育潛能及妊娠結局的影響。
資料與方法
一、研究對象
選取2014年3月至2015年4月在我院生殖中心行ICSI治療的不孕患者的臨床資料共427個周期。入選標準:(1)獲卵數≥6 個;(2)基礎血清卵泡刺激素(FSH)≤10 U/L;(3)不育原因為男性因素或伴有輸卵管功能障礙。排除標準為:反復種植失敗(既往 3 次及以上胚胎種植失敗者)。根據取卵日脫顆粒細胞后卵母細胞成熟度(MⅡ卵母細胞數與卵母細胞數的比例)分為 A、B、C 三組,A組為成熟度≥80%,283個周期;B組成熟度為60%~79%,124個周期;C組成熟度<60%,20個周期。
二、方法
1.促排卵方案:患者均采用黃體期長方案,于前一周期的黃體中期(月經第21天)注射促性腺激素釋放激素激動劑(注射用醋酸西曲瑞克,規格0.25 mg/支/次,Merck Serono,瑞士),皮下注射,每日1次,月經第5~6天開始注射;月經來潮達到降調標準后注射卵泡刺激素(FSH,5.5 μg(75 U)/支,默克雪蘭諾,瑞士)/人絕經期促性腺激素(HMG,75 U/支,麗珠制藥),月經第3天開始每日150 U~300 U,皮下注射;定期B超監測及血清LH、E2、孕酮(P)水平測定,根據卵泡生長情況,調整促性腺激素(Gn)劑量:當促排卵5~7 d卵泡發育不明顯時,每日增加1支75 U的HMG,肌肉注射。
2.取卵:當B超下顯示有1個卵泡直徑≥18 mm、或2個卵泡直徑≥17 mm或3個卵泡直徑≥16 mm時,于當日21:00肌肉注射重組人絨毛膜促性腺激素(艾澤,Merck Serono S.p.A.,意大利)250 μg,36 h左右后在陰道B超引導下取卵。將卵泡液中卵冠丘復合物(OCCCs)撿出,置于IVF-30液(Vitrolife,瑞士)中漂洗3~4次去除紅細胞,后移入含IVF-30液的卵母細胞培養皿中,置于5%~6% CO2培養箱預培養3~4 h,然后將OCCCs置于透明質酸酶中脫去周圍顆粒細胞,于倒置顯微鏡下觀察卵母細胞成熟狀態。卵母細胞的卵周間隙內見第一極體為MⅡ卵母細胞,其余為未成熟卵母細胞,包括MⅠ和 GV期卵母細胞。
3.ICSI及胚胎培養:HCG注射后 38~42 h將MⅡ期卵母細胞進行ICSI,次日晨觀察受精情況,是否出現原核及原核數,見到原核確定為受精,見到兩個原核(2PN)確定為正常受精。受精后43~45 h觀察卵裂情況,胚胎進一步發育為4~6細胞為正常卵裂,如停止發育為未卵裂。受精后 67~69 h再次觀察,如卵裂球數目≥5個,大小較均勻,碎片比例<20%的胚胎為可移植胚胎。如卵裂球數目為8~10個,大小均勻,碎片比例<5%的胚胎為優質胚胎。
4.胚胎移植:移植后14 d檢查血清HCG,4~5周后陰道B超檢,見查宮內胎囊及胎心搏動為臨床妊娠。臨床妊娠率=臨床妊娠周期數/移植周期數×100%;累積臨床妊娠率=新鮮周期胚胎移植和凍融胚胎移植后獲得臨床妊娠的周期數/總取卵周期數×100%。
三、統計學方法

結 果
一、臨床資料
在427個周期中,A組、B組、C 組分別占 66.28%、29.04%、4.68%。三組的年齡、不育年限、基礎FSH和AMH水平均無統計學差異P>0.05。A組、B組Gn天數及用量少于C組,差異有統計學意義(P<0.05)(表1)。
二、三組患者HCG日激素水平
HCG日血清E2:A組>B組>C組,兩兩比較有統計學差異(P<0.05)。HCG日血清LH、P,三組間無統計學差異(P>0.05)。每成熟卵母細胞E2水平(血清E2/≥14 mm卵泡數):三組間無統計學差異(P>0.05)。每卵母細胞E2水平(血清E2/獲卵數):三組間無統計學差異(P>0.05)(表2)。
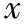
表1 三組患者一般情況比較(-±s)
注:與A組、B組比較,*P<0.05

表2 三組患者HCG日激素水平比較
注:與B組比較,*P<0.05;與C組比較,#P<0.05
三、三組患者獲卵情況
成熟卵泡數、獲卵數、MⅡ卵數:A組>B組>C組,兩兩比較有統計學差異(P<0.05)。獲卵率(獲卵數/≥14 mm卵泡數):A組大于B組和C組,差異有統計學意義(P<0.05),B組、C組比較獲卵率無統計學差異(P>0.05)。≥18 mm卵泡數/≥14 mm卵泡數:C組>A組和B組,差異無統計學意義(P>0.05)(表3)。
四、三組患者胚胎發育及臨床結局情況
正常受精率(2PN數/MⅡ卵數):A組大于B組和C組,有統計學差異(P<0.05),B組、C組卵裂率無統計學差異(P>0.05)。卵裂率(2PN卵裂數/2PN數):A組大于B組和C組,有統計學差異(P<0.05),B組、C組卵裂率無統計學差異(P>0.05)。可移植胚胎率(可移植胚胎數/卵裂數):三組間無統計學差異(P>0.05)。優胚率(優質胚胎數/可移植胚胎數):A組大于B組和C組,有統計學差異(P<0.05),A組、B組優胚率無統計學差異(P>0.05)。累積妊娠率:A組和B組大于C組,有統計學差異(P<0.05),A組、B組累積妊娠率無統計學差異(P>0.05)。中重度卵巢過度刺激綜合征(OHSS)發生率:三組間無統計學差異(P>0.05)(表4)。
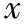
表3 三組患者獲卵情況比較[(-±s),%]
注:與B組比較,*P<0.05;與C組比較,#P<0.05

表4 三組患者胚胎發育及臨床結局的比較(%)
注:與B組比較,*P<0.05;與C組比較,#P<0.05
討 論
在COH過程中,對于卵巢儲備功能正常的患者通常采用黃體期長方案,可抑制早發LH峰,有利于提高卵泡發育的同步性。本研究所選對象均為長方案。隨著卵母細胞成熟度的增加,三組患者≥14 mm卵泡數、獲卵數、成熟卵數增加,A組分別為16.12,16.04,14.31;B組分別為14.80,14.25,10.35;C組分別為11.50,10.95,5.70;C組的Gn天數[(13.65±3.08)d vs.(12.46±2.27)d、(12.23±1.78)d]、Gn用量[(3 365.00±1 125.930)U vs.(2 113.96±976.55)U、(2 779.23±1 098.21)U]均顯著高于A組、B組。提示Gn用藥時間長、Gn用量較大而成熟卵數及獲卵數相對少(<10個)的患者易發生卵母細胞成熟度不足。李莉等[1]的研究也顯示HCG日≥14 mm卵泡數和獲卵數少于10個應警惕發生卵母細胞成熟度低下。
在自然周期中,單個優勢卵泡的發育,可使血清 E2水平達到1 098 pmol/L左右,在COH中,外源性Gn刺激多卵泡同時發育,繼而產生相應倍數的血清E2[2]。HCG注射日高水平的E2,與獲卵數有直接關系[3]。三組患者隨著成熟卵泡數、獲卵數及成熟卵數的增加,血清E2也相應增加,但三組每成熟卵泡E2水平、每獲卵數E2水平無統計學差異。三組中HCG日>18 mm占成熟卵泡的比例,C組(47.82%)較A(43.87%)、B(44.12%)兩組高,但差異無統計學意義,說明三組注射HCG的標準較一致。原因可能為:(1)與促排卵過程有關,如垂體-卵巢軸過度抑制導致卵巢對Gn的敏感性下降,卵巢反應低下,卵泡發育不均,Gn用量增加,卵母細胞質量下降。(2)HCG注射時機:如時間太早,顆粒細胞的LH受體不足,對HCG反應不足,導致卵丘小且緊附卵泡壁,不易抽吸,回收卵母細胞少,且所獲卵大多是不成熟卵母細胞,受精率降低,也可促使卵泡閉鎖。若注射 HCG太遲,卵泡過熟,成熟卵泡內卵母細胞丟失,小卵泡內獲得未成熟卵。(3)可能是由于卵巢反應不良或多囊卵巢綜合征(PCOS) 引起。Sachs等[4]的研究認為高反應的患者易產生較多的未成熟卵。C組可能為卵巢反應不良或對Gn敏感性下降,卵泡發育不均,HCG注射日大部分為中小卵泡,獲卵數及成熟卵數低,若推遲HCG時間,可能導致Gn用量的增加,并可能增加OHSS的風險。
本研究A組的2PN受精率(86.55% vs.78.19% vs.79.82%)、卵裂率(99.17% vs.97.91% vs.95.60%)顯著高于B、C組;A組、B組的優胚率(48.03% vs.44.58% vs.39.62%)顯著高于C組,雖然A組>B組,但差異無統計學意義。囊胚形成率:A組>B組>C組,但差異無統計學意義,說明卵母細胞成熟度是影響胚胎發育潛能的主要因素之一。夏蘭等[5]的研究顯示MⅡ卵母細胞數與HCG日14 mm以上卵泡數的比率≤50%,成熟度降低,受精率及優胚率均降低;蔣益群等[6]也認為ICSI 周期中,未成熟卵母細胞比例過高(≥50%)可能影響胚胎的發育潛能及臨床結局。優質的卵母細胞是細胞核和細胞質的同步成熟。只有胞核和胞質同步成熟的卵母細胞才具備良好的受精及胚胎發育的潛能[7]。生發泡的破裂及第一極體排出只代表卵母細胞核的成熟,而細胞質未必成熟,Combelles等[8]認為,胞質的成熟創造了良好的代謝環境,蛋白質磷酸化和去磷酸化的完成以及細胞器的結構重組和重新分布,提供卵母細胞所需能量,使卵母細胞正常受精、卵裂及囊胚形成。另外卵母細胞在前三個細胞周期的合成代謝也是由貯存于細胞質中的 RNA及蛋白質完成的,所以胞質的成熟是受精及胚胎發育的一個重要因素。在胞質未成熟時過早授精,可能影響受精及胚胎發育。A組、B組的累積妊娠率高于C組(51.59%、48.38% vs.35.00%),差異有統計學意義;雖然A組>B組,但差異無統計學意義。原因可能為A、B兩組有較多的可移植的胚胎,可供多次凍融胚胎移植,而C組可供移植的胚胎數少。卵泡發育的整個過程都受到促排卵藥物的影響,大劑量Gn可能對卵母細胞減數分裂、發育潛能和表觀遺傳修飾有影響。Meng等[9]的研究顯示COH過程會降低小鼠卵母細胞水通道蛋白3的表達以及胚胎的發育潛能。
足夠且優質的卵母細胞是IVF成功的基礎。Gn用量較多且HCG日≥14 mm卵泡數和獲卵數少于10個的患者易發生卵母細胞成熟度不足,可能影響受精及發育潛能,將導致可供移植的胚胎數減少,影響妊娠率[9-11]。調整促排卵藥物及用量或改變促排卵方案可能改善部分患者的卵母細胞成熟度[12]。對于卵巢反應不良及卵巢低反應的患者,可采用 IVF+未成熟卵體外培養(IVM)[13-14],充分利用優勢卵泡和小卵泡中的卵母細胞,李建華等[15]于 2013年報道了行自然周期成熟卵和IVM獲得的胚胎經凍融435例,妊娠率達 38.2%;對于PCOS患者,通過 IVM 方式增加獲卵數和避免OHSS風險。許薇等[16]于 2010年報道了170例PCOS、PCO等患者行IVM的妊娠結局,妊娠率 21.12%,流產率41.67%,更好的培養環境是IVM良好妊娠結局的保證。
本研究以本生殖中心行ICSI 治療的427例不孕患者為研究對象,探究影響HCG日卵母細胞成熟度的臨床因素,及卵母細胞成熟度對胚胎發育潛能及妊娠結局的影響。結果提示年齡、不育年限、HCG日血清LH、P、成熟卵母細胞E2水平、卵母細胞E2水平等因素無統計學差異;成熟卵泡數、獲卵數、MⅡ卵數、正常受精率、卵裂率、優胚率、累積妊娠率等因素有統計學意義(P<0.05)。可見,卵母細胞成熟度與胚胎質量存在密切關系,并且卵母細胞成熟率低可能與卵巢反應不良或對Gn敏感性下降有關。因此,卵母細胞成熟率低可能影響受精及胚胎發育潛能,導致可供移植的胚胎數減少,從而影響妊娠率。
[1] 李莉,劉見橋,杜紅姿,等.應用HCG日激素水平預判卵母細胞成熟度[J].中國婦幼保健,2015,30:2590-2592.
[2] Horikawa T,Nakagawa K,Ohgi S,et al.The frequency of ovulation from the affected ovary decreases following laparoscopic cystectomy in infertile women with unilateral endometrioma during a natural cycle[J].J Assist Reprod Genet,2008,25:239-244.
[3] Valbuena D,Martin J,de Pablo JL,et al.Increasing levels of estradiol are deleterious to embryonic implantation because they directly affect the embryo[J].Fertil Steril,2001,76:962-968.
[4] Sachs AR,Politch JA,Jackson KV,et al.Factors associated with the formation of triploid zygotes after intracytoplasmic sperm injection[J].Fertil steril,2000,73:1109-1114.
[5] 夏蘭,徐步芳,趙甡,等.MⅡ卵子數與人絨毛膜促性腺激素注射日14 mm以上卵泡數比率對卵胞漿內單精子顯微注射結局的影響[J].中華臨床醫師雜志(電子版),2016,10:1368-1372.
[6] 蔣益群,王珊珊,張寧媛,等.ICSI周期卵子成熟度對胚胎發育與臨床結局的影響[J].中國性科學,2015,24:84-87.
[7] Andersson U,Filipsson K,Abbott CR,et al.AMP-activated protein kinase plays a role in the control of food intake[J].J Biol Chem,2004,279:12005-12008.
[8] Combelles CM,Cekleniak NA,Racowsky C,et al.Assessment of nuclear and cytoplasmic maturation in in-vitro matured human oocytes[J].Hum Reprod,2002,17:1006-1016.
[9] Meng QX,Gao HJ,Xu CM,et al.Reduced expression and function of aquaporin-3 in mouse metaphase-II oocytes induced by controlled ovarian hyperstimulation were associated with subsequent low fertilization rate[J].Cell Physiol Biochem,2008,21:123-128.
[10] 周瑤,倪郝,譚穎,等.IVF/ICSI周期中HCG日血清孕酮水平與獲卵數的關系及對妊娠結局的影響[J].實用醫學雜志,2013,29:1581-1584.
[11] 吳惠華,孟慶霞,鄒琴燕,等.長方案及拮抗劑方案中HCG日孕酮水平對IVF-ET妊娠結局的影響[J].生殖醫學雜志,2017,26:24-28.
[12] 江勝芳,張昌軍,徐鴻毅,等.人絨毛膜促性腺激素注射日血清孕酮水平升高預測體外受精-胚胎移植妊娠率降低[J].生殖醫學雜志,2014,23:285-291.
[13] 劉娟,曾玉燕,王小云,等.HCG日孕酮水平與體外受精-胚胎移植治療結局的關系探討[J].暨南大學學報(自然科學與醫學版),2017,38:167-171.
[14] 劉亞瓊,李元,蔡素芬,等.HCG注射前雌二醇水平下降是否影響PCOS患者IVF/ICSI結局?[J].生殖醫學雜志,2016,25:123-128.
[15] 李建華,郭軍紅,徐野.自然周期IVF/IVM技術取卵時有無成熟卵母細胞獲得對臨床結局的影響[J].中國優生與遺傳雜志,2013,21:116-119.
[16] 許薇,李志強,翁寧.未成熟卵體外培養的妊娠結局分析[J].中國優生與遺傳雜志,2010,18:100.

