生物活性玻璃的研究現狀及發展趨勢
馬安博
(西安航空職業技術學院,陜西 西安 710089)
生物活性玻璃是一類重要的無機非金屬類骨、齒及皮膚創面修復材料,在臨床應用中取得較好的治療效果。近年來,學者們主要研究了微納米生物活性玻璃(MNBG)的制備技術、結構、性能、材料與細胞的相互作用及其組織修復特性。細胞學研究表明,生物活性玻璃的促進成骨是通過激活P38和ERK 2條信號通路實現介導骨髓間充質干細胞(MSC)向成骨細胞定向分化而實現的[1]。動物實驗研究表明,微納米生物活性玻璃具有顯著的異位成骨特性,其機制是通過玻璃顆粒中Si、Ca離子的釋放,促進了骨祖細胞向成骨細胞分化,從而加速了新骨形成[2]。然而,生物活性玻璃的力學性能,可梯度降解性能和孔結構等問題在一定程度上影響了生物玻璃醫療器械的臨床治療效果。因此,克服生物活性玻璃的不足,進一步改善和提高生物活性玻璃材料的各項性質,將成為材料科學、生物科學及醫學等交叉學科的研究熱點[3]。
1 生物活性玻璃的研究現狀
繼Hench教授研制開發出45S5生物玻璃之后,又有多種生物活性微晶玻璃不斷被研制開發出來。1973年,德國Bromer等[4]通過大幅度減少部分堿金屬氧化物的含量,即減少鉀、鈉含量,增加鈣、磷含量并應用玻璃的微晶技術,成功制備了Na2O -K2O-MgO-CaOP2O5- SiO2系統的微晶生物玻璃,主晶相為碳酸磷灰石。其生物活性低于45S5玻璃,但其機械性能卻有了較大的提高,可以應用于受力不明顯的骨缺損填充,如頜骨的修補,也可作為骨水泥材料應用于臨床上。由Hench教授開發的45S5生物玻璃中,K、Na含量較高,因而化學穩定性欠佳,從而影響其長期耐久性,且強度較低,應用受到限制。1982年,日本京都大學的小久保正等[5]通過熱處理MgO-CaO-SiO2- P2O5- CaF2玻璃制出了高強度的生物微晶玻璃(A-W微晶玻璃),其玻璃基質中含有晶相磷灰石和β-硅灰石。因不含堿金屬氧化物,所以其機械性能較好,是當前力學性能相對最好的醫用微晶玻璃材料,各項力學性能均接近人骨,此外,其與骨骼組織的結合強度也較高。
為滿足臨床使用的需要,生物材料必須被加工成一定形狀,這就要求生物材料具有良好的可加工性。1983年,Holland等[6]研制成功了商品名為Bioverit的可切削生物微晶玻璃,其主晶相是磷灰石和金云母晶體。這類微晶生物玻璃的特點是既具有一定的生物活性又具有較好的可切削加工性,并可根據臨床需要和一般的機械加工方法制成各種不同形狀,材料不會發生斷裂。此外,近年來生物材料領域的研究者們相繼研制出磷酸鹽多孔微晶玻璃、鐵磁玻璃陶瓷和含生物玻璃相的復合生物材料等一系列特定性能的生物活性玻璃。生物活性玻璃作為人工醫學材料已得到廣泛研究和臨床應用,越來越顯示出惰性生物材料所不能比擬的優勢[7]。
2 生物活性玻璃的制備
與傳統玻璃制備工藝一樣,最早的生物玻璃和微晶玻璃都是通過熔融法制備的。隨著溶膠-凝膠技術的發展,該方法被引用到生物玻璃的制備中來,這種生物玻璃由于具有較高的比表面積,因而顯示出了較高的生物活性。
2.1 熔融法
熔融法是制備生物玻璃最常用的方法之一,采用該方法制備的生物玻璃密實無孔、比表面積較小。
熔融法的一般制備工藝是將原料混合均勻后,在千攝氏度以上的高溫下熔融成玻璃液,保溫一段時間后淬冷,制成產品。熔融法制備工藝簡單、易于大規模生產,但是通過熔融法制得的生物玻璃,其組成范圍和生物活性都受到一定的局限,因為高溫容易使配料中的磷等元素揮發、使其成分的控制難以精確,而且玻璃的高溫熔制容易導致Si-OH官能團的減少,且得到的生物材料中Ca2+的溶解性能相對較低,這些因素都會降低材料的生物活性。另外制備反應溫度也比較高,能耗較大。
2.2 溶膠-凝膠法
熔融法制備的生物活性玻璃成功用于各種臨床應用已有10多年,但由于熔融法的局限性,人們研究開發了SiO2-CaO-P2O5溶膠-凝膠生物活性玻璃。
生物玻璃系統的前驅體主要是正硅酸乙脂(TEOS)、四水硝酸鈣和磷酸三乙脂(TEP)。用鹽酸或硝酸催化TEOS和TEP進行水解,通常H2O與醇鹽的比值(R值)為物質的量比;所有反應物都加入后,充分攪拌,經過充分水解后得到均勻的溶膠;凝膠后陳化一段時間,最后在150 ℃下干燥;干凝膠經過研磨和過篩,得到的粉體經過壓制和燒結就可得到所需的塊體材料。制備步驟如圖1所示。
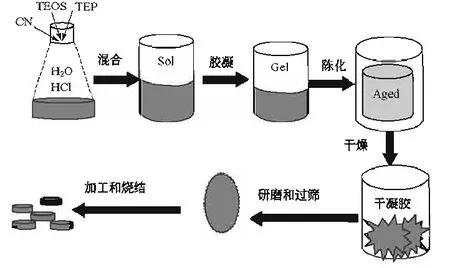
圖1 溶膠-凝膠法制備生物活性玻璃的示意圖Fig.1 Preparation of bioactive glass by sol-gel method
溶膠-凝膠生物活性玻璃具有納米結構,是由納米微球組成的(如圖2所示),并含有大量5~100 nm的孔,其比表面積是熔融法所制備生物玻璃的上萬倍,更大的比表面積能為無定形磷酸鈣的形成提供更多的Si-OH成核空間,因而其降解速度和表面形成HCA層的速度也更快,具有更高的生物活性[8]。

圖2 溶膠-凝膠法制備的58S生物活性玻璃的SEM圖Fig.2 SEM image of 58S bioactive glass prepared by sol-gel method
溶膠-凝膠法作為一種濕化學合成方法,因其優越的性能,已受到越來越多的關注。將溶膠-凝膠技術與模板合成技術相結合,在大分子物質的調制下,合成出具有高生物活性的、可調控降解特性的以及組織細胞相容性的新型微納米溶膠-凝膠生物玻璃粉體(球形、放射狀、棒狀和微囊)和纖維(如圖3所示),為溶膠-凝膠生物活性玻璃及其有機/無機復合材料骨齒科修復體的制備提供基本原料[9]。

圖3 新型微納米生物活性玻璃的結構形態控制Fig.3 Morphological control of new micro-nano bioactive glass structures
2.3 溶膠-凝膠自蔓延法
在溶膠-凝膠法的基礎上,將自蔓延高溫合成(SHS)法引入到生物玻璃的制備中,可在短時間內獲得成分均勻的超細生物玻璃前驅粉[10]。將SHS法和溶膠-凝膠法結合起來,先借助溶膠-凝膠法制得成分均勻的濕凝膠以實現成分均勻性,然后將濕凝膠與有機燃料相混合,點火發生劇烈燃燒得到粉末以實現超細化。濕凝膠已經是溶膠顆粒的聚集體,與燃料混合時不會破壞凝膠所具有的成分均勻性。該方法綜合了SHS法和溶膠-凝膠法的優點,制得的粉末粒徑范圍較窄,平均粒徑較小(約為200 nm),且具有優良的壓制性能。
3 生物活性玻璃的應用
從1985年開始,生物活性玻璃大量應用于臨床。生物活性玻璃最早在日本發展并廣泛應用于不同領域,如脊椎連接、自體移植后髂骨頂的重建以及整形外科手術中多重骨缺損的填充。生物活性玻璃的第一例臨床成功應用的是用來修復中耳骨,以治療傳導性聽力損傷。生物活性玻璃被用來維持拔牙后牙槽晴的高度,粒狀生物活性玻璃還被用作大型頜骨缺損修復和治療由齒根膜疾病引發的骨損傷。
生物活性玻璃和生物微晶玻璃因其優異的生物活性、組分和性能可設計性而引起廣泛關注,生物玻璃的應用領域也因而在不斷擴展。目前,生物玻璃用于生物組織和器官損傷的修復及癌癥的治療受到了人們的極大關注,生物玻璃在齒科材料、組織工程支架、藥物載體及癌癥治療等領域具有廣闊的應用前景[11]。
3.1 口腔科材料
生物玻璃的早期應用主要是在口腔方面,如用于下頜骨置換、牙槽嵴增高、牙周病治療、根管充填、蓋髓、拔牙窩充填、預防牙槽萎縮和骨腔充填等。
當前,生物玻璃在口腔科的應用研究得到了迅速發展,主要有以下幾大方面。
(1)牙周病治療。如何使由于炎癥性牙周病導致的骨喪失重新再生,仍然是牙周病治療的難題。目前的方法包括自體骨移值、異體骨移植、異源體移植、引導組織再生(GTR)或GTR與脫礦凍干骨結合使用等,但都有一定的缺陷性。由于生物玻璃獨特的成骨特性,可用于牙周病的治療。
(2)作為護牙劑成分。生物活性玻璃糊劑對口腔微生物有作用。實驗發現,生物玻璃可使內氏放線菌在10 min內喪失活力,放線共生放線桿菌、牙眼類桿菌和變鏈菌等在60 min內喪失活力,血鏈球菌在60 min較顯著喪失活力。在水溶液中,生物活性玻璃對齦上齦下菌斑有著廣譜抗菌作用。因此,無論在防齦還是預防牙周病方面,生物玻璃有著廣泛的應用前景。
3.2 人工骨材料
具有人工骨材料與生物體的親和性和對生物組織無害的生物功能之新型玻璃已經用于人工骨和人工牙。在生物玻璃用于狗肋骨擴增手術中發現,使用生物活性玻璃時,骨修復的速度甚至比使用同量自體骨還要快。作為部分或全部聽骨鏈的主要置換材料,生物玻璃已有十幾年的臨床應用歷史,臨床成功率高達90%。中耳骨是生物玻璃應用相對最早的產品,移植在人耳中,特別是輔以一些微電子設備,能使某些耳聾病人恢復不同程度的聽力。
3.3 藥物治療載體和癌癥治療方面的應用
生物活性玻璃具有合適的孔隙,良好的生物相容性,適度的降解率,作為BMP(骨形態發生蛋白)的載體材料,在骨修復中可使BMP在局部長時間內有效發揮誘導作用,并且能使BMP在載體的作用下大范圍內起誘導修復作用;此外,生物活性玻璃還可作抗生素或抗骨腫瘤藥物的載體用于骨腫瘤切除后的缺損處或骨髓炎的死腔中,既可以避免全身用藥可能帶來的副作用,又可以在填補缺損的同時在局部持續、緩慢而有效地發揮抗菌或抗腫瘤作用,作為與手術相輔的療法,綜合提高療效。
將生物玻璃材料埋入腫瘤附近,對癌細胞進行直接放射或熱處理,只殺死癌細胞而又不損傷正常組織。Luderer等[12]在Al2O3-SiO2- P2O5玻璃基質中摻加鐵酸鋰,使其成為鐵磁玻璃陶瓷,并作為熱種子用于癌癥的熱療。在CaO-SiO2為基質的玻璃陶瓷中摻加Fe3O4,用其形成的生物活性鐵磁陶瓷對癌細胞進行熱療,發現其對骨癌細胞有效。
3.4 在臨床上的應用
尿失禁病人因膀胱尿出口敞開而失控,生物玻璃與某些生物液混合配制成注射液,注射在膀胱出口周圍,使其收縮,可使尿失禁得到控制。隨著生物玻璃材料強韌化程度的提高,生物玻璃也可用于外科和整形外科方面疾病的治療,如AW微晶玻璃已經作為人工錐間墊、腸骨墊等使用,可切削生物活性微晶玻璃在整形外科方面用于隆鼻、頜增高和畸形頜整復等;也可用于五官科,作為人工喉管支架、眼睛晶狀體修復等。
4 復合生物活性玻璃
4.1 與高聚物復合的生物活性玻璃
佛羅里達大學對聚礬和生物玻璃復合材料進行了研究,這種復合材料的分散相可通過研磨等方法使之顯露出生物活性表面,以利于人工修復骨材與人骨鍵合。對生物玻璃和聚甲基丙烯酸甲酯(PMMA)等有機骨水泥及與可用于人體的材料如高密度聚乙烯(HDPE)的復合,這方面的研究報道較多,其復合材料表面也有羥基磷灰石析出。有的復合樹脂牙中玻璃的加入量甚至可達92%(質量分數)。
4.2 與合金復合的生物活性玻璃
由于合金具有自身的優勢,仍被廣泛用作醫用材料。通過等離子噴涂等方法在金屬合金表面涂覆具有生物活性的羥基磷灰石或生物玻璃等涂層材料,是改善醫用合金的生物活性和相容性的有效手段,也是近幾年來生物醫學材料領域中研究的熱點之一。但臨床應用發現,這類材料植入人體后,涂層會從合金表面剝落,使基體金屬與人體之間的結合強度急劇下降。主要是涂層與金屬之間的結合強度較低、涂層內應力較高、涂層不致密、涂層過薄和化學穩定性不佳等原因。為提高化學穩定性,可在合金基體和涂層間引入一層生物玻璃,這樣,其化學性質就比較穩定,能夠形成致密的過渡層。
4.3 與纖維復合的生物活性玻璃
生物玻璃與纖維復合后,可改善材料的韌性。Kasuga等[13]采用多階段處理工藝得到了高強度的磷酸鹽微晶玻璃和β-Ca(PO3)2纖維復合材料。對碳纖維增強微晶玻璃的研究表明:碳纖維的加入,不僅改變了裂紋的擴展方向,而且吸收裂紋擴展過程中會產生能量,使得復合材料的KIC和抗彎強度大大提高,但生物活性并沒有降低。近期研究顯示,應用生物活性纖維作為第2相的一部分,很可能制備出與人骨彈性模量一樣的各向異性之生物復合材料。
4.4 與氧化鋯復合的生物活性玻璃
在生物玻璃中引入ZrO2的目的是獲得較高強度的生物材料。對于(42%~59%)SiO2-( 7%~ 15%) LiO2-( 4%~ 5%) P2O5-( 15%~28%)ZrO2(質量分數)系統的微晶玻璃而言,其主晶相為Li3P O4和 不同晶型的ZrO2;較高質量分數的ZrO2(20%)和P2O5(10%)使生物玻璃有較好的力學性能。
5 生物活性玻璃研發趨勢
目前有關生物活性玻璃的臨床應用還不夠廣泛,不能完全滿足實際應用的需求,對其研究還不夠徹底。主要有以下幾點:①生物活性玻璃含有的硅成分在體內不能完全降解并且其代謝機理尚不清楚,最終不能完全轉化成人體骨組織成分;②生物活性玻璃的機械強度較低,脆性較大,尤其是抗彎強度較差,嚴重限制了其應用范圍;③生物活性玻璃對細胞的調節機制尚不完全明確。
生物活性玻璃作為理想的人工醫學材料已得到廣泛研究和臨床應用,越來越顯示出惰性生物材料所不能比擬的優勢。生物玻璃今后的主要研究方向:①生物活性玻璃需要高溫燒結成型,這樣有些材料的活性不免會受到影響而大大降低,因此在制備工藝上需尋求低溫合成路線,如溶膠-凝膠法、液相反應等技術;②生物活性玻璃像普通玻璃一樣存在力學弱點,即脆性較大,因而限制了其應用范圍,增強、增韌將是重要的研究方向;③可降解生物微晶玻璃、調控降解速度并激活成骨細胞基因的生物玻璃、仿人工骨和齒的生物玻璃的復合材料、高強度加工的微晶玻璃、酶載體微孔玻璃以及生物芯片玻璃等材料將成為重點研究對象。
6 結語
近年來,研究人員對生物活性玻璃材料不斷進行了改進,制備出了納米級的微孔生物材料和有機/無機復合材料,以有機改性無機的生物材料是生物玻璃材料的今后發展方向。若在增韌方面取得應用性的進步,使其可以任意塑性,既具備機械強度又具有力學韌性,必能極大地改善臨床上的不足現狀。隨著研究工作地不斷深入,對于生物玻璃的各項性能的改進必將取得更大地進步。
[1]倪衛東.生物活性玻璃陶瓷涂層與Hedgehog信號通路調控成骨[J].中國組織工程研究,2016,20(43):6424-6430.
[2]李學偉.生物活性玻璃在口腔醫學中的應用[J].口腔生物醫學,2004,4(1):4-46.
[3]唐倩.溶膠-凝膠法制備的生物活性玻璃的研究進展[J].國際口腔醫學雜志,2006,33(4):275-277.
[4]王德平.玻璃基生物醫用材料的研究進展[J].材料導報,2002,16(5):36-38.
[5]小久保正.應用固體化學分野[J].生體材料,2002,20(1):27-28.
[6]曹月明.低溫燒結生物微晶玻璃的研究[J].河北聯合大學,2015,23(6):70-75.
[7]楊小東.生物活性玻璃陶瓷人工骨的研究取得重要進展[J].華西口腔醫學雜志,1986,(4):42.
[8]苗鴻雁.溶膠-凝膠法制備生物微晶玻璃的研究進展[J].材料導報,2006,20(1):54-56.
[9]丁峰,李楠,李永生,等.介孔生物玻璃/磷酸鈣骨水泥多級孔復合支架的制備及其載藥特性研究[J].無機材料學報,2013,28(1):97-102.
[10]梁艷峰.自蔓延高溫合成法(SHS)制備SiC顆粒[J].特種鑄造及有色合金,2011,31(1):73-75.
[1 1]Xia W,Chang J.Pre parationand characterization of nano-bioactive-glasses(NBG) by a quick alkali-mediated sol-gel method [J].Materials Letters,2007,61(14):3251-3253.
[12]周智華.生物玻璃及其復合材料的研究進展[J].化學通報,2005,68(1):1-10.
[13]Xiao Z,Adam B L,Cazares L H,et al.Quantitation of serum prostate-specific membrane antigen by a novel protein biochip immunoassay discriminates benign from malignant prostate disease[J].Cancer Research,61(16):6029-6033.

