酶解輔助乙醇提取 牡丹果皮木犀草素的研究
陳 剛,楊玉珍,張 敏,羅 青,王國霞
(鄭州師范學院,河南鄭州 450044)
牡丹籽油在2011年被認定為新資源食品,“鳳丹”牡丹(Paeoniasuffruticosa“Feng Dan”)是榨取牡丹籽油常用的品種之一,隨著牡丹籽油的急性肝損傷保護作用[1],抗糖尿病活性[2],降血脂、降血糖作用[3-4],防曬[5]等保健功能[6-8]逐漸被人們重視,其種植面積也將逐年擴大,同時也將產生大量的果皮,因此為果皮資源的再利用提供技術支持是非常迫切的。木犀草素為黃酮類化合物,具有抗氧化[9]、抗菌[10]、抗腫瘤[11]、抗炎[12]等生物活性。目前有學者[13]研究了牡丹種皮木犀草素的提取工藝,但牡丹果皮中木犀草素的提取研究尚未見報道,本文研究牡丹果皮木犀草素的提取工藝,可為油用牡丹果皮資源的再利用提供技術支持。
1 材料與方法
1.1 材料與儀器
“鳳丹”牡丹果皮 2016年8月采收的五年生實生苗“鳳丹”牡丹果皮置于室內陰干備用;木犀草素對照品 上海源葉生物科技有限公司;果膠酶(酶活力500 U·g-1) Sigma公司;纖維素酶(酶活力10000 U·g-1) 南京都萊生物技術有限公司;無水乙醇、乙酸、乙酸鈉、鉬酸銨 均為分析純。
JA3003N電子天平 上海菁海儀器有限公司;PHSJ-5實驗室pH計 上海精科;MINID實驗室超純水器 河南森空儀器設備有限公司;TGL16M冷凍離心機 湖南湘立科學儀器設備有限公司;TH-250B型數控超聲波清洗機 濟寧天華超聲電子儀器有限公司;DHG-9140電熱鼓風干燥箱 上海一恒科學儀器有限公司;HH-S4型數顯恒溫水浴鍋 邢臺市潤聯機械設備有限公司;CT410粉碎機 蘇州安創儀器有限公司;FCD-270SE電冰柜 青島海爾特種電冰柜有限公司;T6型紫外可見分光光度計 北京普析通用儀器有限責任公司。
1.2 實驗方法
1.2.1 乙醇提取工藝單因素實驗與正交實驗
1.2.1.1 乙醇提取工藝單因素實驗 取牡丹果皮,洗凈,在55 ℃的干燥箱干燥8 h后用粉碎機制粉,將過100目篩后的粉末存放于磨砂的廣口瓶密封,置于4 ℃冰箱中備用。
分別取1 g牡丹果皮粉末,按照10∶1的液料比分別加入60%、65%、70%、75%、80%的乙醇溶液搖勻,靜置提取30 min,在10000 r·min-1、4 ℃離心10 min,取出上清液,再按相同比例向殘渣中加入乙醇溶液,搖勻并再次靜置相同時間,在相同離心條件下離心,取出上清液,合并上清液,考察乙醇體積分數對木犀草素得率的影響。
分別取1 g牡丹果皮粉末,按照10∶1的液料比加入65%的乙醇溶液搖勻靜置浸泡提取20、25、30、35、40 min,其它操作同上,考察靜置浸泡時間對木犀草素得率的影響。
分別取1 g牡丹果皮粉末,按液料比6∶1、8∶1、10∶1、12∶1、14∶1 (mL·g-1)加入65%的乙醇溶液搖勻,靜置提取30 min,其它操作同上,考察液料比對木犀草素得率的影響。
分別取1 g牡丹果皮粉末,按照10∶1的液料比加入65%的乙醇溶液,搖勻靜置提取30 min,在10000 r·min-1、4 ℃離心10 min,取出上清液。按相同操作提取1、2、3、4、5次,考察提取次數對木犀草素得率的影響;以上實驗均重復三次。
1.2.1.2 乙醇提取工藝正交實驗 在上述單因素實驗基礎上,利用L9(34)正交實驗,對乙醇體積分數、液料比、浸泡時間及提取次數這四個因素的條件進行優化,方案如表1所示。

表1 乙醇提取木犀草素正交實驗因素和水平Table 1 The orthogonal test factors and levels of ethanol extracttion of luteolin
1.2.2 酶解輔助乙醇提取工藝單因素實驗與正交實驗
1.2.2.1 酶解輔助乙醇提取工藝單因素實驗 分別取10份1 g牡丹果皮粉末置于試管中,加入pH4.0的酶緩沖液5 mL(分別為0.05、0.10、0.15、0.20、0.25 g·L-1的纖維素酶,0.05、0.10、0.15、0.20、0.25 g·L-1的果膠酶)搖勻后于50 ℃水浴保溫120 min。再以90 ℃水浴滅活5 min,按照優化的乙醇提取條件提取,測得木犀草素得率,考察不同的酶種類及酶濃度對木犀草素得率的影響。
分別取1 g牡丹果皮粉末,加入pH4.0的0.10 g·L-1的果膠酶緩沖液5 mL,搖勻后于50 ℃水浴保溫80、100、120、140、160 min,其他操作同上,考察水浴時間對木犀草素得率的影響。
分別取1 g牡丹果皮粉末,加入pH3.5、4.0、4.5、5.0、5.5的0.10 g·L-1的果膠酶緩沖液5 mL,搖勻后50 ℃水浴保溫120 min,其他操作同上,考察pH對木犀草素得率的影響。
分別取1 g牡丹果皮粉末,加入含有pH4.0的0.10 g·L-1的果膠酶緩沖液5 mL,搖勻后在40、45、50、55、60 ℃水浴保溫120 min,其他操作同上,考察水浴溫度對木犀草素得率的影響;以上實驗均重復三次。
1.2.2.2 酶解輔助乙醇提取工藝正交實驗 在上述的單因素實驗基礎上,利用L9(34)進行正交實驗,對酶濃度、水浴時間、水浴溫度和pH四個因素的條件進行優化,設計方案如表2所示。

表2 酶解輔助乙醇提取木犀草素正交實驗因素和水平Table 2 The orthogonal test factors and levels of enzyme assisted ethanol extraction of luteolin
1.2.3 木犀草素得率的測定 參考文獻[14]的方法,有改進。以4.00 g·L-1的鉬酸銨溶液為對照品,分別配制濃度為0.0040、0.0056、0.0072、0.0088、0.0104、0.0120、0.0136 mg·mL-1的木犀草素標準使用液,在360 nm處測定吸光度,得出線性回歸方程。
準確量取提取液1 mL用鉬酸鹽分光光度法[14]測定吸光度,將結果代入制作好的木犀草素標準曲線方程,根據公式計算結果。
木犀草素得率的計算公式如下:
式中,C為根據測得的吸光度和標準曲線方程計算出的樣品中木犀草素濃度(mg·mL-1),V為提取的上清液體積(mL),K為稀釋倍數,m為果皮粉末質量(g)。
1.3 數據處理
實驗數據用Microsoft office 2010 作圖,SPSS 13.0進行數據統計分析,采用鄧肯氏新復極差法檢驗,以p<0.05為差異顯著性標準。
2 結果及分析
2.1 木犀草素標準曲線
根據不同質量分數的木犀草素標準溶液及其所對應的吸光度值,擬合線性方程為y=43.906x+0.0173,R2=0.9929,式中y為吸光度值,x為木犀草素質量分數。
2.2 乙醇提取工藝單因素實驗結果
2.2.1 乙醇體積分數對木犀草素得率的影響 由圖1可知,在乙醇體積分數為60%至65%的范圍內,木犀草素得率隨著乙醇體積分數的增加而增加,乙醇體積分數為65%時其得率為10.18 mg·g-1,達到最大值,但乙醇體積分數大于65%時,提取得率隨乙醇體積分數的增加反而降低,這是因為隨著乙醇-水體積分數的變化,溶劑的極性也隨之變化,對木犀草素的溶出率發生變化,而且體積分數不同的乙醇水溶液對組織細胞的結構影響不同,同時水的減少也削弱了對顆粒細胞的溶脹,所以乙醇體積分數提高到一定程度,木犀草素的提取率反而降低[15]。體積分數為80%時,木犀草素得率為8.42 mg·g-1,比乙醇體積分數為65%時木犀草素得率10.18 mg·g-1,低17.29%,方差分析結果顯示,在乙醇體積分數為65%時,顯著(p<0.05)大于其它處理水平的木犀草素得率。

圖1 乙醇體積分數對木犀草素得率的影響Fig.1 Effect of volume fraction of ethanol on luteolin yield
2.2.2 浸泡時間對木犀草素得率的影響 由圖2可以看出,浸泡時間在20~30 min范圍時,木犀草素得率是逐漸上升的,在浸泡時間為30 min時,木犀草素得率達到最大,為9.95 mg·g-1,這是由于浸泡時間越長就會有越多的木犀草素溶解到提取液中;而浸泡時間為30~40 min時,木犀草素得率反而下降,40 min的得率為8.60 mg·g-1,可能是由于木犀草素保存在溶劑里時間過長被氧化破壞的緣故。方差分析結果表明,浸泡時間30 min時的木犀草素得率顯著(p<0.05)高于25 min和35 min,故選取25、30和35 min三個處理水平用于正交實驗設計。
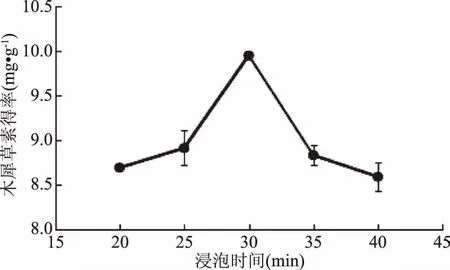
圖2 浸泡時間對木犀草素得率的影響Fig.2 Effect of soak time on luteolin yield
2.2.3 液料比對木犀草素得率的影響 由圖3可知,液料比在6∶1~10∶1的范圍內,木犀草素得率是不斷增加的,當液料比為10∶1時,木犀草素得率最大,為10.70 mg·g-1,這是因為隨著乙醇量的增加,使其與底物的接觸機會增大,從而得到更多的木犀草素;但當液料比在10∶1~14∶1范圍內時,木犀草素得率反而降低,是因為與木犀草素競爭乙醇溶液的其他醇溶性雜質溶出量增加,導致木犀草素的溶出率降低,得率下降[16]。當液料比為6∶1時木犀草素得率為9.96 mg·g-1,比液料比為10∶1時木犀草素得率10.70 mg·g-1低6.92%。方差分析結果表明,液料比為10∶1時,顯著(p<0.05)大于其他處理水平的木犀草素得率。因此,選取液料比為8∶1、10∶1、12∶1三個水平用于正交實驗設計。

圖3 液料比對木犀草素得率的影響Fig.3 Effect of liquid to solid ratio on luteolin yield
2.2.4 提取次數對木犀草素得率的影響 由圖4可以看出,提取次數在1~2次范圍內,木犀草素得率是逐漸增大的,最高為9.42 mg·g-1,這可能是因為提取次數增多使得更多的木犀草素溶解在提取液中;而在提取次數為2~5次時,木犀草素得率反而是下降的,提取5次時的木犀草素得率為9.00 mg·g-1,出現此變化的原因可能是提取次數過多導致提取液中的木犀草素被氧化分解造成的。方差分析結果表明,提取次數為2次時的木犀草素得率顯著(p<0.05)高于1次和3次,故選取1、2和3次三個處理水平用于正交實驗設計。

圖4 提取次數對木犀草素得率的影響Fig.4 Effect of extracting times on luteolin yield
2.3 正交實驗及結果分析
正交實驗結果以及極差分析結果如表3所示,影響牡丹果皮木犀草素得率的主次關系依次為提取次數、乙醇體積分數、浸泡時間、液料比。

表3 乙醇提取木犀草素正交實驗因素結果Table 3 Design and results of orthogonal test of ethanol extract luteolin
由表4可知,乙醇體積分數、浸泡時間、液料比、提取次數四因素都達到了顯著(p<0.05)水平,表明實驗中的乙醇體積分數、浸泡時間、液料比、提取次數均顯著(p<0.05)地影響了木犀草素得率。

表4 乙醇提取木犀草素方差分析結果Table 4 The results of ANOVA of ethanol extract luteolin
2.4 驗證實驗
經極差分析可知,當組合為A1B2C2D3,即乙醇體積分數60%,浸泡時間30 min,液料比10∶1,提取3次時,木犀草素得率最大。而此組合并未出現在上述正交實驗組合中,所以在此工藝條件下驗證,得出的最優組合提取條件下的木犀草素得率為(15.48±0.18) mg·g-1。對比優化前的提取條件,即60%乙醇溶液浸泡25 min、液料比為8∶1、提取一次的條件下所得的木犀草素得率9.25 mg·g-1,優化后的得率為優化前的1.67倍。
2.5 酶解輔助乙醇提取工藝單因素實驗結果
2.5.1 酶種類及酶質量濃度對木犀草素得率的影響 由圖5可知,果膠酶對于木犀草素得率的影響更加明顯,所以選用果膠酶輔助提取木犀草素。在果膠酶濃度為0.05~0.10 g·L-1范圍內,得率不斷增大,果膠酶濃度為0.10 g·L-1時木犀草素的得率達到最大為17.94 mg·g-1,是因為隨著果膠酶濃度升高,酶與底物接觸的機會增加,有更多的木犀草素被分離出來;而酶濃度為0.10~0.25 g·L-1時,木犀草素得率反而逐漸降低,果膠酶濃度為0.25 g·L-1時,木犀草素得率為16.34 mg·g-1,比0.10 g·L-1時低9.79%。方差分析結果顯示,當果膠酶濃度為0.10 g·L-1時的得率顯著(p<0.05)大于其他處理水平的木犀草素得率。因此,選擇果膠酶濃度為0.05、0.10、0.15 g·L-1三個水平用于正交實驗設計。

圖5 纖維素酶濃度和果膠酶濃度對木犀草素得率的影響Fig.5 Effect of cellulase concentration and pectinase concentration on luteolin yield
2.5.2 水浴時間對木犀草素得率的影響 由圖6可知,在水浴時間為80~140 min范圍內,隨著水浴時間的不斷延長,得率也不斷升高,當水浴時間為140 min時得率最大,為17.98 mg·g-1,這可能是因為水浴時間越長就有越多的木犀草素溶解到提取液中;但當水浴的時間在140~160 min時,木犀草素的得率反而降低至16.88 mg·g-1,比水浴時間為140 min時木犀草素得率低6.12%,這可能是因為木犀草素在較高溫度下保持時間過長而被氧化破壞的緣故。方差分析結果顯示,水浴時間為140 min時,顯著(p<0.05)大于其他處理水平的木犀草素得率。所以選擇120、140、160 min三個水平用于正交實驗設計。

圖6 水浴時間對木犀草素得率的影響Fig.6 Effect of water bath time on luteolin yield
2.5.3 pH對木犀草素得率的影響 如圖7所示,pH3.5~4.0范圍內,木犀草素得率隨著pH增大而升高,pH4.0時得率達到最大值,為17.80 mg·g-1,這可能是因為隨著pH的升高,酶的活性也隨之升高;但當pH4.0~5.5范圍內時,木犀草素得率反而降低,pH5.5時為16.62 mg·g-1,比pH4.0時低了6.63%,這可能是pH過高,果膠酶活性降低,從而使得木犀草素得率降低。方差分析結果顯示,pH4.0時,顯著(p<0.05)大于其他處理水平的木犀草素得率。因此選取pH為3.5、4.0、4.5三個水平用于正交實驗設計。

圖7 pH對木犀草素得率的影響Fig.7 Effect of pH on luteolin yield
2.5.4 水浴溫度對木犀草素得率的影響 由圖8可知,水浴溫度在40~55 ℃時,木犀草素得率不斷增高,在55 ℃時達到最大,為17.62 mg·g-1,這也許是因為溫度升高,酶活性也隨之增大;但在55~60 ℃范圍內時,木犀草素得率反而降低,60 ℃時為16.06 mg·g-1,比55 ℃時低8.85%,這是因為果膠酶的最適溫度為55 ℃,溫度過高會使果膠酶活性降低,從而使木犀草素得率降低。方差分析結果顯示,水浴溫度是55 ℃時的得率,顯著(p<0.05)大于其它處理水平的木犀草素得率。因此,選取45、50、55 ℃三個水平用于正交實驗設計。

圖8 水浴溫度對木犀草素得率的影響Fig.8 Effect of water bath temperature on luteolin yield
2.6 正交實驗及結果分析
正交實驗結果和極差分析結果見表5,由表5可知,影響牡丹果皮木犀草素得率的主次關系依次為水浴時間、水浴溫度、pH、果膠酶濃度。

表5 酶解輔助乙醇提取木犀草素正交實驗因素結果Table 5 Design and results of orthogonal test of enzyme assisted ethanol extraction of luteolin

表6 酶解輔助乙醇提取木犀草素方差分析結果Table 6 The results of ANOVA of enzyme assisted ethanol extraction of luteolin
由表6可知,果膠酶濃度、水浴時間、pH、水浴溫度四因素均達到顯著(p<0.05)水平,說明了實驗中的果膠酶濃度、水浴時間、pH、水浴溫度均顯著(p<0.05)地影響木犀草素得率。
2.7 驗證實驗
經極差分析表明,當組合為A1B3C2D3,即在果膠酶濃度0.05 g·L-1、水浴加熱160 min、pH4.0、水浴溫度55 ℃條件下進行處理后,再在乙醇體積分數60%、浸泡時間為30 min、液料比為10∶1的條件下提取3次,木犀草素得率預計達到最大。因為此組合并沒有出現在以上正交實驗組合中,所以在此條件下進行驗證,得出的最優組合提取條件下的木犀草素得率為(19.30±0.41) mg·g-1。對比未經優化的提取條件,即60%乙醇溶液浸泡25 min、液料比為8∶1、提取一次的條件下所得的木犀草素得率9.25 mg·g-1,優化后的產品得率為優化前的2.09倍;對比酶解條件未優化的得率,即果膠酶0.05 g·L-1、水浴加熱120 min、pH3.5、水浴溫度45 ℃的條件下處理后,在乙醇體積分數為60%、果皮浸泡30 min、液料比為10∶1條件下提取3次所得木犀草素得率16.70 mg·g-1,優化后的產品得率為優化前的1.15倍。
3 結論
本研究采用酶解輔助乙醇提取牡丹果皮木犀草素的工藝條件,首先進行乙醇提取牡丹果皮木犀草素最優條件的探究,通過正交實驗得出最優提取組合,即在乙醇體積分數為60%、浸泡時間30 min、液料比為10∶1的條件下提取3次,木犀草素得率為15.48 mg·g-1;在此最優組合的條件下加入果膠酶,同樣在單因素實驗的基礎上,通過正交實驗得出酶解條件的最佳組合為果膠酶0.05 g·L-1、水浴加熱160 min、pH4.0、水浴溫度55 ℃,再以兩次正交實驗的結果進行驗證,即在果膠酶0.05 g·L-1、pH4.0、水浴加熱160 min、水浴溫度55 ℃的條件處理后,再在乙醇體積分數為60%、果皮浸泡30 min、液料比為10∶1的條件下提取3次,牡丹果皮木犀草素得率最高達19.30 mg·g-1。對比本實驗最初研究結果表明,經過果膠酶輔助乙醇提取后,木犀草素得率為優化前的2.09倍,達到了強化提取的預期效果,節約了能源,提高了提取效率。
[1]翟文婷,朱獻標,李艷麗,等. 牡丹籽油對小鼠急性肝損傷的保護作用[J]. 中國油脂,2013,38(11):43-45.
[2]Su J,Wang H,Ma C,et al. Anti-diabetic activity of peony seed oil,a new resource food in STZ-induced diabetic mice[J]. Food & Function,2015,6(9):2930-2938.
[3]Su J,Ma C,Liu C,et al. Hypolipidemic Activity of Peony Seed Oil Rich inα-Linolenic,is Mediated Through Inhibition of Lipogenesis and Upregulation of Fatty Acidβ-Oxidation[J]. Journal of Food Science,2016,81(4):H1001-H1009.
[4]董振興,彭代銀,宣自華,等. 牡丹籽油降血脂、降血糖作用的實驗研究[J]. 安徽醫藥,2013,17(8):1286-1289.
[5]高婷婷,王亞蕓,任建武. GC-MS法分析牡丹籽油的成分及其防曬效果的評定[J]. 食品科技,2013,39(6):296-299.
[6]代慧慧,魏安池,李曉棟,等. 牡丹籽油開發應用的研究進展[J]. 糧食與油脂,2016,30(1):4-6.
[7]朱獻標,翟文婷,董秀勛,等. 牡丹籽油化學成分及功能研究進展[J]. 中國油脂,2014,39(1):88-91.
[8]王順利,任秀霞,薛璟祺,等. 牡丹籽油成分、功效及加工工藝的研究進展[J]. 中國糧油學報,2016,31(3):139-146.
[9]呂暢,王紅芳,閻雪瑩. 木犀草素抗氧化作用研究進展[J].黑龍江醫藥,2015,28(5):1019-1022.
[10]王倩,謝明杰. 木犀草素對金黃色葡萄球菌的抑菌活性及其機制[J]. 微生物學報,2010,50(9):1180-1184.
[11]魏平平,張振海,金鑫,等. 木犀草素混合膠束的制備及其抗腫瘤活性研究[J]. 中國藥學雜志,2015,50(15):1330-1334.
[12]劉圓,李園園,馮婷婷,等. 木犀草素鎮痛抗炎作用的實驗研究[J]. 齊齊哈爾醫學院學報,2010,31(15):2368-2370.
[13]孟慶煥,祖元剛,王化,等.酶解輔助乙醇提取牡丹種皮中的木犀草素[J].東北林業大學學報,2015,43(6):133-135.
[14]徐文峰,廖曉玲,廖文利,等. 鉬酸鹽分光光度法測定花生殼中木犀草素[J]. 理化檢驗:化學分冊,2008,44(12):1229-1230.
[15]李洪娟. 花生殼中木犀草素的超聲提取工藝[J]. 湖北農業科學,2010,49(5):1183-1185.
[16]仇洋,徐艷陽,劉輝,等. 微波-超聲輔助提取玉米須木犀草素的工藝優化[J]. 食品安全質量檢測學報,2016,7(4):1637-1644.

