樹鼩糞便中沙門氏菌LAMP檢測方法建立及應用
王 璇,袁 園,張志成,劉城秀,宋慶凱,孫曉梅
(中國醫(yī)學科學院/北京協(xié)和醫(yī)學院醫(yī)學生物學研究所樹鼩種質(zhì)資源中心,中國醫(yī)學科學院醫(yī)學生物學研究所實驗樹鼩標準化與應用研究省創(chuàng)新團隊,云南省眼科疾病防治研究重點實驗室,昆明 650118)
沙門氏菌(Salmonella)屬于γ-變形菌綱、腸桿菌科、沙門氏菌屬,為革蘭氏陰性菌。是重要的人獸共患病病原菌之一,引起人獸感染后可能表現(xiàn)為無癥狀帶菌狀態(tài),也會出現(xiàn)有癥狀的致死疾病,能加重病態(tài)或死亡率, 或者降低動物的繁殖生產(chǎn)力[1],對實驗動物的影響較嚴重;是所有實驗動物微生物質(zhì)量控制中必須排除的病原菌。腸炎沙門氏菌(Salmonellaenteritidis)和傷寒沙門氏菌(Salmonellatyphimurium) 是全世界流行的主要沙門氏菌[2],感染后通常引起嘔吐、腹瀉、腸炎等癥狀。
環(huán)介導等溫擴增技術(shù)是由Notomi等[3]在2000年最早發(fā)明的一種新型的核酸擴增方法。其原理是針對靶基因保守序列的6~8區(qū)域設(shè)計4~6條引物,包括外引物、內(nèi)引物、環(huán)引物各一對,其中內(nèi)引物和外引物是反應必需的,加入環(huán)引物可通過與莖環(huán)DNA雜交,并促進鏈置換和擴增[4-5],以加速LAMP反應,在具鏈置換活性的DNA 聚合酶(如Bst)作用下,即可在60℃~66℃的恒溫條件下短時間內(nèi)實現(xiàn)大量擴增,反應結(jié)果可通過直接觀察是否產(chǎn)生焦磷酸鎂白色沉淀來判斷[6-7],也可在反應前后加入顯色劑(如鈣黃綠素,SYBR Green I等)根據(jù)顏色變化來判斷,還可在紫外光下通過觀察熒光情況判斷[8-9];對擴增產(chǎn)物進行凝膠電泳為梯狀條帶。LAMP法檢測具有特異、靈敏、快速、便攜等特點,在恒溫條件下40 min內(nèi)即可完成高效擴增反應,可肉眼觀察反應結(jié)果,被廣泛應用病原菌和寄生蟲的檢測中[10]。
樹鼩作為一種實驗動物,其在進化上接近于靈長類動物,在生理、生化及解剖學等生物學特性方面與人類有著相似之處,被廣泛引用于人類病毒性疾病[11]、眼科疾病[12]、生殖生物學及免疫學[13]等疾病研究中。利用樹鼩進行實驗前需要檢測沙門氏菌以排除其對實驗的干擾,因此,建立快速、簡便、特異的方法對于樹鼩沙門氏菌檢測具有重要意義。本研究旨在建立一種具有上述特點的可大規(guī)模檢測樹鼩糞便沙門氏菌的LAMP方法。
1 材料和方法
1.1 實驗菌株
本研究使用的兩個陽性菌株即腸炎沙門氏菌(CMCC50041株,凍干粉)和乙型副傷寒沙門氏菌(CMCC50094株,凍干粉)來自于中國食品藥品鑒定研究院;其它菌株即普通變形桿菌、糞腸球菌等8株均為前期從野生來源樹鼩腸道中分離、鑒定、保存的菌株[14],見表1中3~10號樣品,由中國醫(yī)學科學院醫(yī)學生物學研究所的李建芳老師惠贈。
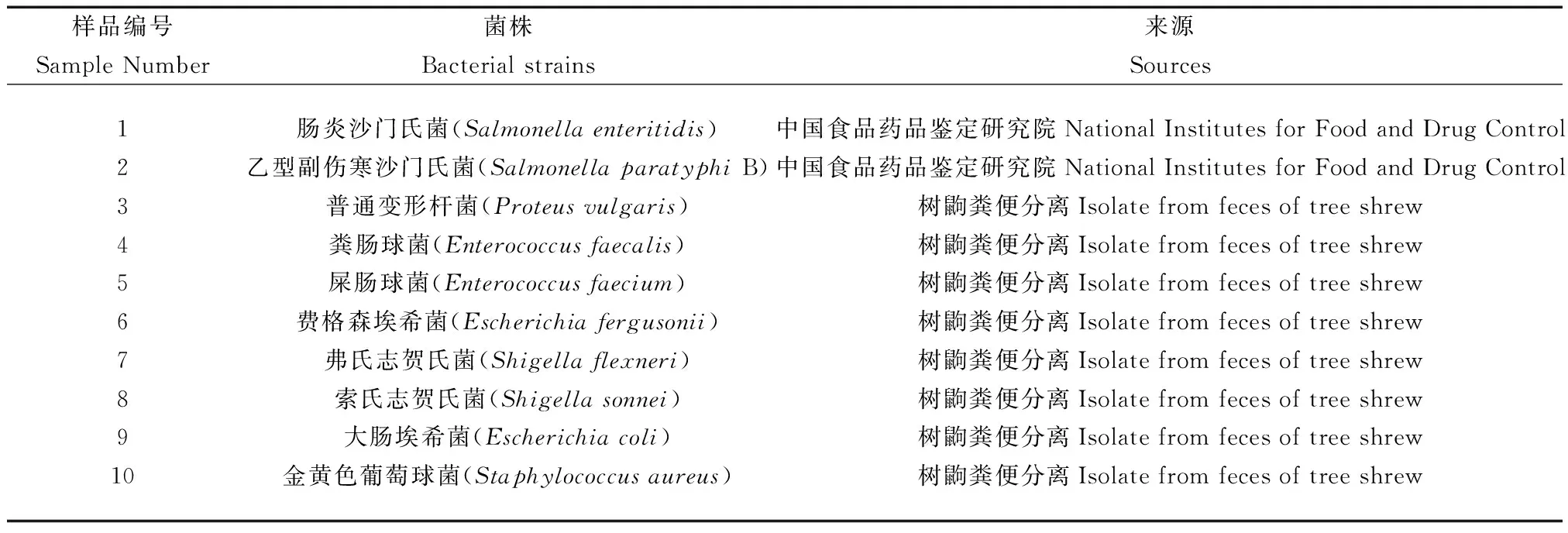
表1 實驗菌株及來源
1.2 樹鼩糞便樣本
利用肛拭子采集野生來源、腹瀉樹鼩的稀便,于1.5 mL離心管中,4℃保存。
1.3 主要儀器與試劑
高速離心機(HIMAC);nanophotometer N50超微量分光光度儀(Implen); PCR 擴增儀(Bio-Rad);凝膠成像儀(Bio-Rad);電泳儀和電泳槽(Bio-Rad);細菌全基因組提取試劑盒(TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0);金牌Mix(擎科生物);WarmStart?LAMP 試劑盒(New England Biolabs Inc);GelRed凝膠核酸染料(Biotium)。
1.4 實驗方法
1.4.1 菌種培養(yǎng)
首先將試驗菌株接種于LB液體培養(yǎng)基內(nèi),恒溫振蕩器內(nèi)37℃ 250 r/min過夜培養(yǎng),以活化和增殖細菌。然后將腸炎沙門氏菌和乙型副傷寒沙門氏菌分別接種于SS培養(yǎng)基上,其余菌種接種于營養(yǎng)瓊脂,37℃恒溫培養(yǎng)箱倒置培養(yǎng)24 h。
1.4.2 菌液濃度測定
將純培養(yǎng)的腸炎沙門氏菌用無菌水10倍梯度稀釋后接種,按平板菌落計數(shù)法計數(shù)。
1.4.3 細菌DNA提取
純培養(yǎng)的實驗菌株參照細菌全基因組提取試劑盒說明書提取DNA;糞便樣品中細菌DNA提取參考LaMontagne[15]、騫宇[16]的細菌基因組提取方法并略微改變。
1.4.4 引物設(shè)計
利用沙門氏菌的invA基因,參考Rahn等[17]的文獻合成普通PCR引物(invA-F、invA-R);參考Yang等[18]的研究合成LAMP引物(F3、B3、FIP、BIP、Loop-F、Loop-B),引物由擎科生物合成,引物序列見表2。
1.4.5 LAMP檢測方法建立和條件優(yōu)化
利用經(jīng)普通PCR檢測為陽性的上述樣本進行LAMP方法建立及優(yōu)化。按照WarmStart? LAMP 試劑盒說明書,采用25 μL的反應體系,包括WarmStart LAMP 2X Master Mix 12.5 μL,40 pmol FIP/BIP各1 μL,10 pmol F3/B3各1 μL, 20 pmol LB/LF 各1 μL,LAMP Fluorescent Dye (50X) 0.5 μL,模板DNA 1 μL,ddH2O補足25 L。對反應溫度和反應時間進行優(yōu)化,其中設(shè)置溫度梯度57℃、58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃、66℃;設(shè)置時間梯度24、26、28、30、32、34、36、38、40、42 min,以篩選最佳反應溫度和反應時間。
1.4.6 LAMP產(chǎn)物檢測
直接肉眼觀察判斷,管中出現(xiàn)白色渾濁為陽性,無明顯渾濁為陰性。另外,反應前在體系中加入鈣黃綠素,反應結(jié)束后陽性為綠色,陰性為橙色,紫外光照射下陽性發(fā)出綠色熒光,陰性不發(fā)熒光。取LAMP產(chǎn)物3 μL用2%的瓊脂糖進行凝膠電泳,在凝膠成像系統(tǒng)中成像, 陽性為梯狀條帶;陰性無明顯條帶。
1.4.7 靈敏度測試
用上述建立的LAMP方法對2株沙門氏菌標準株和8株非沙門氏菌進行檢測,同時進行普通PCR擴增(其中PCR反應條件為:94℃預變性5 min;94℃變性40 s,60℃退火40 s,72℃延伸50 s,35個循環(huán);72℃延伸5 min;保存于4℃)。取擴增產(chǎn)物3 μL于2%的瓊脂糖進行凝膠電泳。

表2 引物序列
1.4.8 靈敏度測試
用無菌水10倍梯度稀釋純培養(yǎng)的沙門氏菌,每個稀釋梯度取5 mL菌液提取DNA。分別進行PCR和LAMP法擴增、電泳,比較兩種方法的靈敏度。
1.4.9 LAMP法在快速檢測樹鼩糞便中沙門氏菌的應用
對91份野生樹鼩新鮮稀便提取的DNA樣品用建立的LAMP法進行檢測,同時用普通PCR法進行對比,比較兩種方法的檢出率。
2 結(jié)果
2.1 沙門氏菌標準株檢測
純培養(yǎng)的沙門氏菌初始濃度為3.36×108CFU/mL。PCR擴增后凝膠電泳結(jié)果顯示在284 bp處有目的條帶(見圖 1),表明為沙門氏菌陽性。LAMP試驗結(jié)束后反應管內(nèi)液體為綠色,無模板對照為橙色,凝膠電泳結(jié)果顯示為梯狀條帶,是LAMP擴增的典型特征(見圖2)。
注:(A) 凝膠電泳(陽性為梯狀條帶);(B) 凝膠成像系統(tǒng)拍照;(C) 肉眼觀察(陽性為綠色);(M) DL1000 DNA marker;(1) 腸炎沙門氏菌標準株;(2) 乙型副傷寒沙門氏菌標準株;(3) 無模板對照。圖2 沙門氏菌標準株LAMP檢測結(jié)果Note.(A) Gel electrophoresis (Positive samples show ladder strips). (B) Pictures taken by the gel imaging system. (C) Visual observation (positive samples are green). (M) DL1000 DNA marker;(1) Salmonella enteritidis standard strain. (2) Salmonella paratyphi B standard strain;(3) No template control.Fig.2 The results of Salmonella standard strain LAMP test
2.2 LAMP 反應條件優(yōu)化結(jié)果
條件優(yōu)化結(jié)果顯示在所有溫度梯度下均出現(xiàn)條帶,且條帶亮度差異較小,選取62℃作為后續(xù)實驗的反應溫度;反應時間在34 min以前條帶亮度逐漸增強,34 min以后條帶無明顯差異,因此確定最佳反應時間34 min。
2.3 LAMP特異性試驗結(jié)果
利用優(yōu)化好的LAMP法檢測特異性,結(jié)果顯示只在兩個沙門氏菌標準株中出現(xiàn)了綠色,且在紫外光下有綠色熒光,凝膠電泳結(jié)果呈梯狀擴增條帶,
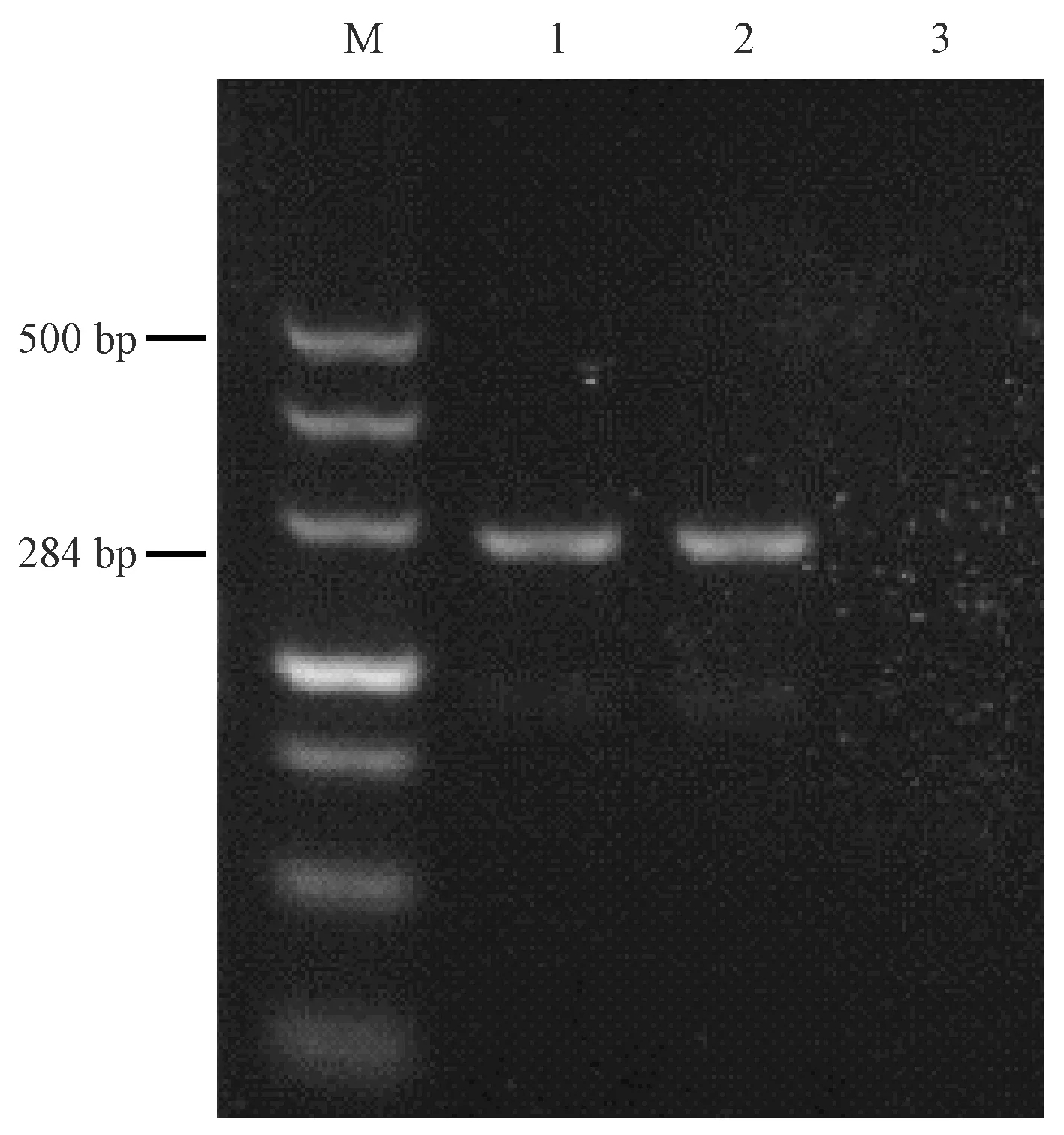
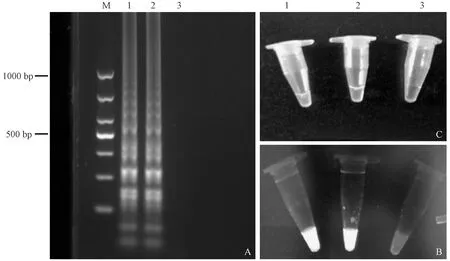
注:(M) DL500 DNA marker;(1)腸炎沙門氏菌標準株;(2)乙型副傷寒沙門氏菌標準株;(3)無模板對照。圖1 沙門氏菌標準株P(guān)CR檢測結(jié)果電泳圖Note:(M) DL500 DNA marker.(1) Salmonella enteritidis standard strain.(2) Salmonella paratyphi B standard strain.(3) No template control.Fig.1 The electrophoresis chart of Salmonella standard strain PCR test
而在其他8株非沙門氏菌內(nèi)無明顯條帶。與PCR結(jié)果一致,說明建立的LAMP法對沙門氏菌具有特異性。(見圖 3)
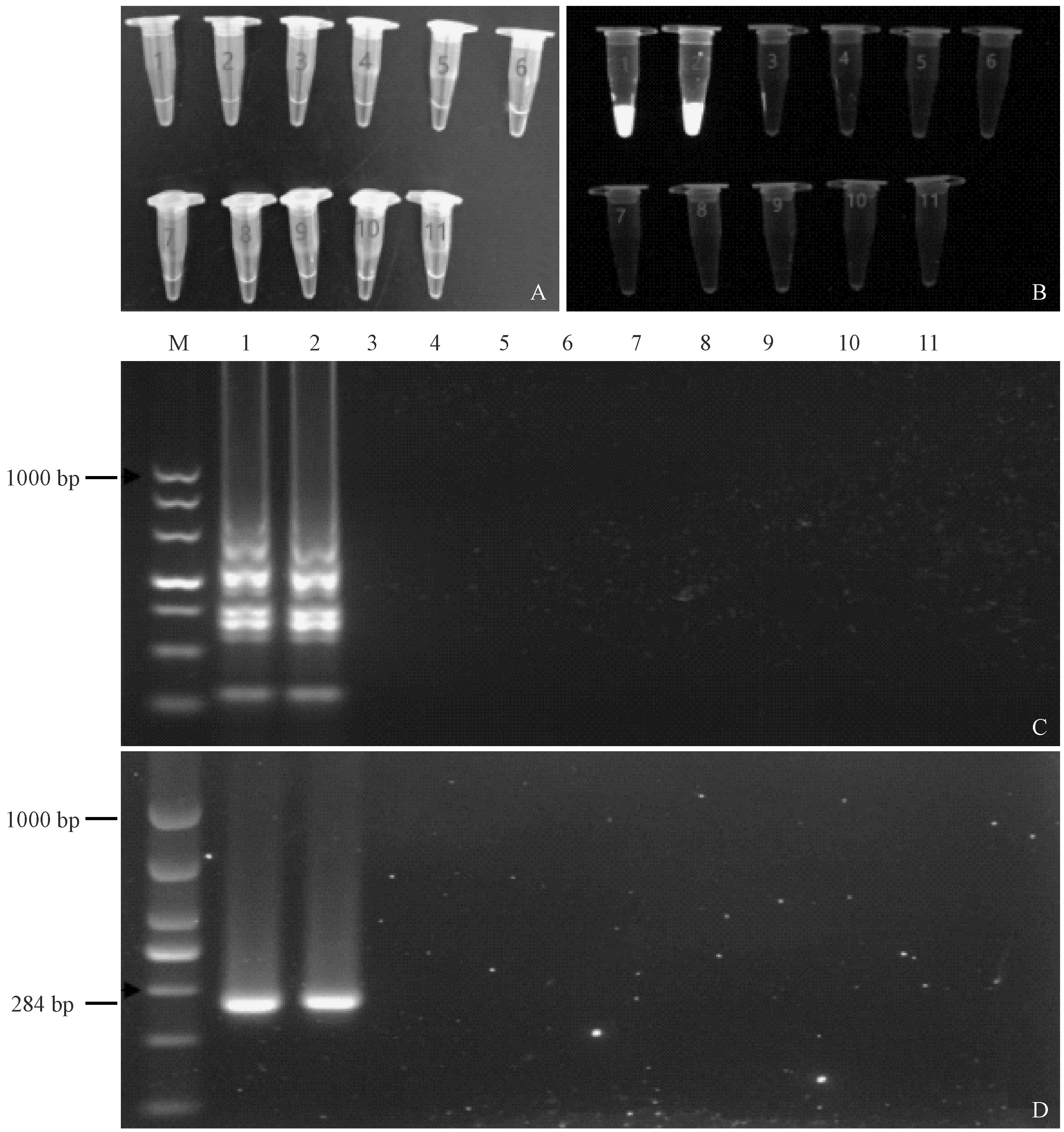
注:(A) 肉眼觀察;(B) 凝膠成像系統(tǒng)拍照;(C) LAMP檢測特異性;(D) PCR檢測特異性;(M) DL1000 DNA marker;(1) 腸炎沙門氏菌;(2) 乙型副傷寒沙門氏菌;(3) 普通變形桿菌;(4) 糞腸球菌;(5) 屎腸球菌;(6) 費格森埃希菌;(7) 弗氏志賀菌;(8) 索氏志賀氏菌;(9) 大腸埃希菌;(10) 金黃色葡萄球菌;(11) 無模板對照。圖3 LAMP和PCR檢測特異性Note.(A) Visual observation. (B) Pictures taken by the gel imaging system. (C) The specificity test results of LAMP. (D) The specificity test results of PCR. (M) DL1000 DNA marker. (1) Salmonella enteritidis. (2) Salmonella paratyphi B. (3) Proteus vulgaris. (4) Enterococcus faecalis. (5) Enterococcus faecium. (6) Escherichia fergusonii. (7)Shigella flexneri.(8) Shigella sonnei. (9) Escherichia coli. (10) Staphylococcus aureus. (11) No template control.Fig.3 The specificity of LAMP and PCR detection
2.4 LAMP檢測沙門氏菌的靈敏度及PCR比較結(jié)果
對純培養(yǎng)的腸炎沙門氏菌進行梯度稀釋,濃度依次為:3.36×108~3.36×100CFU/mL。然后進行LAMP和PCR檢測,凝膠電泳結(jié)果顯示LAMP產(chǎn)物在3.36×108~3.36×101CFU/mL有明顯梯狀條帶;PCR產(chǎn)物在3.36×108~3.36×103CFU/mL有明顯條帶(見圖 4)。因此,LAMP法的檢測限在3.36×101~3.36×100CFU/mL之間,PCR的檢測限在1×103~3.36×102CFU/mL之間,LAMP檢測沙門氏菌的靈敏度是PCR檢測的10~100倍。
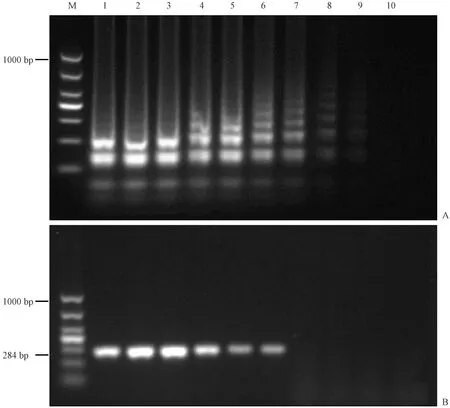
注:(A) LAMP檢測靈敏度;(B) PCR檢測靈敏度;(M) DL1000 DNA marker;(1~9號) 3.36×108~3.36×100 CFU/mL;(10) 無模板對照。圖4 LAMP和PCR檢測靈敏度Note.(A) LAMP assay. (B) PCR assay. (M) DL1000 DNA marker. (No.1-No.9) 3.36×108 to 3.36×100 CFU/mL; (10) No template control.Fig.4 Sensitivity of the LAMP and PCR assays
2.5 LAMP法在快速檢測樹鼩糞便中沙門氏菌的應用
對采集的91份新鮮樹鼩糞便樣品提取DNA進行LAMP檢測,同時進行普通PCR驗證,LAMP結(jié)果顯示陽性樣本數(shù)為19份,陽性檢出率為20.88%;PCR結(jié)果顯示陽性樣本數(shù)為18份,陽性檢出率為19.78%,且PCR和LAMP檢出的陽性樣品完全吻合。LAMP及PCR產(chǎn)物凝膠電泳部分結(jié)果(見圖5)。對PCR檢測陽性的樣品隨機抽取三份進行測序,測序結(jié)果與目的序列的吻合度均達到99%以上,因此可以確定LAMP結(jié)果的可靠性。
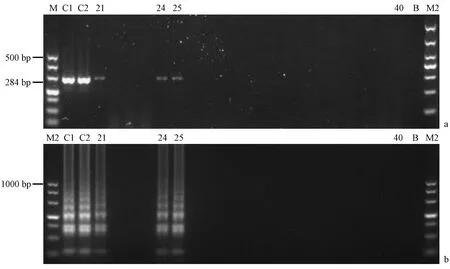
注:(a) PCR產(chǎn)物凝膠電泳;(b) LAMP產(chǎn)物凝膠電泳;(M) DNA marker;(M2) DL1000 DNA marker;(C1)腸炎沙門氏菌;(C2) 乙型副傷寒沙門氏菌;(21~40號) 樹鼩糞便樣品21~40號;(B) 無模板對照。圖5 樹鼩糞便樣品部分LAMP檢測結(jié)果Note.(a) The gel electrophoresis results of PCR products. (b) The gel electrophoresis results of LAMP products.(M) DL500 DNA marker. (M2) DL1000 DNA marker. (C1) Salmonella enteritidis. (C2) Salmonella paratyphi B. (No.21-40) Tree shrew fecal samples No.21-No.40. (B) No template control.Fig.5 The results of LAMP test of a part of the tree shrew stool samples
3 討論
實驗動物致病菌的篩查和檢測方法通常需要具備簡便、快速、特異、靈敏等特性。沙門氏菌作為一種致病性強、流行范圍廣的病原,目前常用的檢測方法主要有傳統(tǒng)的培養(yǎng)鑒定、免疫學(如ELISA試驗)及分子生物學(PCR,qPCR等)方法。雖然傳統(tǒng)的培養(yǎng)鑒定法仍然是沙門氏菌檢測的金標準,但通常需要耗費較長的時間(3 d以上),不利于快速檢測診斷[19];免疫學方法使用方便、檢測快速,但其較低的特異性限制了應用[20],并且針對于樹鼩這一新的實驗動物品種,目前還沒有可使用的市售免疫試劑盒;基于分子生物學基礎(chǔ)的PCR和qPCR方法被廣泛用于沙門氏菌檢測,具有較高特異性和靈敏度,但是需要復雜的儀器設(shè)備,且結(jié)果必須通過凝膠電泳才能觀察,耗時較長,不適用于大規(guī)模快速檢測。LAMP方法針對目的基因的6~8個區(qū)域設(shè)計4~6條引物,只有同時存在所有引物才能啟動擴增,這保證了LAMP法的特異性;LAMP法對儀器要求較低,不需要昂貴的PCR儀,在恒溫水浴鍋中就可以完成全部反應,避免了升降溫循環(huán)的時間消耗,而且實驗結(jié)果直接肉眼可視。因此,相比于傳統(tǒng)的細菌培養(yǎng)、免疫學方法、PCR方法,LAMP法具有操作簡便、耗時短、不需要特殊設(shè)備、結(jié)果可視等優(yōu)點,更適用于現(xiàn)場快速檢測和基層樣品初篩[21-22]。
沙門氏菌invA基因編碼侵襲蛋白A,與細菌吸附侵入有關(guān)[23],侵襲蛋白決定沙門氏菌對腸黏膜細胞的侵襲力,與其致病性密切相關(guān)[24],invA基因高度保守且具有種屬特異性,常被用作沙門氏菌檢測的靶基因。另外,雖然FimY,bcfD[25]等基因也常被用于沙門氏菌檢測的靶基因,但是FimY基因作為LAMP法的靶基因時不能檢測邦戈沙門菌(Salmonellabongori),所以FimY基因不適用于沙門氏菌屬的所有種的檢測[26]。本方法選取了invA基因作為LAMP法檢測的目的基因,在其保守區(qū)設(shè)計引物,結(jié)果顯示在2株沙門氏菌菌株表現(xiàn)出陽性,非沙門氏菌的8種細菌檢測為陰性,擴增產(chǎn)物經(jīng)測序驗證,與預期一致,說明具有較好的特異性。
在本研究中建立的沙門氏菌LAMP法的檢測限為3.36×101CFU/mL,是普通PCR法的10~100倍,反應時間為34 min。吳家林等[27]利用invA基因建立的沙門氏菌LAMP法檢測限為4.8×101CFU/mL,反應時間60 min;邱索平等[28]利用FimY基因建立的實驗猴沙門氏菌檢測方法的檢測限1.35×101CFU/mL,反應時間60 min;Zhuang等[25]利用bcfD基因建立的LAMP的檢測限5×100,反應時間25 min;馬晨等[29]比較了傳統(tǒng)的細菌分離培養(yǎng)鑒定方法,其檢測限是0.5×105CFU/mL,低于這一劑量的樣品都將無法被檢測,并且檢出時間需要1 d以上,抗雜菌干擾能力較分子生物學方法低,樣品中微生物污染背景較高且沙門氏菌劑量較低時,檢測結(jié)果易被干擾。本研究建立的樹鼩糞便中沙門氏菌的LAMP檢測方法的靈敏度與其他的研究報道的LAMP方法相近,而高于傳統(tǒng)的培養(yǎng)鑒定方法;反應時間明顯低于傳統(tǒng)培養(yǎng)鑒定方法和不含LF/LB引物的LAMP方法,說明加入LF/LB引物能通過促進鏈置換和擴增從而大大加速LAMP反應[4-5]。
由于LAMP法較高的靈敏度和擴增效率,極易因污染而出現(xiàn)假陽性[26],因此在加樣過程中應該盡量避免交叉污染和產(chǎn)生氣溶膠污染,陽性模板和其他樣品模板加樣區(qū)域應分離。在本試驗中使用的顯色劑是鈣黃綠素,在反應前加入到反應體系,反應過程中不需開蓋,避免了反應后開蓋加入顯色劑時引起的氣溶膠污染,保證了實驗的特異性。
利用建立的LAMP法對91份野生來源樹鼩新鮮稀便樣品檢測,結(jié)果顯示LAMP法檢測的陽性率為20.88%,PCR檢測的陽性率為19.78%,陽性樣品完全一致,表明所建立LAMP方法可用于樹鼩糞便樣品的檢測。邢進等[30]曾對樹鼩腸道內(nèi)容物進行細菌分離培養(yǎng),并進行生化、藥敏和16SrRNA 測序鑒定,最終得出樹鼩沙門氏菌攜帶率為3.3%;高家紅等[31]的樹鼩正常腸道細菌的培養(yǎng)分離鑒定及其藥敏試驗研究結(jié)果顯示沙門氏菌攜帶率8.41%。本研究的沙門氏菌陽性檢出率高于上述研究結(jié)果,原因之一是樣品來源不同,本次實驗檢測的糞便樣品均來自于野生、待檢疫的腹瀉樹鼩,并且采樣時間為夏季,濕熱的環(huán)境易于沙門氏菌滋生。原因之二是分子生物學檢測方法的靈敏性。本實驗研究為實驗樹鼩沙門氏菌病原的檢測提供了又一種簡單、快捷、有效的方法。
[1] 彭麗萍, 陳博文, 徐建超, 等. 食品沙門氏菌檢測方法進展[J]. 中國人獸共患病雜志, 1999, 16(5): 89-91.
[2] 徐桂云,樊世杰. 家禽沙門氏菌感染現(xiàn)狀及不同國家的防治策略[J]. 中國家禽,2012,34(9): 7-12.
[3] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): e63.
[4] Nagamine K, Hase T, Notomi T, et al. Accelerated reaction by loop mediated isothermal amplification using loop primers[J]. Mol Cell Probes, 2002, 16(3): 223-229.
[5] Fukuta S, Ohishi K, Yoshida K, et al. Development of immunocapture reverse transcription loop-mediated isothermal amplification for the detection of tomato spotted wilt virus from chrysanthemum[J]. J Virol Methods, 2004, 121(1): 49-55.
[6] Mori Y, Nagamine K, Tomita N, et al. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochem Biophys Res Commun, 2001, 289(1): 150-154.
[7] Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J]. Nat Protoc, 2008, 3(5): 877-882.
[8] Gao H, Lei Z, Jia J, et al. Application of loop-mediated isothermal amplification for detection of Yersinia enterocolitica in pork meat[J].J Microbiol Methods, 2009, 77(2): 198-201.
[9] Lu CC, Dai TT, Zhang HF, et al. Development of a loop-mediated isothermal amplification assay to detect Fusarium oxysporum[J]. J Phytopathol, 2015, 163(1): 63-66.
[10] 戴婷婷, 陸辰晨, 鄭小波, 等. 環(huán)介導等溫擴增技術(shù)在病原物檢測上的應用研究進展[J].南京農(nóng)業(yè)大學學報, 2015, 38(5): 695-703.
[11] 殷安國, 匡德宣, 李曉飛, 等. 樹鼩模型在人類病毒性疾病研究中的應用進展[J]. 中國實驗動物學報, 2014, 22(2): 86-89.
[12] 周廣龍, 朱勤, 李振宇, 等. 樹鼩在眼科學的基礎(chǔ)研究進展[J]. 中國實驗動物學報, 2015, 23(6): 652-655.
[13] 徐新平, 陳紅波, 賁昆龍. 樹鼩在醫(yī)學生物學中的應用[J]. 中國實驗動物學報, 2005, 13(3): 187-190.
[14] 劉麗君,余柄廷,胡凝珠, 等. 樹鼩糞便細菌分離培養(yǎng)與鑒定[J]. 中國比較醫(yī)學雜志. 2015, 25(210): 64-68.
[15] LaMontagne MG, Michel FC Jr, Holden PA, et al. Evaluation of extraction and purification methods for obtaining PCR-amplifiable DNA from compost for microbial community analysis[J]. J Microbiol Methods, 2002, 49(3): 255-264.
[16] 騫宇, 趙欣. 大鼠糞便中細菌基因組DNA提取方法的比較[J]. 食品工業(yè)科技, 2014, 35(4): 166-169.
[17] Rahn K, De Grandis SA, Clarke RC, et al. Amplification of an invA gene sequence of Salmonella typhimurium by polymerase chain reaction as a specific method of detection of Salmonella[J]. Mol Cell Probes, 1992, 6(4): 271-279.
[18] Yang Q, Domesle KJ, Wang F, et al. Rapid detection of Salmonella in food and feed by coupling loop-mediated isothermal amplification with bioluminescent assay in real-time[J]. BMC Microbiol, 2016, 16(1): 112.
[19] GB4789.4-2010,食品微生物學檢驗沙門氏菌檢驗[S].
[20] Eriksson E, Aspan A. Comparison of culture, ELISA and PCR techniques for Salmonella detection in faecal samples for cattle, pig and poultry[J]. BMC Vet Res, 2007, 3: 21.
[21] 張鳳玉, 胡丹, 呂恒, 等. 2型豬鏈球菌89K毒力島Ⅳ型分泌系統(tǒng)LAMP檢測方法的建立[J]. 中國病原生物學雜志, 2014, 9(2): 113-116,121.
[22] 熊春蓉, 殷旭仁, 宋麗君, 等. 環(huán)介導同溫DNA擴增法(LAMP)與解剖-顯微鏡檢法檢測血吸蟲感染性釘螺效果的比較[J]. 中國病原生物學雜志, 2014, 9(12): 1084-1087.
[23] Ashida H, Toyotome T, Nagai T, et al. Shigella chromosomal IpaH proteins are secreted via the type III secretion system and act as effectors[J]. Mol Microbiol,2007, 63(3): 680-693.
[24] Galán JE, Curtiss R. Distribution of the invA, -B, -C, and -D genes of Salmonella typhimurium among other Salmonella serovars: invA mutants of Salmonella typhi are deficient for entry into mammalian cells[J]. Infect Immun,1991, 59(9), 2901-2908.
[25] Zhuang L,Gong J, Li Q, et al. Detection of Salmonella spp. by a loop-mediated isothermal amplification (LAMP) method targeting bcfD gene[J]. Lett Appl Microbiol. 2014, 59(6): 658-664.
[26] Boyd EF, Hartl DL. Analysis of the type 1 Pilin gene cluster fim in Salmonella: its distinct evolutionary histories in the 5’ and 3’ regions[J]. J Bacteriol, 1999, 181(4): 1301-1308.
[27] 吳家林, 沙丹, 馬廣源, 等. 沙門氏菌LAMP檢測方法的建立[J]. 中國病原生物學雜志, 2015, 10(7): 611-614.
[28] 邱索平, 林志雄, 游勇來, 等. 實驗猴糞便樣品中沙門氏菌LAMP檢測方法的建立及應用[J]. 中國畜牧獸醫(yī), 2014, 41(1): 51-56.
[29] 馬晨, 陳雪華, 李建國. 國標法與快速法檢測沙門氏菌的結(jié)果比較[J]. 食品科技, 2015, 40(9): 276-282.
[30] 邢進, 馮育芳, 付瑞, 等. 野生樹鼩可培養(yǎng)細菌和真菌攜帶情況的調(diào)查[J]實驗動物科學, 2012, 29(3): 34-38.
[31] 高家紅, 江勤芳, 羅志武, 等. 樹鼩正常腸道細菌的培養(yǎng)分離鑒定及其藥敏試驗研究[J]. 中國比較醫(yī)學雜志, 2009, 19(12): 24-26,34.

