肝臟血管周上皮樣細胞腫瘤的臨床病理分析
龍衛國,鄭芳,李梅,陳凱,張云興,吳建農
(江蘇大學附屬醫院病理科,江蘇 鎮江 212000)
血管周上皮樣細胞腫瘤(PEComa)是一類組織學形態上由大量圓形和卵圓形上皮樣細胞構成的罕見間質腫瘤[1]。這類腫瘤細胞胞質豐富,含透明嗜酸性顆粒,細胞對肌源性標記物平滑肌肌動蛋白(SMA)及黑色素性標記物HMB-45和Melan-A染色呈陽性。自1991年PEA首次報道腎臟的血管平滑肌脂肪瘤以來,PEComa家族越來越多被發現和報道。目前已經報道的PEComa家族包括腎與腎外血管平滑肌脂肪瘤(AML)、淋巴管肌瘤病(LAM)、肺透明細胞糖瘤(CCST)及透明細胞肌黑色細胞腫瘤(CCMMT)和一系列發生于盆腹腔臟器、軟組織及骨等組織學形態和免疫表型類似的少見部位腫瘤[2],這些腫瘤可分為特殊類型和非特殊類型。特殊類型包括AML、LAM、CCST和CCMMT,非特殊類型即PEComa-NOS[3]。目前我們通常所講的PEComa是指PEComa-NOS。PEComa可以發生于子宮、卵巢、胃腸道、肝胰、前列腺和軟組織等部位,但原發于肝臟者十分罕見。本研究對2例發生于肝臟的上皮樣PEComa的臨床、組織學及免疫組化(IHC)特征進行分析,并對其鑒別診斷和生物學行為進行探討,旨在提高大家對PEComa的認識。
1 材料與方法
1.1 資料來源 收集江蘇大學附屬醫院2010年9月—2017年3月診治的肝臟PEComa患者2例。
1.2 方法 標本經4%中性福爾馬林固定,常規石蠟切片、HE染色,光鏡觀察。IHC采用二步法;所用抗體AE1/AE3,EMA,Vimentin,CK7,CK8,CK18,CK19,CK20,CD68,CD34,CD117,DOG-1,CD10,Lysozyme,HMB-45,Melan-A,SMA,Desmin,Hepatocyte,AFP,S-100,Ki-67,均購自福州邁新公司。
2 結果
2.1 臨床特征 病例1:女,53歲。體檢發現肝右葉占位,查CT示肝右葉后下段強化灶(1.4 cm×2.6 cm),考慮MT可能入院,既往無病毒性肝炎病史。病例2:女,45歲,因下腹痛在我院就診時偶然發現肝臟占位,正電子發射斷層掃描(PET-CT)示肝臟左頂葉部2.3 cm×1.6 cm類圓形低密度影,考慮小肝癌,血清甲胎蛋白(AFP)水平正常。2例患者均入院后行肝占位局部切除術。
2.2 病理檢查
2.2.1 肉眼觀察 病例1:送檢肝組織一塊,體積4.5 cm×3.2 cm×2 cm,切面見一土黃色結節,直徑約1.5 cm,質軟,境界尚清。病例2,送檢肝組織一塊,體積3.0 cm×2.6 cm×1.6 cm,切面見一灰黃色結節,最大徑約2.5 cm,質軟,境界尚清。
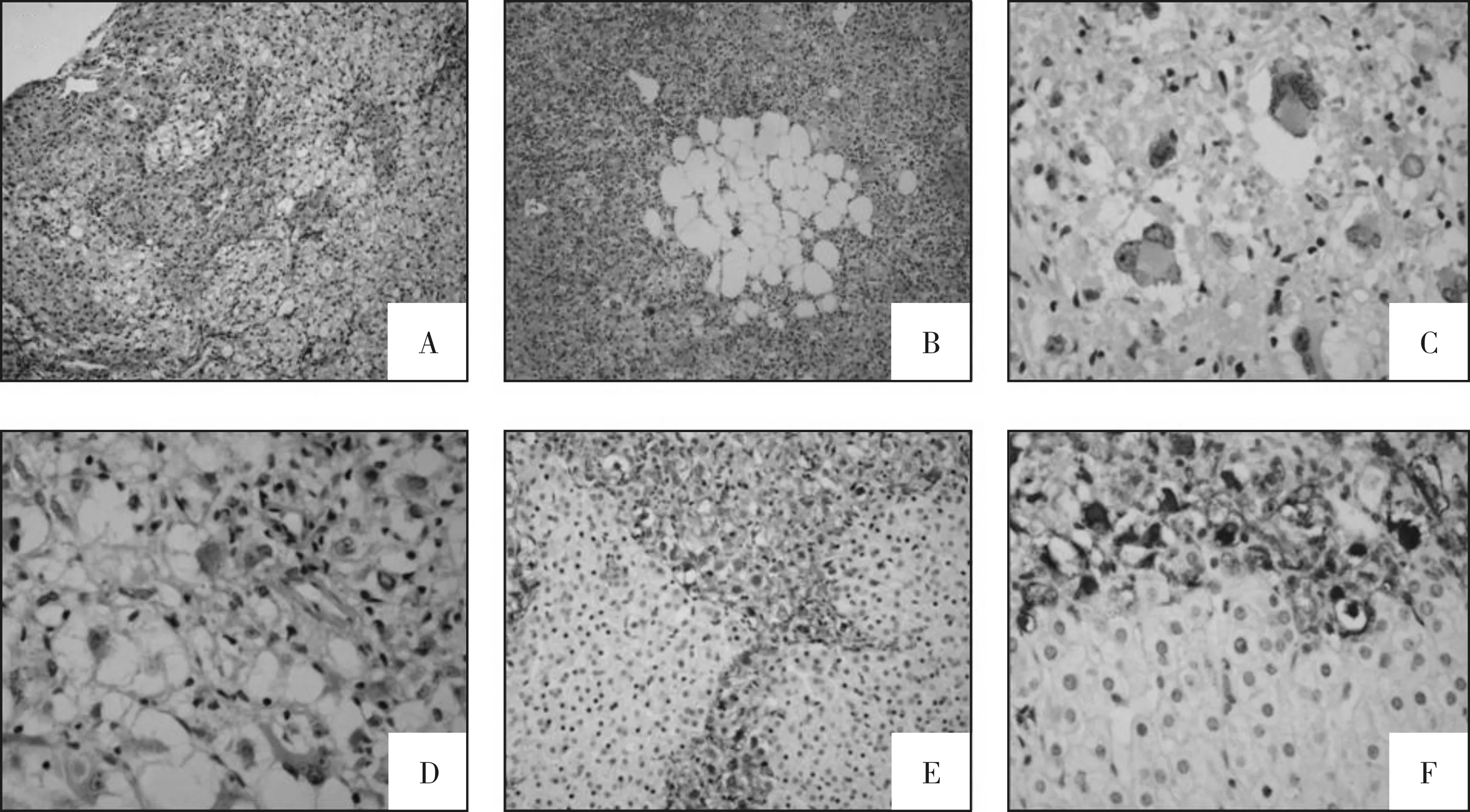
2.2.2 鏡檢 病例1:低倍鏡下腫瘤境界尚清,無包膜,呈膨脹性生長方式,高倍鏡下可見局部腫瘤組織與周邊肝組織相互交錯,但無破壞性浸潤。低倍鏡下腫瘤組織呈紅白相間的斑駁樣,片狀白色淡然區在高倍鏡下由泡沫樣組織細胞聚集組成,體積大,胞質豐富泡沫樣,核圓,大小一致,居中或偏位,無異型。大部分紅染區腫瘤細胞豐富,呈片狀分布,細胞中等大,多邊形,胞質中等,淡嗜酸或強嗜酸性,胞質內可見細小顆粒。核呈圓形或橢圓形,核大小輕度不等,染色質空淡,可見1~2個小核仁,局灶區腫瘤細胞及細胞核略呈梭形,與周邊上皮樣細胞移行,核形及胞質染色相似。背景中可見較多淋巴細胞呈散在或灶狀分布。腫瘤細胞間可見豐富的薄壁毛細血管和少量血竇樣腔隙,腫瘤細胞圍繞血管呈放射狀排列。部分區腫瘤細胞間可見出血現象伴陳舊性含鐵血黃色沉積。在腫瘤周邊或與肝組織交界處,腫瘤細胞密度中等,胞體顯著增大呈上皮樣,胞質呈淡粉染色或透亮,可見顆粒,個別細胞呈“蜘蛛樣”,整個腫瘤組織中未找見核分裂像。周圍肝組織可見肝脂肪變性,匯管區散在淋巴細胞和中性粒細胞浸潤(具體見圖1)。病例2:低倍鏡下腫瘤境界較清,但無包膜,高倍鏡下腫瘤組織周邊與周圍肝組織相互交錯,呈浸潤樣生長方式,局部腫瘤組織內甚至可見殘留的孤立肝細胞島。腫瘤細胞呈大-中等的多邊形上皮樣細胞,片狀分布,胞質豐富,嗜酸或者透亮。嗜酸性胞質呈細顆粒狀,并可見較多“蜘蛛樣”細胞,細胞界限相對較清。瘤細胞核呈圓形或橢圓形,核大小不等,在體積較大的上皮樣細胞中可見多核和奇異形核,核染色深,偶見核內包涵體,但未見核分裂像及病理性核分裂像。上皮樣細胞間散在多灶分布脂肪細胞成分,局灶腫瘤細胞及細胞核呈梭形且相互移行。腫瘤細胞間可見豐富的薄壁毛細血管和血竇樣腔隙及散在大的擴張的厚壁血管。灶性區腫瘤細胞間可見出血現象。腫瘤細胞背景中可見散在分布或小灶狀淋巴細胞聚集,周圍肝組織匯管區見少量散在淋巴細胞浸潤(具體見圖2)。
2.2.3 免疫組化 病例1:AE1/AE3-、VIM+、CK8-、CK7-、CK18-、CK19-、CK20-、CK68灶+、Lysozyme灶+、CD34血管+、CD117-、DOG-1-、Hepatocyte-、AFP-、CD10-、Melan-A強+(圖1E)、HMB-45+(圖1F)、S-100-、SMA+,Ki-67指數1%。病例2,AE1/AE3-、VIM+、CK7-、CK19-、AFP-、CD34血管+、CD117-、DOG-1-、Melan-A+(圖2E)、HMB-45強+(圖2F)、SMA+、S100脂肪細胞個別+、Ki-67指數1%。
3 討論
世界衛生組織定義PEComa為一種由具有特殊組織學形態和免疫組化特征的血管周上皮樣細胞(PEC)組成的間質性腫瘤[4]。 2003年WHO將其作為獨立的腫瘤類型確定,也統一了對其各種不同的疾病名稱,其目的也是為了消除困擾。但目前國內對發生于肺和腎外的PEComa家族腫瘤診斷命名仍不夠統一。
有學者認為PEComas可能來源PEC[5]。PEC的特征是分布于血管周圍,圍繞血管腔呈放射狀排列。仔細研究在PEComa家族腫瘤中均能發現具有診斷意義的特征性血管,PEC通常取代肌性血管管壁的平滑肌細胞和膠原纖維[6]。典型者越靠近血管腔,PEC形態越表現為上皮樣,而遠離血管腔的細胞則類似平滑肌細胞呈梭形細胞形態。部分PEC胞質內大量脂質而使細胞形態類似脂肪細胞或脂肪母細胞,這些脂肪樣細胞在腫瘤通常定位于更遠離血管的部位,有的將其稱為脂肪分化成分。雖然稱之為PEComa,但至今仍未在任何器官和組織的生理結構中找到可以識別的PEC成分,因此PEC的起源仍然不清。
肝臟部位原發PEComa家族腫瘤常見AML、PEComa-NOS和CCMMT。而后者發病率更低,國內文獻目前只有2篇報道肝臟鐮狀韌帶和圓韌帶CCMMT[7-8]。肝臟AML類似腎臟發生的AML,其特征包括:具有成熟的脂肪細胞、厚壁血管以及大小不等的梭形、肌樣、上皮樣細胞[9]。如腫瘤內以增生的上皮樣細胞為主,同時具有經典的AML的三種成分,則命名為上皮樣AML。上皮樣的腫瘤細胞可以具有明顯多形性和異型性,常有多核、巨核、畸形核和不規則核。病例2,具有AML的三種成分,以上皮樣細胞為主,因此診斷為上皮樣AML較妥當。事實上國內外文獻報道的肝臟AML大多為上皮樣型,這與腎臟原發AML以經典梭形細胞成分為主不同。如果腫瘤僅僅由上皮樣細胞或梭形肌樣細胞組成,而無脂肪樣細胞成分,則將之定義為PEComa-NOS更為妥當[10]。病例1,未見脂肪細胞成分,腫瘤組織成分主要為上皮樣細胞和豐富薄壁血管或血竇組成,而不是厚壁血管,腫瘤細胞在血管周圍圍繞管腔呈放射狀排列,因此診斷為PEComa-NOS更為合適。

注:A.HE 100×腫瘤組織邊界和肝組織相互交錯;B.HE 400×淡染區的泡沫樣組織細胞;C.HE 400×腫瘤組織周邊細胞顯著上皮樣,可見蜘蛛樣細胞;D.HE 400×腫瘤組織中央區,細胞豐富,體積中等;E.IHC Melan-A 100×;F.IHC HMB-45 400×。
圖1 病例1的HE染色及免疫組化圖
注:A.HE 100×腫瘤組織邊緣呈浸潤性生長;B.HE 100×灶性脂肪細胞分化區;C.HE 400×腫瘤細胞呈上皮樣,并可見多核巨細胞,核異型;D.HE 400×可見多量蜘蛛樣細胞;E.IHC Melan-A 400×;F.IHC HMB-45 400×。
圖2 病例2的HE染色及免疫組化圖
PEComa家族通常好發于中年女性,30~50歲之間,這與我們的病例一致。男女之比為1∶5,也有文獻報道發生于3歲的嬰兒[11],國內文獻尚沒有發生于嬰幼兒的報道。通常臨床上無特異性癥狀,血清學檢查也無異常。也有文獻報道患者因腫瘤巨大而出現右上腹脹痛不適甚至是急性腹痛而就診[12]。本文2例患者均是體檢時偶然發現肝臟占位,血清腫瘤指標均正常,病毒性肝炎指標均陰性。國內雖然文獻報道偶爾肝臟PEComa患者乙肝病毒檢測陽性[13],但大量的文獻研究PEComa發病與肝炎病毒并無相關性,考慮到我國人口中乙肝病毒攜帶的人群數量基數,這種個案的乙肝病毒陽性與PEComa的發病并無關聯性。大體上腫瘤好發于肝臟右葉,呈單發實性,偶有多個病灶,肝左右葉同時發生,國內偶有發生于肝門部的報道[14]。腫瘤體積不等,國內一項研究腫瘤最大徑可達26 cm[15]。腫瘤切面因不同成分所占比例不同變化較大,以上皮樣細胞和梭形細胞為主時,大體可呈灰紅色魚肉樣,以脂肪樣細胞為主時大體可呈黃色。肉眼觀腫瘤界限相對較清,但通常無包膜或包膜不完整,偶有文獻報道腫瘤有明確纖維性包膜[15]。免疫組化表型上,通常PEC特征性共表達黑色素細胞標記HMB-45和Melan-A及平滑肌細胞標記SMA。本文2例病例中這三種抗體均明顯呈陽性表達,符合PEComa的免疫表型。也有研究認為部分PEComa不同程度的表達TFE-3蛋白[16],然而Rao等[17]對23例PEComa標本進行FISH檢測,無1例表現出TFE-3的基因融合或者是基因放大,因此TFE-3在PEComa中的表達及TFE-3在PEComa中如何表達還有待進一步研究。
鑒別診斷:因肝臟PEComa腫瘤組織中不同成分比例變化較大,因此在組織形態學上通常需要與以下幾種腫瘤加以區分:(1)平滑肌腫瘤:胞質通常強嗜酸性,以梭形細胞為主,核呈雪茄煙樣,兩端頓圓,免疫組化不表達黑色素細胞標記HMB-45和Melan-A;(2)轉移性胃腸道上皮樣GIST:腫瘤細胞密度通常較高,轉移性者通常為惡性,可見較多核分裂及核異型,免疫組化CD34和CD117陽性,而不表達黑色素細胞標記,另外GIST通常缺乏PEComa特征性的竇樣血管和厚壁血管;(3)原發性肝細胞癌:上皮樣型者需與肝細胞癌鑒別,原發性肝細胞癌常伴有AFP升高和肝炎病毒檢測陽性,細胞異型顯著,壞死和核分裂像常見,癌細胞表達CK8/18和Hepatocyte。
肝臟PEComa 大多數表現出良好的生物學行為及預后,但近年來國內也相繼有多篇報道肝臟惡性PEComa[10,20,22]。關于惡性PEComa的標準尚未統一,2005年Flope等[18]總結并提出了PEComa暫行的良惡性標準:(1)良性:瘤體直徑小于5 cm,無浸潤性生長,無高的核分級和細胞密度,核分裂≤1/50 HPF,無壞死,無血管浸潤;(2)惡性潛能未定:僅有細胞多形性核/多核巨細胞;或僅有瘤體直徑大于5 cm;(3)惡性:瘤體直徑大于5 cm,浸潤性生長,高的核分級和高細胞密度,核分裂>1/50 HPF,壞死,血管浸潤,具有兩個或者更多上述指標。這些標準是基于對大多數軟組織和婦科原發非AML的PEComa而制定的,對于肝臟原發PEComa家族是否同樣適用還有待更多病例的檢驗。之前國內外文獻報道的肝臟惡性PEComa都至少具有上述診斷惡性的2個或2個以上特征。2004年WHO將腎臟原發上皮樣AML定義為具有惡性潛能的腫瘤,如果按照同樣的標準,對于肝臟原發上皮樣AML,不論腫瘤大小和有無異型及壞死,鑒于目前的病例數仍然不多,以期能夠獲得長期的臨床隨訪,在病理診斷時至少附上惡性潛能未定。對于經典三相型AML,即使出現細胞學的非典型性,仍然認為是良性的[19]。而發生于腎臟的上皮樣AML則1/3的患者發生轉移,偶爾導致患者死亡,尤其是顯示壞色和核非典型性的病例,是否表明發生于腎臟的上皮樣AML預后比腎外上皮樣AML差仍需大樣本量的研究與隨訪。本組2例腫瘤直徑均小于5 cm,但2例腫瘤均沒有包膜,高倍鏡下局部可見腫瘤組織與正常肝組織呈相互交錯的浸潤性生長,腫瘤組織與肝組織相對比較和諧,無破壞性浸潤的證據,亦無促纖維組織增生。病例2腫瘤局灶有細胞核的多形性和多核巨細胞,但無核分裂像,免疫組化顯示在多形性核的區域Ki-67指數均小于1%,提示局灶核的多形性可能是腫瘤細胞的退行性改變。白楊等[10]報道4例肝臟惡性PEComa腫瘤Ki-67指數達10%~20%,況麗平等[20]報道1例發生于年輕女性的惡性PEComa的Ki-67高達70%。而趙園園等[21]報道的7例生物學行為良性的肝臟PEComa腫瘤Ki-67指數平均1.3%(陽性范圍0~5%),這與本文2例病例較為符合。因此是否能以Ki-67指數5%作為判斷良惡性的一個標準,尚需大樣本量 的統計。上述文獻報道發生于肝臟的PEComa均無包膜,大部分隨訪無復發和轉移的病例均顯示腫瘤組織與周圍肝組織界限清楚,而診斷惡性PEComa的病例均顯示有浸潤性生長方式。本文2例病例隨訪至今均無復發和轉移,說明并無惡性生物學行為,因此2例病例雖然腫瘤組織周邊均有浸潤性生長的方式,但這種無破壞性浸潤生長的方式可能不能作為診斷惡性的依據。葉郁紅等[22]報道了1例肝臟復發性PEComa惡變的病例,2年前是以上皮樣細胞為主,無細胞異型和壞死,但腫瘤最大徑達13 cm,復發后腫瘤梭形細胞成分反而增多,細胞明顯異型和核分裂,按照Folpe的標準,2年前的腫瘤只能歸類于惡性潛能未定,而事實上其已經具有惡性生物學行為。2008 年,Nguyen 等[23]提出,肝臟惡性AML 的特征包括臨床侵襲性表現(如腫瘤轉移或腫瘤致死)、腫瘤>10 cm、凝固性壞死。國內文獻報道[10,20,22]的惡性肝臟PEComa腫瘤體積均>10 cm,均有中-重度細胞異型和腫瘤內出血、壞死。可見,Nguyen的診斷標準在肝臟原發PEComa中值得借鑒。
通過對2例原發于肝臟的上皮樣AML和PEComa-NOS并復習文獻分析可知,臨床及組織學需要與肝臟原發性肝細胞癌進行仔細鑒別。對于診斷肝臟PEComa家族的腫瘤,需要通過仔細檢查和必要的免疫組化方法來預測其生物學行為。無論PEComa為何種性質,目前主要治療方式為外科手術切除。對惡性或具有惡性潛能的PEComa,可以在手術后補充化療或放療,但缺乏足夠的病例支持,常規的化療效果也難以統計。對于診斷上皮樣AML的腫瘤即使沒有明顯的惡性特征,也應長期隨訪。本文中的2例患者均行肝臟契形切除術,術后未行特殊治療,隨訪至今,均未發生復發或轉移。
[1] MARTIGNONI G,PEA M,REGHELLIN D,et al.PEComas:the past,the present and the future[J].Virchows Arch,2008,452(2):119-132.
[2] FOLPE AL,KWIATKOWSKI DJ.Perivascular epithelioid cell neoplasms:pathology and pathogenesis[J].Hum Pathol,2010,41(1):1-15.
[3] ZHAO LJ,YANG YJ,WU H,et al.Perivascular epithelioid cell tumor of the liver:a case report and literature review[J].Eur Rev Med Pharmacol Sci,2013,17(12):1665-1668.
[4] FLETCHER CDM,UNNI KK,MERTENS F,et al.Pathology and genetics of tumours of soft tissue and bone[M].Lyon:IARC Press,2002:221-222.
[5] HORNICK JL,FLETCHER CD.PEComa:what do we know so far[ J].Histopathology,2006,48(1):75-82.
[6] FOLPE AL,MENTZEL T,LEHR HA,et al.Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin:a clinicopathologic study of 26 cases and review of the literature[J].Am J Surg Pathol,2005,29(12):1558-1575.
[7] 邢曉皖,螘國錚,王曉秋,等,肝圓韌帶透明細胞肌黑色素細胞瘤[J],臨床與實驗病理學雜志,2001,17(3):219-222.
[8] 董都選,石萍霞,李允利,等.肝鐮狀韌帶透明細胞肌黑色素瘤臨床病理觀察[J].診斷病理學雜志,2007,14(1):39-41.
[9] ARMAH HB,PARWANI AV.Perivascular epithelioid cell tumor[J].Arch Pathol Lab Med,2009,133( 4) :648-654.
[10] 白楊,孫璐,郭愛桃,等.肝惡性血管周上皮樣細胞腫瘤4例臨床病理分析[J].診斷病理學雜志,2014,21(2):73-75,79.
[11] FOLPE AL,GOODMAN ZD,ISHAK KG,et al.Clear cell myomelanocytic tumor of the falciform ligament/ligamentum teres:a novel member of the perivascular epithelioid clear cell family of tumors with a predilection for children and young adults[J].Am J Surg Pathol,2000,24 (9):1239-1246.
[12] PRIOLA AM,PRIOLA SM,CATALDI A,et al.Acute abdomen as an unusual presentation of hepatic PEComa.A case report[J].Tumori ,2009,95(1):123-128.
[13] 李曉紅,滕曉東,魏萍,等.肝臟血管平滑肌脂肪瘤臨床病理分析[J].浙江中西醫結合雜志,2009,4(19):202-204.
[14] 王剛,翟文龍,葉健文,等.肝門部及肝臟血管周上皮樣腫瘤2例報道并文獻綜述[J].中華消化病與影像雜志,2017,7(2):89-92.
[15] 鐘定榮,紀小龍,李向紅.14例肝血管平滑肌脂肪瘤病理形態分析[J/CD].中華病理學雜志(電子版),2000,29(4):10-13.
[16] DICKSON BC,BROOKS JS,PASHA TL,et al.Expression in tumors of the microphthalmia-associated transcription factor (MiTF) family[J].International Journal of Surgical Pathology,2010,19(1):26-30.
[17] RAO Q,CHENG L,XIA QY,et al.Cathepsin K expression in a wide spectrum of perivascular epithelioid cell neoplasms(PEComas):a clinicopathological study emphasizing extrarenal PEComas[J].Histopathology,2013,62(4):642-650.
[18] FLOPE AL,MENTZEL T,LEHR HA,et al.Perivascular epithelioid cell neoplasms of soft tissue and gynecologic origin:a clinicopathologic study of 26 cases and review of the literature[J].Am J Surg Pathol,2005,29(12):1558-1575.
[19] WEISS SW.Goldblum Jr[M].Enzinger & Weisss Soft Tissue Tumors,2001:586-587.
[20] 況麗平,周厚強,沈金輝,等,肝惡性血管周上皮樣細胞腫瘤臨床病理觀察[J].診斷病理學雜志,2016,23(9):680-683.
[21] 趙園園,徐恩偉,李靜.肝臟血管周上皮樣腫瘤7 例報告并文獻復習[J].中國腫瘤臨床,2015,42(22):1100-1102.
[22] 葉郁紅,張聲,王行富.肝臟惡性血管周上皮樣細胞瘤臨床病理觀察[J].中國現代醫生雜志,2009,47(32):98-100.
[23] NGUYEN TT,GORMAN B,SHIELDS D,et al.Malignant hepatic angiomyolipoma:report of a case and review of literature[J].Am J Surg Pathol,2008,32(5):793-798.

