棉花GhFAD2-1基因5’UTR內含子的克隆與序列分析
孫 亮,文 鳳,劉 峰,張新宇,孫 杰
(石河子大學農學院,新疆石河子 832000)
0 引 言
【研究意義】在棉籽中,Δ12-油酸去飽和酶基因GhFAD2-1是控制油酸向亞油酸轉化的關鍵酶基因,對棉籽中多不飽和脂肪酸的含量與比例起著重要的調控作用[1]。GhFAD2-1上游序列所包含的調控元件等是對其組織特異性、作用強弱和時空表達進行精確調控的關鍵。對GhFAD2-1上游序列相關轉錄調控元件及調控作用的識別成為理解其表達機制的必要步驟。研究克隆并分析棉花GhFAD2-1上游5'UTR內含子序列,對研究GhFAD2-1時空表達特性及調控的分子機制具有重要的意義。【前人研究進展】包括陸地棉(G.hirsutum)、海島棉(G.barbadense)、雷蒙德氏棉(G.raimondii)以及魯賓遜氏棉(G.robinsonii)等棉屬的FAD2-1基因的上游序列都含有一個位于5'非翻譯區(qū)(5'UTR)的內含子[2];GhFAD2-1的啟動子序列則位于該5'UTR內含子的上游,由于GhFAD2-1的上游區(qū)域含有內含子,所以增加了其表達調控的復雜性。一直以來對其調控序列研究的不夠深入。基因編碼區(qū)的上游序列在很大程度決定著目的基因表達的時間、空間和強度。內含子是基因組中的一種重要元件,其對轉錄及轉錄后水平的基因表達水平起著重要的調控作用[3-4]。從目前已有的研究結果中,尚不能準確判定GhFAD2-1基因轉錄起始位點,5'UTR區(qū)內含子的剪切位點,其具體堿基序列及片段長度等。【本研究切入點】農業(yè)生產栽培的棉花主要是四倍體的陸地棉(G.hirsutum),其基因組AADD數據及相關基因編碼序列等已經公布在棉花基因組數據庫(http://www.cottongen.org)、NCBI等中,為研究進行序列比對分析奠定基礎。【擬解決的關鍵問題】研究基于陸地棉GhFAD2-1基因編碼區(qū)序列,設計特異性引物,通過進行5' RACE 擴增,獲得完整的GhFAD2-1非翻譯區(qū)(5'UTR)全長序列。通過結合5'-RACE獲得GhFAD2-1基因的5'-端核苷酸序列與基因組擴增GhFAD2-1序列進行比較,獲得GhFAD2-1基因5'-端UTR區(qū)域內的內含子序列,并對其進行作用原件分析,為進一步研究GhFAD2-1基因的表達與調控奠定基礎。
1 材料與方法
1.1 +材 料
棉花(Gossypiumhirsutum)品種新陸早33號、大腸桿菌菌株E.coliDH5α等均為實驗室保存。克隆載體pMD18-T、ExTaqDNA聚合酶、Clontech SMART RACE cDNA Amplification Kit、限制性內切酶、DNA Marker等購自大連寶生物公司。DNA凝膠回收試劑盒、Plant RNA快速提取試劑盒(離心柱型)等購自天根生化有限公司;其他試劑均為國產和進口分析純。
1.2 方 法
1.2.1 5'-RACE獲得GhFAD2-1基因的5'-端
取新陸早33號花后15 d的棉花種子,去除外層軟殼后,將棉仁在研缽中用液氮冷激后快速研磨,將粉末快速裝入RNase-free的離心管中,保證樣品不溶解,并讓液氮揮發(fā),采用高純總RNA快速提取試劑盒提取總RNA。
根據GenBank中已報道的棉花GhFAD2-1基因編碼區(qū)的序列信息,利用Primer Premier 6設計特異性擴增引物FAD2-1-R: 5'-GGATGCAACCTTGGAGAACC-3';引物由上海生工公司合成。參照Clontech SMART RACE cDNA Amplification Kit說明,合成獲得5'-RACE-Ready cDNA。以5'-RACE-Ready cDNA為模板,以已設計的特異性引物FAD2-1-R和5'-RACE Kit 中提供的UPM引物組成配對引物,進行PCR反應。PCR產物于1%的瓊脂糖凝膠中,3 V/cm電泳45 min后,在紫外凝膠成像系統中觀測目的條帶。獲得清晰的預期目標條帶,進行膠回收。膠回收操作步驟參照天根生物公司膠回收試劑盒說明書。參照Takara公司pMD18-T Vector試劑盒說明將回收目的片段連接到pMD18-T Vector上。轉化大腸桿菌DH5α,篩選抗Amp菌落,同時進行菌落PCR鑒定。挑選6個PCR陽性克隆送華大基因公司測序。
1.2.2GhFAD2-1基因的5'-端UTR內含子克隆與序列分析
以5'-RACE獲得GhFAD2-1基因的5'-端核苷酸序列為基礎:以轉錄起點處設計PCR特異性擴增上游引物;以翻譯起始點處設計PCR特異性擴增下游引物。應用植物基因組提取試劑盒提取新陸早33號葉片基因組DNA。以新陸早33號基因組DNA為模板,進行PCR反應;PCR 產物于1%的瓊脂糖凝膠中,3 V/cm 電泳45 min 后,在紫外凝膠成像系統中觀測目的條帶。膠回收、PCR鑒定等方法同上。挑選6個PCR陽性克隆送華大基因公司測序。
對比分析5'-RACE獲得GhFAD2-1基因的5'-端核苷酸序列與上述基因組擴增的特異序列,鑒定出GhFAD2-1基因的5'-端UTR區(qū)域內的內含子序列,并對其進行生物信息學分析。順式作用元件采用http://www.dna.affrc.go.jp/PLACE/以及http://bioinformatics.psb.ugent.be/webtools/plantcare/html/在線分析。
2 結果與分析
2.1 GhFAD2-1基因5端序列的克隆
應用高純總RNA快速提取試劑盒(離心柱型)提取獲得高質量的總RNA(圖1);采用Clontech SMART RACE cDNA Amplification Kit將總RNA轉錄成cDNA。以反轉錄的cDNA為模板進行PCR擴增,在350 bp左右出現目標條帶(圖2)。取PCR陽性克隆進行測序。測序結果表明,cDNA擴增出兩條序列,片段大小為362 bp。與GhFAD2-1基因編碼區(qū)序列(GenBank: HQ259410)有285 bp 的重疊片段,表明GhFAD2-1基因5'端非翻譯區(qū)(5'-untranslated region, 5'-UTR)長77 bp,轉錄的起點堿基為T(圖3)。圖1~3
圖1 新陸早33號提取的總RNA檢測
Fig.1 The detection of total RNA of xinluzao33
圖2 5'-RACE擴增目標序列
Fig.2 5'-RACE technique of target sequence

圖3 5'-RACE獲得GhFAD2-1基因的5'-端序列
Fig.3 The 5'- end sequence of GhFAD2-1 was obtained by 5'-RACE technique
2.2GhFAD2-1基因5'UTR內含子克隆及序列
以新陸早33號基因組DNA為模板,以5'-RACE獲得GhFAD2-1基因的5'-端核苷酸序列的轉錄起點為基礎設計的特異性上游引物FAD2-1-5F: 5'-TCGCCCAAAACCAACACGCCT-3';以翻譯起始點處設計特異性擴增下游引物FAD2-1-5R: 5'-CATCCTACCACCGGCACC-3'。PCR擴增產物電泳顯示約在1 200 bp左右出現特異性條帶(圖4)。采用T-A克隆方法將PCR產物與pMD18-T連接、轉化;6個PCR陽性克隆測序表明,所克隆獲得的片段分成了兩類:有4個克隆序列完全一致,片段全長為1 209 bp;另外2個克隆序列完全一致,片段全長為1 201 bp;兩者有174個堿基差異(圖5)。由于棉花是異源四倍體(AADD基因組);研究表明,擴增獲得的高度同源的片段可能分別來源于A或D基因組。進一步對比棉花基因組數據庫(http://www.cottongen.org)中的GhFAD2-1基因組的序列進行分析;結果表明,片段全長為1 201 bp與棉花基因組數據庫中Gh_A13G1850(GhFAD2-1)的序列相吻合,表明該序列來源于A基因組。片段全長為1 209 bp與棉花基因組數據庫中Gh_A13G1850(GhFAD2-1)的序列存在較多的堿基差異,推測其可能來源于D基因組。將其于棉花基因組數據庫中Gh_D13G2238(GhFAD2-1)的序列進行對比分析;研究表明,兩者的序列與較好的一致性,表明所克隆的1 209 bp序列來源于D基因組。值得注意的是,通過1 209 bp序列與基因組數據庫中GhFAD2-1(Gh_D13G2238)的5'序列對比分析表明,棉花基因組數據庫中Gh_D13G2238(GhFAD2-1)基因的上游出現冗余重復信息(位于起始密碼子上游-1 880 bp~-693 bp),該序列全長1 187 bp;綜合GhFAD2-1的5'RACE與基因組擴增研究結果,可以判定棉花基因組數據庫中Gh_D13G2238(GhFAD2-1)基因上游的序列在基因組測序時或基因組組裝過程中,出現了錯誤。當將棉花基因組數據庫中Gh_D13G2238(GhFAD2-1)基因的上游的錯誤重復冗余1 187 bp序列刪除后,其序列就與所克隆獲得的片段全長為1 209 bp的序列完全一致。
結合5'-RACE獲得GhFAD2-1基因的5'-端核苷酸序列與基因組擴增獲得序列,進一步分析比較。研究表明,位于A基因組的GhFAD2-1基因5'-端UTR區(qū)域內的內含子序列全長1 103 bp;位于D基因組的GhFAD2-1基因5'-端UTR區(qū)域內的內含子序列全長1 111 bp(圖5)。A和D基因組的GhFAD2-1基因5'-端UTR區(qū)域內的內含子的剪切位點相同,5'-端UTR內含子兩個剪切位點分別AA-GG、CA-GC。這表明,該內含子剪切位點不具有GT-AG規(guī)則,并且序列中富含AT,其剪切位點可能為一新的剪切方式。
使用PlantCARE 在線分析克隆到的GhFAD2-1 5'-端UTR內含子序列的順式作用元件,結果表明,在A基因組和D基因組序列中都具有與激素相關的作用原件:乙烯應答元件ERE(ATTTCAAA)和赤霉素響應元件P-box(CCTTTTG),以及脅迫等相關的作用元件,如干旱誘導元件MBS(TAACTG)、防御和應激反應元件TC-rich repeats(ATTTTCTTCA)等。GhFAD2-1 5'-端UTR內含子序列還含有與光響應相關的作用元件Box I(TTTCAAA)、GT1-motif(GGTTAA)、ATCT-motif(AATCTAATCC)等。在A基因組和D基因組序列中都還具有種子特異的表達元件GCN4_motif(CAAGCCA),這也與GhFAD2-1在種子優(yōu)勢表達這一組織特異性表達相一致。此外,在D基因組中,GhFAD2-1 5'-端UTR內含子序列還包含高效轉錄作用元件5UTR Py-rich stretch(TTTCTCTCTCTCTC)。GhFAD2-1 5'-端UTR內含子序列包含的主要順式作用元件及其在內含子序列上的位置。圖4,圖5,表1
圖4 PCR擴增目標序列
Fig.4 PCR amplification of target sequence

注:5'UTR_intron_A: 棉花D基因組GhFAD2-1基因5'-UTR及內含子; 5'UTR_intron_D: 棉花D基因組GhFAD2-1基因5'-UTR及內含子紅色字體為堿基差異;加粗字體為起始密碼子;下劃線為基因組PCR擴增相對應的引物序列;aaGG、CAgc分別為5'-端UTR內含子兩個剪切位點
Note: 5'UTR_intron_A: 5'- terminal UTR and intron sequence of GhFAD2-1from a A-genome cotton; 5'UTR_intron_D: 5'- terminal UTR and intron sequence of GhFAD2-1from a D-genome cotton; Red fonts represents base differences; The bold font represents the start codon; The underline is the sequence corresponding to the primers; The aaGG and CAgc are two 5'- terminal UTR intron splice site, respectively
圖5 GhFAD2-1基因5'-端UTR及內含子
Fig.5 5'-UTR and intron sequence of GhFAD2-1
表1 GhFAD2-1 5'UTR內含子區(qū)順式調控元件
Table 1 The cis regulatory elements of GhFAD2-1 5'UTR intron
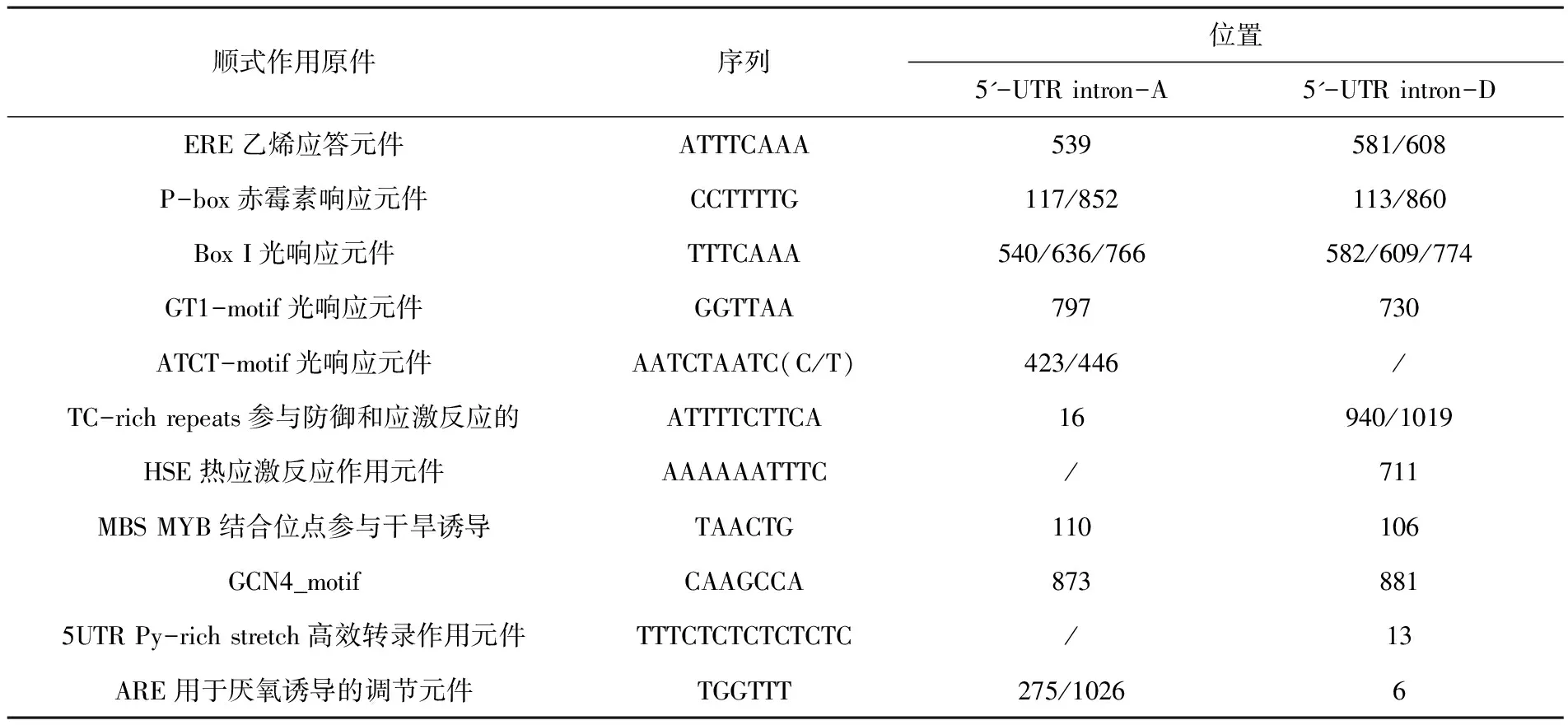
順式作用原件序列位置5'-UTRintron-A5'-UTRintron-DERE乙烯應答元件ATTTCAAA539581/608P-box赤霉素響應元件CCTTTTG117/852113/860BoxI光響應元件TTTCAAA540/636/766582/609/774GT1-motif光響應元件GGTTAA797730ATCT-motif光響應元件AATCTAATC(C/T)423/446/TC-richrepeats參與防御和應激反應的ATTTTCTTCA16940/1019HSE熱應激反應作用元件AAAAAATTTC/711MBSMYB結合位點參與干旱誘導TAACTG110106GCN4_motifCAAGCCA8738815UTRPy-richstretch高效轉錄作用元件TTTCTCTCTCTCTC/13ARE用于厭氧誘導的調節(jié)元件TGGTTT275/10266
3 討 論
研究基于陸地棉GhFAD2-1基因編碼區(qū)序列,通過進行5' RACE 擴增,結合基因組PCR擴增序列進行比較,分別克隆獲得了A、D基因組的GhFAD2-1基因5'UTR內含子序列。通過序列比對分析,發(fā)現了D基因組GhFAD2-1基因基因的上游出現冗余重復信息(位于起始密碼子上游-1 880 bp~-693 bp),該序列全長1 187 bp,可能是由于基因組測序或組裝過程中導致的錯誤冗余信息。克隆獲得的內含子序列富含AT,對棉花GhFAD2-1基因5'UTR內含子區(qū)順式調控元件進行分析,發(fā)現其包括一些典型的與光響應相關的作用元件如Box I(TTTCAAA)、GT1-motif(GGTTAA)等;以及與激素(乙烯、赤霉素)和脅迫因素相關的應答元件等。這也與相關研究認為棉花等植物的FAD2基因的轉錄水平受到多種激素和非生物脅迫等因素的影響相一致[4-7]。
內含子是基因組中的一種重要元件,在許多植物中都已證實內含子的存在可以顯著增強基因的轉錄效率,如在單子葉植物中能夠提高基因表達量的內含子有來自玉米的Adh1、Sh1、Bz1、Hsp82、Actin、Ubi1和GapA1基因等[8-10]和來自水稻的SalT、Act1、OsTubA1和OsCDPK2基因等[11-12];在雙子葉植物中可以提高表達量的內含子有來自矮牽牛的RbcS基因[13]和馬鈴薯的ST-LS1基因等[14]。內含子介導的增強效應一般在2~10倍左右,有的甚至可提高基因表達100倍以上[11]。尤其是當內含子位于轉錄本5'UTR時,可以顯著增強基因的轉錄效率[15]。同時,不同內含子對同一基因表達增強的程度不同,玉米Shl基因的內含子1可以使報告基因表達水平增強40倍,而玉米Adhl基因的內含子1使報告基因的表達水平僅提高4倍。Adhl基因的內含子2和6均能不同程度的增強報告基因的表達水平,但內含子9卻不能[16]。對于研究獲得的棉花GhFAD2-1的5'UTR內含子是否發(fā)揮轉錄增強子的功能,其對所調控基因的轉錄程度的影響如何,仍有待于進一步研究。此外,D基因組5'UTR內含子序列中,具有高效轉錄作用元件5UTR Py-rich stretch,對于棉花GhFAD2-1在棉籽中是否是D亞組表達量高于A亞組表達量,也有待于進一步分析。對棉花GhFAD2-1基因的上游的調控序列的克隆研究,有助于進一步在分子水平上研究GhFAD2-1基因功能及其表達調控規(guī)律,進而為植物的遺傳改良奠定了基礎。
4 結 論
研究利用5'RACE技術,克隆獲得棉花Δ12-油酸去飽和酶基因GhFAD2-1的5'UTR序列:GhFAD2-1成熟mRNA的5' UTR為77 bp;通過進一步分析棉花基因組序列,進而再利用PCR技術克隆獲得GhFAD2-1的5'UTR內含子序列:在棉花的A、D基因組中,GhFAD2-1的5' UTR中各含有一個全長分別為1 103 bp、1 111 bp的內含子序列;其轉錄的起點堿基為T;5' UTR內含子兩個剪切位點分別AA-GG、CA-GC。作用元件分析表明,內含子包括一些典型的與光響應相關的作用元件,以及與激素和脅迫因素相關的應答元件等。該研究的結果為進一步在分子水平上研究GhFAD2-1功能及其表達調控規(guī)律,進而為植物的遺傳改良奠定了基礎。
)
[1] Shanklin, J., & Cahoon, E. B. (1998). Desaturation and related modifications of fatty acids1.AnnualReviewofPlantPhysiology&PlantMolecularBiology, 49(49): 611-641.
[2] Liu, Q., Brubaker, C. L., Green, A. G., Marshall, D. R., Sharp, P. J., & Singh, S. P. (2001). Evolution of the fad2-1 fatty acid desaturase 5' utr intron and the molecular systematics of gossypium (malvaceae).AmericanJournalofBotany, 88(1): 92-102.
[3] 牛俊奇,吳朝興,楊麗濤,等. 甘蔗SoNIN1基因結構及其內含子信息分析[J]. 生物技術通報,2014,(12):147-152.
Niu Jun-qi, Wu Chao-xing, Yang Li-tao, et al. (2014). Analysis of Genomic Structure and Introns of SoNIN1 Gene from Sugarcane [J].BiotechnologyBulletin, (12):147-152. (in Chinese)
[4] 李秀蘭,姜曰水. 高等植物細胞器Ⅱ類內含子剪接的研究進展[J]. 植物生理學報,2017,53(8):1 365-1 371.
LI Xiu-Lan, JIANG Yue-Shui. (2017). Research progress of group II intron splicing in higher plant organelles [J].PlantPhysiologyJournal, 53(8):1,365-1,371. (in Chinese)
[5] Zhang, J., Liu, H., Sun, J., Li, B., Zhu, Q., & Chen, S., et al. (2012). Arabidopsis fatty acid desaturase fad2 is required for salt tolerance during seed germination and early seedling growth.PlosOne, 7(1): e30355.
[6] Matteucci, M., D'Angeli, S., Errico, S., Lamanna, R., Perrotta, G., & Altamura, M. M. (2011). Cold affects the transcription of fatty acid desaturases and oil quality in the fruit of olea europaea l. genotypes with different cold hardiness.JournalofExperimentalBotany, 62(10): 3,403-3,402.
[7] Kargiotidou, A., Deli, D., Galanopoulou, D., Tsaftaris, A., & Farmaki, T. (2008). Low temperature and light regulate delta 12 fatty acid desaturases (fad2) at a transcriptional level in cotton (gossypium hirsutum).JournalofExperimentalBotany, 59(8): 2,043-2,056.
[8] Donath, M., Mendel, R., Cerff, R., & Martin, W. (1995). Intron-dependent transient expression of the maize gapa1, gene.PlantMolecularBiology,28(4): 667-676.
[9] Callis, J., Fromm, M., & Walbot, V. (1987). Introns increase gene expression in cultured maize cells.Genes&Development, 1(10): 1,183-1,200.
[10] Maas, C., Laufs, J., Grant, S., Korfhage, C., & Werr, W. (1991). The combination of a novel stimulatory element in the first exon of the maize shrunken-1 gene with the following intron 1 enhances reporter gene expression up to 1,000-fold.PlantMolecularBiology, 16(2): 199-207.
[11] Morello, L., Bardini, M., Cricrì, M., Sala, F., & Breviario, D. (2006). Functional analysis of dna sequences controlling the expression of the rice oscdpk2, gene.Planta, 223(3): 479-491.
[12] Jeon JongSeong, Lee SiChul, Jung KiHong, Jun SungHoon, Kim ChanHong, & An GynHeung. (2000). Tissue-preferential expression of a rice α-tubulin gene, ostuba1, mediated by the first intron.PlantPhysiology, 123(3): 1,005-1,014.
[13] Dean, C., Favreau, M., Bond-Nutter, D., Bedbrook, J., & Dunsmuir, P. (1989). Sequences downstream of translation start regulate quantitative expression of two petunia rbcs genes.PlantCell, 1(2): 201-208.
[14] Leon, P., & Walbot, V. (1991). Transient gene expression in protoplasts of phaseolus vulgaris isolated from a cell suspension culture.PlantPhysiology, 95(3): 968-972.
[15] Bourdon, V., Harvey, A., & Lonsdale, D. M. (2001). Introns and their positions affect the translational activity of mrna in plant cells.EmboReports, 2(5): 394-398.
[16] Vasil, V., Clancy, M., Ferl, R. J., Vasil, I. K., & Hannah, L. C. (1989). Increased gene expression by the first intron of maize shrunken-1 locus in grass species.PlantPhysiology, 91(4): 1,575-1,579.

