Thermal Shift高通量篩選法快速篩選覆盆子中雌激素樣活性化合物*
張中群 ,張 競 ,劉永彬 ,王 彧 ,柴 欣
覆盆子為薔薇科植物華東覆盆子(Rubus chingii Hu)的干燥果實,具有強壯、補益、補腎壯陽的功效[1]。現代藥理研究表明覆盆子具有抗氧化、抗炎、抗血栓、抗腫瘤等活性,其主要含有黃酮類、萜類、甾體類、酚酸類等化合物[2]。
Thermal Shift Assay是近年新發展的一種基于熒光技術的快速檢測方法[3],通過實時檢測蛋白熒光染料(如Sypro Orange)的熒光信號觀察蛋白的熱穩定性[4]。Protein Thermal Shift方法不僅可以快速測定蛋白熱穩定性,還可以作為一個高效的篩選工具[5],篩選對蛋白有作用的配體化合物。不同配體對蛋白熱穩定性的影響不同,有的提高蛋白熱穩定性,有的則降低蛋白熱穩定性[6],在實驗過程中通過觀察蛋白的熔解溫度(Tm)判斷配體化合物對蛋白的作用強弱。
覆盆子具有抗骨質疏松作用[7],與其化學成分的雌激素樣活性相關[8-9],研究表明覆盆子的乙酸乙酯部位具有較強的雌激素樣作用,顯著促進MCF-7細胞增殖[10]。本研究采用Thermal Shift高通量篩選方法,對覆盆子中的10個主要化學成分(覆盆子酸、山柰酚、山柰酚-3-O-蕓香糖苷、山柰酚-3-O-葡萄糖苷、山柰酚-3-O-洋槐糖苷、槲皮素-3-O-洋槐糖苷、蘆丁、異槲皮苷、金絲桃苷和短葉蘇木酚酸)進行篩選。
1 材料
1.1 質粒與菌株 pET-32a、pET-28a由南開大學郭宇副教授課題組惠贈;DH5α、BL21(DE3)感受態細胞購自全式金生物技術有限公司。優化的hERα、hERβ基因由蘇州金唯智生物科技有限公司合成并構建至pUC-57載體中。
1.2 藥物與試劑 覆盆子酸、山柰酚、山柰酚-3-O-蕓香糖苷、山柰酚-3-O-葡萄糖苷、山柰酚-3-O-洋槐糖苷、槲皮素-3-O-洋槐糖苷、蘆丁、異槲皮苷、金絲桃苷和短葉蘇木酚酸為本實驗室自制;瓊脂糖凝膠DNA回收試劑盒、快速質粒小提試劑盒購自天根生化科技有限公司;Sal I、BamH I、Nde I限制性核酸內切酶為Thermo公司產品;LB Broth、氯化鈉、甘油、咪唑、氨芐青霉素、卡那霉素、IPTG、Tris、Heps購自上海生工生物科技有限公司;Ni-NTA純化介質,Hi-Trap Heparin柱購自GE Healthcare;雌二醇(E2)、SYPRO?Orange Protein Gel Stain dye購自Sigma Aldrich。
1.3 儀器 高壓破菌機(JNBIO,中國);AKTA Explore蛋白純化系統(GE Healthcare);Real-Time PCR(LightCycler?480,羅氏)。
2 方法
2.1 hERα-LBD、hERβ-LBD基因擴增 采用primer引物設計軟件,通過編碼hERα-LBD、hERβ-LBD的基因序列設計 hERα-LBD、hERβ-LBD 擴增的上、下游引物。hERα-LBD(上游引物:5'-GCGGATCCAAGAAAAACAGCCTGGC-3',下游引物:5'-TTGTCGACTTACGGTGCATGTAAACGGTGT-3)和hERβ-LBD(上游引物:5'-TTCATATGATGGATATCAAGAATAGCCCG-3',下游引物:5'-ATGGATCCTTACTGACTCTGCGGATTCTG-3')。以人工合成的 hERα、hERβ全長基因為模板,擴增hERα-LBD、hERβ-LBD基因片段。PCR擴增條件為:94℃預變性5 min,95℃變性 50 s,58℃退火 50 s,72℃延伸 2 min,30個循環。通過瓊脂糖凝膠電泳檢測擴增產物。
2.2 原核表達重組質粒的構建 采用瓊脂糖凝膠電泳檢測擴增產物,瓊脂糖凝膠DNA回收試劑盒回收擴增產物。將pET32a質粒和hERα-LBD擴增產物分別用BamHⅠ和SaLⅠ雙酶切;pET28a質粒和hERβ-LBD擴增產物分別用NdeⅠ和BamHⅠ雙酶切,回收基因和質粒。將基因與載體連接轉化DH5a感受態細胞,提取質粒并雙酶切鑒定為陽性克隆后測序驗證插入序列的完整性和正確性。
2.3 重組質粒轉化 取兩支100 μL BL21(DE3)商業感受態細胞,分別加入1 μL pET32a、pET28a重組質粒,冰浴30 min,42℃熱激90 s,再次冰浴6 min,隨后轉入1 mL無抗LB液體培養基中,37℃振蕩培養1 h使細胞復蘇,取200 μL涂固體LB平板,37℃培養箱中過夜培養。
2.4 hERα-LBD、hERβ-LBD 重組蛋白的表達純化 將 hERα-LBD 或 hERβ-LBD BL21(DE3)陽性轉化子接種到5 mL帶有抗性的LB液體培養基(含100 μg/mL氨芐青霉素或50 μg/mL卡那霉素)培養5h,紫外可見分光光度計600nm檢測,當吸光度A值為0.6時轉入800 mL LB液體培養基(含100 μg/mL氨芐青霉素或50 μg/mL卡那霉素)中37℃繼續振蕩培養。當600 nm的吸光度A值為0.6時,降溫至16℃然后加入0.25 mmol/L IPTG誘導培養16 h。4 000 g,4℃條件下,離心15 min倒掉上清液,加入適量體積的裂解緩沖液(hERα-LBD:20 mmol/L Hepes、300 mmol/L NaCl、10%甘油、pH 7.5;hERβ-LBD:20 mmol/L Tris-HCl、300 mmol/L NaCl、10%甘油、pH 8.5)振蕩重懸收集細胞。收集后的細胞采用高壓破菌機4℃循環破碎,25 000 g離心30 min,取上清液。采用預處理的Ni-NTA親和層析柱處理上清液,裂解緩沖液(含50 mmol/L咪唑)去除雜質蛋白,含500 mmol/L咪唑的裂解緩沖液洗脫目的蛋白。目的蛋白濃縮后,4℃條件下10 000 g離心10 min,取上清液,采用AKTAExploer層析系統進一步純化。hERα-LBD 流動相為(緩沖液 A:20 mmol/L Hepes、50 mmol/L NaCl、5%甘油,pH 7.5,緩沖液 B:20 mmol/L Hepes、1 mol/L NaCl、5%甘油,pH 7.5);hERβ-LBD 流動相為(緩沖液 A:20 mmol/L Tris-HCl、50 mmol/L NaCl、5%甘油,pH 8.5,緩沖液 B:20 mmol/L Tris-HCl、1 mol/L NaCl、5%甘油,pH 8.5)。收集純化后的流分并取樣用于SDS-PAGE分析。
2.5 Thermal Shift Assays 候選化合物覆盆子酸、山柰酚、山柰酚-3-O-蕓香糖苷、山柰酚-3-O-葡萄糖苷、山柰酚-3-O-洋槐糖苷、槲皮素-3-O-洋槐糖苷、蘆丁、異槲皮苷、金絲桃苷、短葉蘇木酚酸以及陽性對照E2分別用二甲基亞砜(DMSO)配制成100 mmol/L 的母液,備用。hERα-LBD、hERβ-LBD、Sypro Orange、候選化合物分別用相應的儲存緩沖液(hERα-LBD測試體系:含20mmol/LHepes,300mmol/L NaCl,pH 7.5;hERβ-LBD 測試體系:含 20 mmol/L Tris-HCl,300 mmol/L NaCl,pH 8.5)稀釋,分別將兩個蛋白稀釋至10 μmol/L,化合物稀釋至100 μmol/L。候選化合物與蛋白溶液以1∶1(v/v)混勻后加入96孔板中,每孔20 μL,平行設置3個復孔,冰上孵育30 min,避光加入稀釋后的 Sypro Orange1 μL(商品母液稀釋1000倍),封膜,在4℃條件下1000 g,離心2 min使孔內無氣泡。以E2為陽性對照,以含蛋白的緩沖液的為陰性對照,以儲存緩沖液為空白對照。采用 Real-Time PCR-LightCycler?480 系統通過連續測定20~95℃過程中SYPRO Orange染料的熒光強度變化從而監測蛋白的去折疊過程。采用LightCycler?480 軟件(V1.5.0,Roche)擬合熔解曲線、計算蛋白熔化溫度(Tm)。
3 結果
3.1 hERα-LBD、hERβ-LBD 重組蛋白 SDS-PAGE蛋白經AKTA Exploer層析系統進一步純化,收集流分,每500 μL為一個流分,采用SDS-PAGE對hERα-LBD、hERβ-LBD 重組蛋白進行分析,分析結果如圖1所示。
由圖 1可見 hERα-LBD、hERβ-LBD 大小與目的蛋白一致且純度均在95%以上,可用于進一步配體結合實驗。合并流分用30 kD超濾離心管濃縮并換液到儲存緩沖液中,Nanodrop2000測得hERα-LBD的濃度為 6 mg/mL,hERβ-LBD的濃度為3.5 mg/mL,液氮瞬間冷凍,-80℃保存。
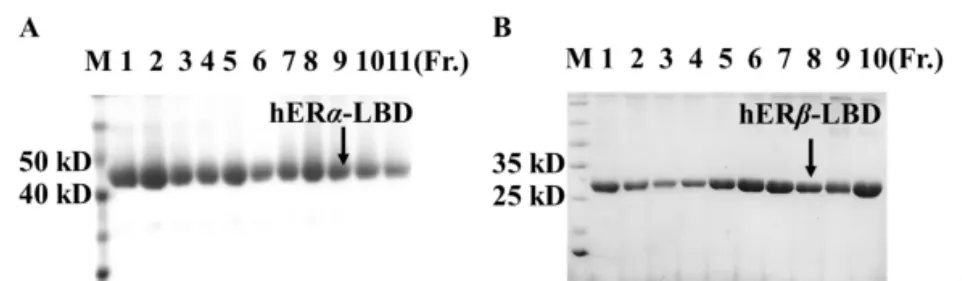
圖1 hERα-LBD(A)、hERα-LBD(B)的SDS-PAGE結果(M:Marker)Fig.1 SDS-PAGE results of hERα-LBD(A)and hERα-LBD(B)(M:Marker)
3.2 候選化合物對受體蛋白熱穩定性的影響 蛋白隨溫度升高會發生解鏈從而暴露出疏水性氨基酸,利用這一特性,可以特異性的添加一些僅與暴露的疏水性氨基酸結合的蛋白熒光染料,通過實時檢測熒光信號即可觀察蛋白的熱穩定性狀況。本實驗根據PCR-LightCycler480系統檢測到的蛋白熔解熒光信號隨溫度的實時變化,結合候選化合物對hERα-LBD 或 hERα-LBD 的 Thermal Shift圖像,計算出候選化合物對hERα-LBD或hERα-LBD的熔化溫度變化(ΔT)。以ΔT為指標篩選具有作用的配體化合物,結果如圖2所示,當ΔT>2時為對受體蛋白具有作用的配體化合物[6]。
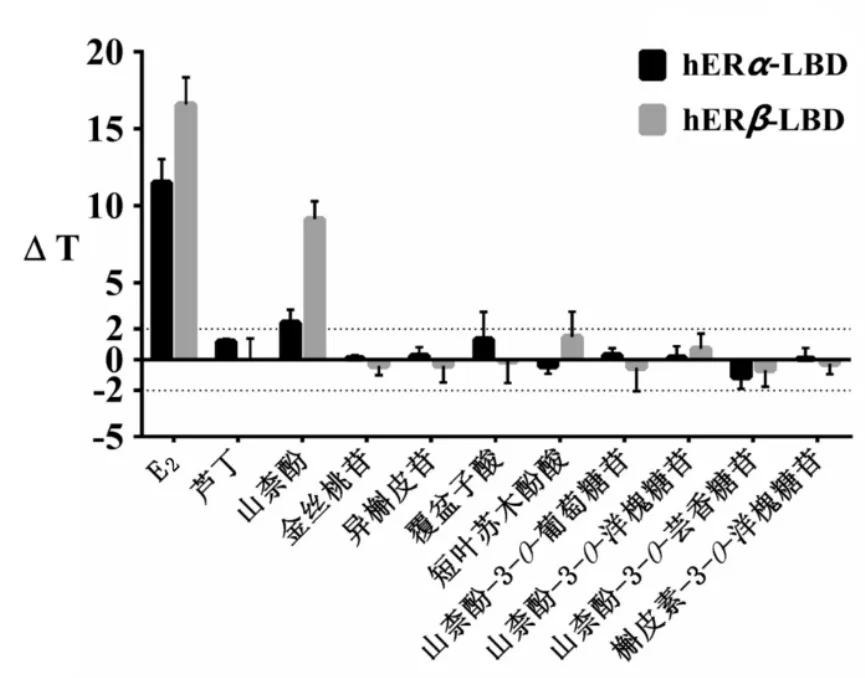
圖2 候選化合物對hERα-LBD、hERβ-LBD熔解溫度的影響Fig.2 Effects of candidate compounds on melting temperature of hERα-LBD and hERβ-LBD
由圖2所示,E2顯著提高了兩種雌激素受體配體結合域(hERα-LBD、hERβ-LBD)的熱穩定性;在候選化合物中山柰酚能明顯提高hERα-LBD和hERβ-LBD的熔解溫度(ΔT>2),尤其對hERβ-LBD的作用較顯著。山柰酚作用于兩種雌激素受體亞型配體結合域的實時熔解曲線如圖3所示。
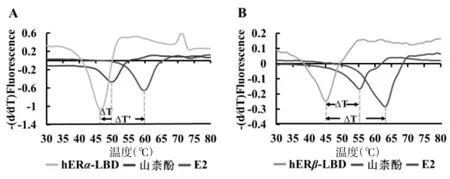
圖3 山柰酚對hERα-LBD(A)、hERβ-LBD(B)熔解溫度的影響Fig.3 Effects of Kaempferol on melting temperature of hERα-LBD(A)and hERβ-LBD(B)
4 討論
雌激素為甾體類化合物,具有廣泛的生物活性,不僅在女性生殖器官的發育、第二性征的維持中起著重要的作用,而且對骨質代謝、脂類代謝、心血管和神經系統等也有重要的作用[11-13]。雌激素的經典作用機制認為,雌激素首先與雌激素受體上的配體結合區合并使受體二聚化,進一步使雌激素受體的DNA結合區(DBD)與靶基因啟動子上的雌激素應答元件(ERE)結合,從而啟動靶基因的轉錄[14-15]。雌激素可用于治療絕經期女性心血管疾病、絕經后骨質疏松等疾病,因此激素替代治療(HRT)廣泛應用于臨床。然而HRT是把雙刃劍,帶來改善的同時也帶來不少的毒副作用,如:子宮內膜出血、乳房脹痛,增加中風、靜脈血栓、乳腺腫瘤、子宮內膜腫瘤等的發生率[16-17]。植物雌激素(PE)是一類從天然植物中提取,結構與內源性雌激素相似的一類化合物,能夠模擬雌激素在人體內的理化作用,與雌激素受體的兩種亞型均可結合并將其激活[18-20],但親和力相對較弱。植物雌激素對絕經后骨質疏松、腫瘤、心血管疾病、老年性癡呆癥等疾病有獨特的預防和治療功效,同時比雌激素有更多優點[21]。植物雌激素根據其化學結構,主要分為4大類:黃酮類、香豆素類、木脂素類以及二苯乙烯類[22-23]。
黃酮類化合物是覆盆子代謝過程中產生的重要天然有機化合物,是覆盆子中主要活性成分之一,山柰酚屬于黃酮類化合物,具有、抗腫瘤、抗炎、抗氧化、抗菌、抗病毒等多種功效[24]。本研究基于雌激素受體與配體結合發揮作用的機制,采用高通量篩選方法篩選覆盆子中的植物雌激素,操作簡單,為篩選中藥中雌激素樣活性化合物或者其它可通過與靶蛋白結合發揮作用的活性化合物提供了一個高效、快速的研究方法。
[1] 程 丹,李 潔,周 斌,等.覆盆子化學成分與藥理作用研究進展[J].中藥材,2012,35(11):1873-1876.
[2] 杜龍飛,李 潔,楊 龍,等.覆盆子的化學成分研究[J].天然產物研究與開發,2014,26(12):1957-1960.
[3] 朱俊萍,范東瀛.Thermal Shift Assays在重組森林腦炎病毒絲氨酸蛋白酶純化中的應用[J].中國生物工程雜志,2009,29(11):53-59.
[4] De CL,Wang X,Spyrou JA,et al.More-powerful virus inhibitors from structure-based analysis of HEV71 capsid-binding molecules[J].Nat Struct Mol Biol,2014,21(3):282-288.
[5] Zubriene A,Matuliene J,Baranauskiene L,et al.Measurement of nanomolar dissociation constants by titration calorimetry and thermal shift assay-radicicol binding to Hsp90 and ethoxzolamide binding to CAII[J].Int J Mol Sci,2009,10(6):2662-2680.
[6] Fu X,Wang Z,Li L,et al.Novel Chemical Ligands to Ebola Virus and Marburg Virus Nucleoproteins Identified by Combining Affinity Mass Spectrometry and Metabolomics Approaches[J].Sci Rep,2016(6):29680.
[7] 龔劍秋,梁文清.覆盆子抗骨質疏松化學組成及抗骨質疏松活性成分研究[J].中華中醫藥學刊,2016,34(3):657-659.
[8] 王俊玲,黃思敏,梁啟瑤,等.雌激素的來源及其在骨代謝中的作用[J].中國骨質疏松雜志,2015,21(6):729-732.
[9] Lagari VS,Levis S.Phytoestrogens in the prevention of postmenopausal bone loss[J].Clin Densitom,2013,16(4):445-449.
[10]程科軍.Ⅰ.覆盆子活性成分研究Ⅱ.金雀根中二苯乙烯類成分的穩定性研究[D].上海:復旦大學,2008.
[11]Takeshi U.Pharmaceutical prospects of phytoestrogens[J].Endocr J,2006,53(1):7.
[12]袁婷婷,張乃丹,何勇靜,等.天然藥物中植物雌激素樣化學成分的研究進展[J].中國中藥雜志,2014,39(23):4526-4531.
[13]黃 穎,周艷華,崔海峰,等.雌激素調節作用機制研究進展[J].中國醫藥導報,2010,7(5):7-8,11.
[14]孟慶書,何 平,朱曉燕,等.植物雌激素的作用機制[J].生命的化學,2007,27(2):141-143.
[15]趙曉民,徐小明.雌激素受體及其作用機制[J].西北農林科技大學學報(自然科學版),2004,32(12):154-158.
[16]Anderson GL,Limacher M,Assaf A R,et al.Effects of conjugated equine estrogen in postmenopausal women with hysterectomy:the Women's Health Initiative randomized controlled trial[J].JAMA-The Journal of the American Medical Association,2004,291(14):1701-1712.
[17]Rossouw JE,Anderson GL,Prentice RL,et al.Risks and benefits oestrogen plusprogestin in healthy postmenopausalwomen:principal results From the Women's Health Initiative randomized controlled trial[J].JAMA-The Journal of the American Medical Association,2002,288(3):321-333.
[18]Branca F,Lorenzetti S.Health effects of phytoestrogens[J].Forum Nutr,2005,57(57):100-111.
[19]Soto AM,Sonnenschein C,Chung KL,et al.The E-screen assay as a tool to identify estrogens:an update on estrogenic environmental pollutants[J].Environ Health Perspect,1995,103(7):113.
[20]Mueller SO.Overview of in vitro tools to assess the estrogenic and antiestrogenic activity of phytoestrogens[J].Chromatography B,2002,777(1-2):155.
[21]Cos P,De Bruyne T,Apers S,et al.Phytoestrogens:recent developments[J].Planta Medica,2003,69(7):589-599.
[22]Strauss L,Santti R,Saarinen N,et al.Dietary phytoestrogens and their role in hormonally dependent disease[J].Toxicology Letters,1998,102-103(102/103):349-354.
[23]Cassidy A,Hanley B,Lamuela-Raventos RM.Isoflavones,lignans and stilbenesorigins,metabolism and potential importance to human health[J].Journal of the Science of Food and Agriculture,2000,80(7):1044-1062.
[24]陳育華,周克元,袁漢堯.山柰酚藥效的研究進展[J].廣東醫學,2010,31(8):1064-1066.

