EMS誘變對北方白菜型冬油菜農藝性狀與品質的影響
楊建勝,孫萬倉,2,劉自剛,2,劉海卿,楊 剛,張樹娟,張 晶,方 彥,2,武軍艷,2,李學才,2
(1.甘肅省干旱生境作物重點實驗室,甘肅省作物遺傳改良與種質創新重點實驗室, 甘肅 蘭州 730070;2.甘肅省油菜工程技術研究中心,甘肅農業大學農學院, 甘肅 蘭州 730070)
化學誘變具有操作簡單、突變性狀穩定等優點,是創制植物新種質的有效途徑,化學誘變劑甲基磺酸乙酯(ethyl methane sulphonate,EMS)具有點突變頻率高且多為顯性突變體以及突變體易于篩選等優點[1]。關于EMS誘變產生突變體的研究已有大量報道,王英培等[2]用EMS處理大豆,篩選出一批高蛋白(45%~50%)、高亞油酸(60%以上)、低亞麻酸的優良突變系;曲高平等[3]用EMS處理甘藍型油菜中雙9號干種子,從M2突變體庫中篩選到3株苯磺隆抗性突變體,創建了包括子葉、葉片、花器、株型、角果等多器官變異類型的突變體庫;廖曉英等[4]利用EMS處理甘藍型油菜玻里馬胞質雄性不育系(polcms)的保持系2B種子,從田間M2誘變群體中篩選獲得多分枝和長角果等占M2誘變群體7.4%的1 495個變異株;薛遠超等[5]分別從GH18和中雙9號的EMS誘變后代中篩選得到14個和2個強耐濕性材料;陳潔等[6]也通過EMS誘變甘藍型油菜獲得了耐濕種質資源。此外,EMS處理對油料作物脂肪酸品質改良具有重要作用,是一種安全有效的育種方法。黃永娟等[7]用0.4% EMS誘變甘藍型油菜NJ7982種子,從M2篩選得到1個油酸含量為76.15%的突變株;張宏軍等[8]采用濃度1.5%EMS處理甘藍型油菜后發現其對油酸含量有一定的影響,同時發現高油酸材料FAD2A中第205位殘基天冬氨酸變成甘氨酸,FAD2B中第241位殘基酪氨酸變成苯丙氨酸,并且二者都發生在油酸減飽和酶催化中心,從而影響蛋白質的空間結構,導致油酸含量提高;德國學者Hans-Joachim Harloff等[9]發現EMS能使甘藍型油菜品質性狀發生改變,通過誘變得到了低芥酸的突變體。北方地區冬季嚴寒、干旱,自然條件嚴酷,強冬性白菜型冬油菜抗寒性優異,是我國北方旱寒區唯一能夠越冬的冬油菜,近年來生產發展十分迅速,正在成為該區重要油料作物和生態作物,但北方強冬性白菜型冬油菜品種品質不好,芥酸與硫苷含量高,缺乏優質種質資源,同時株型不適應現代種植業發展要求,農藝性狀等也不盡理想。因此,創制白菜型冬油菜優質種質資源、改良北方白菜型冬油菜的品質和農藝性狀是北方強冬性白菜型冬油菜育種研究的重要內容,本試驗以白菜型冬油菜隴油7號為材料,用不同濃度EMS溶液進行誘變處理,以期明確EMS誘變對北方強冬性白菜型冬油菜的品質和農藝性狀的影響,為白菜型油菜的品質改良提供依據。
1 材料與方法
1.1 試驗材料
白菜型冬油菜超強抗寒品種隴油7號種子,由甘肅省作物遺傳改良與種質創新重點實驗室提供,化學誘變劑為甲基磺酸乙酯(EMS),購自美國Sigma公司,原液濃度為10 mol·L-1。
1.2 試驗設計
2013年9月在甘肅農業大學試驗農田進行大田試驗,試驗地肥力中等,播前翻耕整地,清除雜草,將用5種不同濃度EMS溶液處理后的種子于2013年9月8日播種,試驗設3次重復,完全隨機區組設計,開溝條播,播深4 cm左右,深淺一致,行距20 cm,株距7 cm左右,播后及時沿播種溝鎮壓保墑,此后常規管理。室內試驗在甘肅省作物遺傳改良與種質創新重點實驗室進行。
1.3 試驗方法
1.3.1 EMS處理方法 用0.1 mol·L-1、pH值7.0的磷酸緩沖液配制不同濃度(0、0.3%、0.6%、0.9%、1.2%)的EMS溶液,分別標記為CK、T1、T2、T3、T4。選取大小均勻,形狀飽滿的隴油7號種子4 500 粒,置于15個10 mL的離心管中(每300粒裝1個離心管),先用蒸餾水浸泡種子10 h,隨后倒掉蒸餾水,倒置離心管于濾紙上吸干種子表面水分,再向離心管中加入不同濃度的EMS溶液,在恒溫(22℃)下處理6 h,處理完后用無菌水沖洗種子10次,流水沖洗過夜。種子晾干后于大田播種,每處理重復3次,按常規方法管理。
1.3.2 M1的田間觀察方法 播種1周后調查統計成苗率,于苗期觀測植株的形態特征(子葉形狀、心葉色、基葉葉型等),蕾薹期觀察植株的株型、葉形、葉色、現蕾情況等,花期調查花器顏色、形態和育性等,成熟期各處理每重復隨機選取15株對株高、分枝部位、有效分枝數、主花序有效長度、主花序有效角果數、全株有效角果數、角果長度、角粒數、千粒重等性狀進行考種以及生育期的調查,單株編號收獲進行品質測定。
1.3.3 M2種子的品質分析方法 2015年6月收獲M2種子,單株編號收獲,種子脫粒晾干后用近紅外分析光譜儀器(上海費爾伯恩精密儀器有限公司,BOEN-SUP-2700)[10]測定軟酯酸、硬酯酸、芥酸、油酸、亞油酸、亞麻酸、二十碳烯酸、含油量(CE)、硫苷(GSL)、水分及粗蛋白(GP),重復3次。
1.4 數據分析
數據處理和分析均采用Excel和SPSS 16.0軟件。
2 結果與分析
2.1 EMS處理對冬油菜M1成苗率的影響
用EMS處理的種子播種1周后田間成苗率的調查結果表明,EMS對成苗率有抑制作用,且隨著濃度的增加抑制作用增強,苗致死率增高。經0.6%濃度處理后種子的成苗率為52%,說明此濃度下苗致死率接近50%,從發芽時間來看,與CK相比,所有EMS處理后種子出苗較慢且不均勻,經高濃度EMS(T4)處理后,種子發芽后子葉黃化而迅速死亡,導致成苗率只有37%(表1)。

表1 不同濃度EMS處理后種子成苗率/% Table 1 Seeding rate after treatment with different concentrations of EMS
注:成苗率指觀察當天田間的植株數占種子總數的百分比;不同字母表示在0.01水平有顯著差異(P<0.01)。
Note: seeding rate refers to the percentage of the number of plants observed in the field to the total number of seeds; different letter indicated significant difference at the 0.01 level(P<0.01).
2.2 EMS處理對M1植株的影響
2.2.1 對苗期植株的影響 EMS對苗期植株的影響主要反映在植株的生長量上,即植株的形態大小。由圖1和表2可知,經EMS處理的油菜生長普遍較CK弱,表現為CK>T1>T2>T3>T4,同一濃度下植株的長勢差異不明顯,說明EMS對油菜的生長發育有一定的抑制作用,且抑制作用與濃度呈正相關,且在高濃度EMS處理下,出現葉片黃化的現象(圖1-D、E),這將影響植株后期的生長發育。
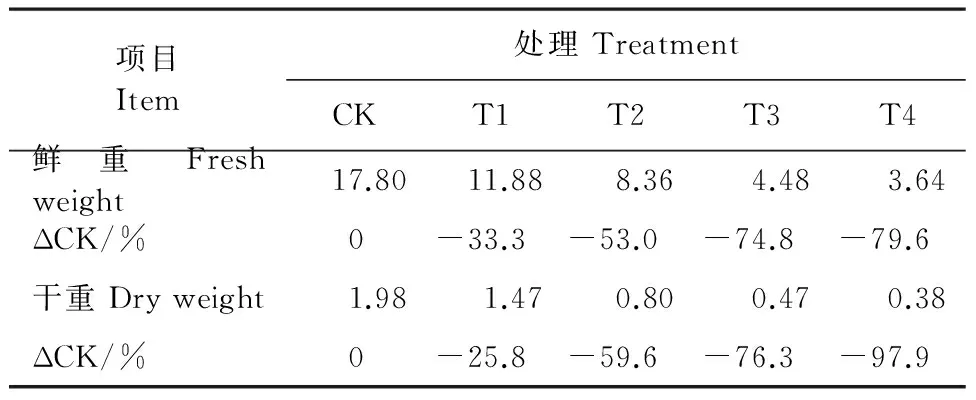
表2 冬油菜五葉期植株的干鮮重/g Table 2 Fresh and dry weight of plants at five-leaf stage
2.2.2 植株葉片產生的變異性狀 不同濃度EMS處理隴油7號種子,各濃度下,蕾薹期植株田間表現有葉片卷曲、皺縮、畸形、黃化等變異性狀。CK的葉片厚而葉色深(圖2-A),而在M1植株中出現了葉片邊緣下卷,葉片變小(圖2-B)、葉片皺縮(圖2-C)、葉尖畸形(圖2-D)、整個葉片畸形(圖2-E)、一半白葉一半綠葉(圖2-F、G)、黃斑葉(圖2-H、I)、葉邊緣黃化以及黃化葉(圖2-J、K、L)等變異植株。在這些變異性狀上,后期一些植株慢慢死亡或死蕾而不能收獲種子。

圖1 不同濃度EMS處理后油菜的田間表現
Fig.1 Rapeseed field performance of different EMS treatments
2.2.3 植株花器官產生的變異性狀 白菜型油菜隴油7號的花序為總狀無限花序,正常花有4個花瓣,呈十字對稱分布,顏色為黃色(圖3-A),但在誘變后代中出現了不正常花,在花瓣數目上出現了2個花瓣的植株,另外2個花瓣萎縮而不發育(圖3-B、C);3個花瓣的植株,1個花瓣萎縮(圖3-D);5個花瓣的植株,在正常花瓣的下面又疊生出1個花瓣來(圖3-E);6個花瓣的植株,也是在正常花瓣的下面疊生出1個花瓣,且有3個花瓣連生在一起(圖3-F)。在花瓣形態上出現了花瓣卷曲、花瓣皺縮變小的變異株(圖3-G、H),也有花瓣大小不一且不對稱的不正常花(圖3-I、J)。在花瓣顏色方面出現了黃白相間花的植株(圖3-I、J)及白花植株(圖3-K),白花植株的花瓣較小而整個花瓣全是白色。此外,還出現了多柱頭而無雄蕊和花瓣的畸形變異花(圖3-L)。
2.2.4 對成熟期植株的影響 在成熟期各處理隨機選取15株進行考種,由表3可知,EMS對株高的影響是隨著EMS濃度的增加,株高逐漸降低,各濃度下株高與CK的差異達到顯著或極顯著水平。隨EMS濃度的增加有效分枝數增多,這主要表現為植株的叢生現象,與CK相比,分枝數多但株型矮小、葉片較小、莖桿纖細、長勢較弱,矮化叢生是這一時期典型的變異特征。EMS對其它性狀的影響都是隨著EMS濃度的增加各性狀發育受到抑制,T4中,除有效分枝數和角果長度外,其它性狀與CK的差異均達到顯著或極顯著水平,說明EMS濃度越高,其對各性狀的發育抑制程度越高。此外,EMS對株高、主花序有效角果數和全株有效角果數的影響最大,株高變小,有效角果數變少,這也是其影響單株產量的主要原因。


圖2 冬油菜EMS誘變后代在葉片性狀上的變異表現 Fig.2 Leaf morphological traits of the mutants induced by EMS
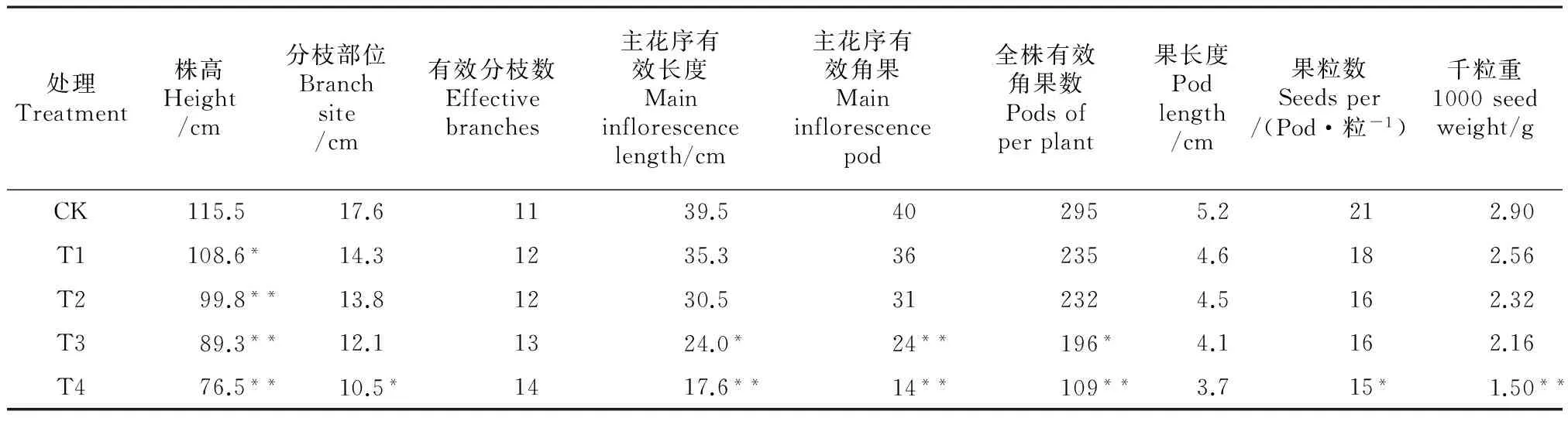
圖3 冬油菜EMS誘變后代在花器上的變異表現 Fig.3 Morphological traits of floral organ of the mutants induced by EMS表3 不同濃度EMS處理后油菜成熟期植株的田間表現 Table 3 Agronomic traits of plants at maturity after treatment with different concentration EMS
注:*和**分別表示與CK相比在0.05和0.01水平上差異顯著。Note: *, ** significant difference atP<0.05 and 0.01 levels, respectively.
經調查,各濃度處理下植株的生育期隨著EMS濃度的增加而延長,CK的生育期為288 d左右,T2的生育期為295 d,較CK延長1周左右,而T4的生育期較CK推遲2周左右,這可能是EMS對其植株在各個生育期的生長發育都有一定的抑制作用所致,從M1植株的各個生育期來看,苗期植株的變異不大,變異主要反映在抽薹期和花期。
2.3 冬油菜M1種子各主要脂肪酸間以及與含油量的相關與回歸分析
由表4可知,軟酯酸與油酸,亞油酸與亞麻酸,芥酸與硬脂酸、亞麻酸在P=0.05水平上相關性不顯著,其它脂肪酸間均存在顯著或極顯著相關關系,油酸除與亞油酸呈極顯著正相關(r=0.374)外,與硬脂酸、亞麻酸、二十碳烯酸、芥酸間均呈極顯著負相關,相關系數r依次為-0.706、-0.744、-0.962、-0.615。在白菜型油菜品質改良育種中,獲得雙低(低硫苷、低芥酸)油菜新品種以及油酸含量高芥酸含量低的突變體材料是育種工作者的理想目標,油酸與芥酸間的負相關性,體現出獲得理想突變體材料的可能性,為白菜型油菜品質改良育種提供理論依據,且油酸和芥酸的回歸系數為-0.4798,即芥酸含量每下降1%,油酸含量可增加0.48%。芥酸與油酸、亞油酸間均呈極顯著的負相關關系,相關系數r依次為-0.717、-0.615、-0.866,而二十碳烯酸與油酸和亞油酸間也呈極顯著的負相關關系(r為-0.962、-0.324),且芥酸與二十碳烯酸間呈極顯著的正相關關系(r=0.501)。

表4 油菜誘變后代種子各主要脂肪酸的相關性及其對應的線性回歸方程 Table 4 The correlation and linear regression equation of the main fatty acids in the seeds of mutagenesis progeny
注:表中數據為相關系數,括號中為對應的回歸方程; *和**分別表示在0.05和0.01水平下相關性顯著。
Note: the table date is correlation coefficients, and that within brackets is regression equation; * and ** mean significant correlation at level of 0.05 and 0.01, respectively.
含油量與軟脂酸、油酸、亞油酸、亞麻酸間均呈極顯著的負相關關系,相關系數r依次為-0.776、-0.301、-0.875、-0.269,與硬脂酸、芥酸間呈極顯著的正相關關系(r為0.374、0.836),而與二十碳烯酸間呈顯著正相關關系(r=0.216)。
2.4 冬油菜M1籽粒品質性狀分析
通過對各處理M1主要脂肪酸含量分析發現,在各濃度處理后,油酸含量高于CK(33.24%)的植株占總植株數的41.9%,油酸含量大于40.0%的植株占總植株數的13.97%,在T1中出現了1株油酸含量為44.02%的植株,在T2中出現了2株油酸含量較高的植株,油酸含量分別為44.04%、44.18%,比CK高11個百分點左右。芥酸含量低于CK(24.70%)的植株占總植株數的50.7%,芥酸含量較低(低于15.0%)的植株占總植株數的11.0%,在T1、T2中分別出現了2株芥酸含量較低的植株,芥酸含量分別為7.49%、8.93%、9.51%和8.50%,比CK低17個百分點左右。硫苷含量低于CK(93.10%)的植株占總植株數的63.97%,硫苷含量較低(低于40.0%)的植株占總植株數的9.56%,在T1、T2中分別出現了1株硫苷含量較低的植株,硫苷含量分別為5.44 μmol·g-1和15.32 μmol·g-1。在這些突變株中出現了4株芥酸和硫苷含量均較低的突變株,其芥酸和硫苷含量分別為7.49%和26.21 μmol·g-1、10.94%和5.44 μmol·g-1、8.93%和28.94 μmol·g-1、9.51%和34.22 μmol·g-1(表5)。

表5 EMS處理對油菜主要脂肪酸含量的影響/% Table 5 Effects of EMS treatment on major fatty acid contents of mutants
2.5 冬油菜M2獲得的優質突變體及其主要品質性狀
在M2中檢測到4株有利突變體,分別為3株油酸含量較高(比CK高15個百分點左右)且芥酸含量較低(比CK低10個百分點左右)的突變株,1株低硫苷含量突變體(表6),這些突變株的出現進一步說明了EMS誘導北方白菜型冬油菜產生優質突變體的有效性。
3 討 論
3.1 EMS誘變可使北方白菜型冬油菜產生較大變異
誘變可以產生豐富的突變體,已廣泛應用于植物遺傳育種和生物學研究[1]。EMS作為一種有效的誘導植物基因發生點突變的手段,在小麥[11]、大豆[12]、玉米[13]、水稻[14]等作物上取得了較好效果,中國科學院石家莊現代化研究所利用EMS處理冬小麥,獲得了比原品種蛋白質含量高3%~40%的突變體,其中M2變異率達到15.7%以上, 獲得9個早熟、矮稈突變系,比原品種增產2.8%~20.5%[15];將濃度為0.1%~0.5%的化學誘變劑EMS注入花生品種花育16號和魯花11號的花器,獲得了單株結果數、單株仁重、飽果率比野生型明顯提高的突變體,同時對花生的品質和農藝性狀也產生了明顯影響[16-18]。本研究結果表明,EMS對白菜型冬油菜M1植株蕾薹期和花期形態特征和農藝性狀影響較大,在蕾薹期出現了葉片白化、卷曲、皺縮、畸形、黃化、花器畸形植株,尤其在花期出現了2花瓣花、3花瓣花、5花瓣花、花瓣皺縮卷曲、黃白相間花、白花以及多柱頭花等變異性狀,這與前人在甘藍型油菜上的研究結果類似[19-20]。
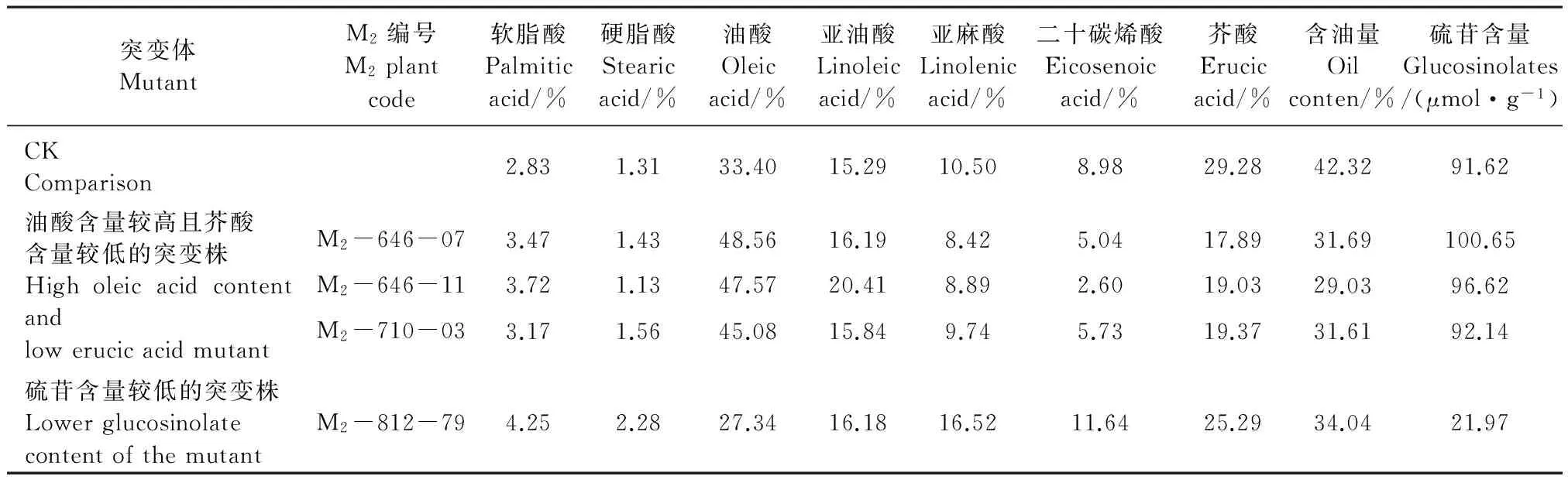
表6 突變體的主要品質性狀 Table 6 Quality traits of the resulting mutant
3.2 變異的產生與EMS處理的濃度和時間有關
研究表明,EMS誘變無論產生有利或有害變異,均與誘變劑的濃度和處理時間有關,且不同的植物材料誘變效果也不同[21-25]。李偉等[26]發現谷子豫谷1號的適宜誘變條件為清水浸種過夜、1%EMS處理8 h;水稻上發現用0.5%EMS溶液處理的水稻種子,再經0.5%和0.7% EMS溶液復合處理,發生突變的頻率為12.4%,復合處理的誘變效果優于一次性處理,在M3篩選到一個生產上能推廣使用的水稻突變新品系[27]。本研究結果表明,適宜的EMS濃度是提高誘變效率的關鍵,成苗率隨EMS濃度的增加而減小,EMS濃度為0.6%時,田間種子的成苗率為52%,接近半致死濃度,而0.3%處理后籽粒品質產生的變異幅度也較大,綜合這2個指標,確定其誘變最適濃度為0.3%~0.6%,此濃度范圍可作為白菜型油菜EMS誘變的參考濃度。本研究中變異性狀的出現,證明EMS在白菜型油菜上的應用是有效的,成熟期的考種結果表明,EMS對株高、分枝部位、主花序有效長度等性狀的發育有一定的抑制作用,且抑制作用與濃度成正相關。
3.3 EMS誘變可成為北方白菜型油菜產生優良突變體的有效途徑
近年來人們越來越關注油菜的品質,通過理化因素誘變已成為創建新型優質種質資源的一種有效手段[1]。本試驗在M2中篩選到了3株油酸含量較高且芥酸含量較低的植株(編號分別為M2-646-07、M2-646-11、M2-710-03),油酸含量分別為48.56%、47.57%、45.08%,比對照高15個百分點;芥酸含量分別為17.89%、19.03%、19.37%,比對照低10個百分點,同時還得到了1株硫苷含量較低(21.97 μmol·g-1)的突變株(編號為M2-812-79),前人研究表明,EMS處理甘藍型油菜種子產生高油酸突變體,其原因可能是:高油酸突變體中,BnFAD2I基因有63個堿基發生變異,進而導致蛋白質翻譯出現終止;BnFAD2II-1基因有41處堿基發生突變,導致15個氨基酸變異,其中處于跨膜區域的+82氨基酸由絲氨酸突變成脯氨酸,+157的苯丙氨酸變成亮氨酸,位于疏水區中,還有9處發生突變的氨基酸殘基位于α-螺旋區,這些突變位點都發生在油酸脫飽和酶催化中心,進而影響該酶的活性,導致突變體的油酸含量升高[7],而對于EMS處理對油菜芥酸和硫苷含量的影響還有待進一步研究。
4 結 論
本研究表明,甲基磺酸乙酯(EMS)處理可誘導北方白菜型冬油菜產生豐富的變異,在M1代中出現葉片、花器官、農藝性狀及品質性狀的變異;在M2中篩選到了3株油酸含量較高且芥酸含量較低的突變體(油酸含量45.08%~48.56%、芥酸含量17.89%~19.37%)和1株低硫苷突變體(硫苷含量21.97 μmol·g-1);能使白菜型冬油菜產生有利變異的EMS處理濃度為0.3%~0.6%,處理時間為6 h。
[1] 柳學余.農作物化學誘變育種[M].南京:東南大學出版社,1992.
[2] 王培英,許德春,郭玉虹,等.人工誘變改良大豆品質的研究[J].核農學報,2000,14(1):21-23.
[3] 曲高平,孫妍妍,龐紅喜,等.甘藍型油菜EMS突變體庫構建及抗除草劑突變體篩選[J].中國油料作物學報,2014,36(1):025-031.
[4] 廖曉英,閻晉東,鐘 鳴,等.甘藍型油菜EMS誘變及多分枝和長角突變體分析[J].生命科學研究,2016,20(5):435-441.
[5] 薛遠超,李加納,劉列釗,等.甘藍型油菜EMS誘變材料的耐濕性鑒定與篩選[J].西南師范大學學報(自然科學版),2012,37(4):76-80.
[6] 陳 潔,張學昆,諶 利,等.甘藍型油菜耐濕種質資源的快速篩選[J].中國油料作物學報,2006,28(2):138-143.
[7] 黃永娟,張鳳啟,楊甜甜,等.EMS誘變甘藍型油菜獲得高油酸突變體[J].分子植物育種,2011,9(5):611-616.
[8] 張宏軍,肖 鋼,譚太龍,等.EMS處理甘藍型油菜(Brassicanapus)獲得高油酸材料[J].中國農業科學,2008,41(12):4016-4022.
[9] Hans-Joachim Harloff, Susanne Lemcke, Juliane Mittasch, et al. A mutation screening platform for rapeseed (BrassicanapusL.) and the detection of sinapine biosynthesis mutants[J] .Theoretical and Applied Genetics, 2012,124(5):957-969.
[10] 吳建國,石春海,張海珍,等.應用近紅外反射光譜法整粒測定小樣品油菜籽含量的研究[J].作物學報,2002,28(3):421-425.
[11] 倪永靜,朱培培,劉紅杰,等.EMS誘導國麥301小麥突變體庫的建立與鑒定[J].河南農業科學,2015,44(4):42-45.
[12] 吳秀紅.EMS對不同大豆品種M2代農藝性狀的影響[J].農學學報,2012,2(5):29-31.
[13] 李海軍,池書敏,劉志增,等.利用EMS化學誘變改造玉米自交系的研究[J].玉米科學,2002,10(3):36-37.
[14] 王 峰,徐 飚,楊正林,等.EMS誘變水稻矮生資源的鑒定評價[J].核農學報,2011,25(2):0197-0201.
[15] 杜連恩,于秀普,魏玉昌.EMS處理小麥合子誘變篩選高蛋白突變體[J].河北農業大學學報,1990,13(4):94-96.
[16] 殷冬梅,楊秋云,楊海棠,等.花生突變體的EMS誘變及分子檢測[J].中國農學通報,2009,25(5):53-56.
[17] 王傳堂,王秀貞,唐月異,等.EMS直接注入花生花器創制高產突變體[J].核農學報,2010,24(2):239-242.
[18] 唐月異,王秀貞,吳 琪,等.EMS誘變選育花生新品種-花育40號[J].核農學報,2014,28(6):0967-0969.
[19] 和江明,王敬喬,陳 薇,等.用EMS誘變和小孢子快速獲得甘藍型油菜高油酸種質材料的研究[J].西南農業學報,2003,16(2):34-36.
[20] 李浩杰,蒲曉斌,張錦芳,等.甘藍型油菜EMS誘變后代農藝性狀觀察及分子檢測[J].核農學報,2012,26(2):0245-0249.
[21] 杜園園,劉永忠,李萬星,等.大豆EMS化學誘變處理條件分析[J].安徽農業科學,2012,40(35):16995-16996.
[22] 祝麗英,池書敏,劉志增,等.甲基磺酸乙酯(EMS)在創造玉米新種質中的應用[J].玉米科學,2001,9(3):14-17.
[23] 陳邵江,宋同明.EMS花粉誘變獲得高油玉米突變體[J].中國農業大學學報,2002,7(3):12-13.
[24] 王 軍,楊慧卿,袁 峰,等.EMS誘變谷子“長農35號”M1代成熟期株型突變體的鑒定與分析[J].中國農學通報,2011,27(18):84-89.
[25] 張紀元,張平平,姚金保,等.以EMS誘變創制軟質小麥寧麥9號高分子量谷蛋白亞基突變體[J].作物學報,2014,40(9):1579-1584.
[26] 李 偉,智 慧,王永芳,等.谷子EMS誘變的處理條件分析[J].河北農業科學,2010,14(11):77-79.
[27] 顧佳清,張智奇,周 音,等.EMS誘導水稻“中花11”突變體的篩選和鑒定[J].上海農業學報,2005,21(1):7-11.

