肝動脈化療栓塞術聯合射頻消融術治療有肝硬化基礎的中期肝癌的臨床研究
舒 丹 黃湘榮 汪 瑩 曾麗紅 許 誠
深圳市第三人民醫院 (廣東 深圳, 518012)
肝細胞癌(HCC)是常見的肝臟惡性腫瘤,由于起病隱匿,臨床上僅30%可于早期發現,大多數初診時已進入中、晚期,失去了根治的機會。目前國內外指南的一線推薦為肝動脈化療栓塞術(TACE),作為姑息性治療手段;射頻消融(RFA)治療則被認為早期患者的根治性手段,且越來越多的證據支持將其適應癥可延伸到巴塞羅那分期標準(BCLC)B期患者。本文探討了TACE聯合RFA治療對于有肝硬化基礎的中期肝癌的安全性與療效。
1 材料與方法
1.1 一般資料 收集本院2013年6月至2015年6月收治的符合BCLC B期診斷標準的HCC患者,全部患者均有乙肝肝硬化,口服恩替卡韋抗病毒治療,血清HBV DNA<100IU/ml。其中26例接受了TACE-RFA聯合治療,即TACE術后1~2周接受CT引導下RFA治療;39例僅接受TACE治療。
1.2 治療方法
1.2.1 TACE術 局麻下采用Seldinger 法經皮穿刺股動脈,常規行肝總動脈造影,必要時行腸系膜上動脈及膈動脈造影,明確腫瘤供血動脈及其走行,超選擇插管至腫瘤靶血管內造影,明確有無動靜脈瘺或動門靜脈瘺,如有嚴重的瘺先用明膠海綿顆粒堵塞瘺口,瘺口閉塞后開始栓塞。栓塞劑為碘化油10~20ml混合順鉑90~120mg。
1.2.2 RFA TACE術后1-2周序貫RFA治療。使用美國RITA公司生產的1500X射頻消融機,術前將病灶內碘油殘缺區及增強強化區作為消融靶區制定穿刺方案,在飛利浦Ingenuity Flex 64排螺旋CT引導下選擇合適的穿刺點及穿刺路徑。全麻下穿刺,成功后根據需消融范圍計算電極展開長度, 最大展開直徑為5 cm,選擇定時模式,機器自動調節輸出功率,每點消融時間10~15min。一般采用“多點穿刺、多針聯合、多點消融”的原則,使消融范圍超過病灶靶區邊緣約1cm,盡量徹底損毀腫瘤。術后給予保肝及對癥處理。
1.2.3 療效評價指標 主要研究終點是總生存期,次要終點是無進展生存期。總生存期指從治療開始至死亡或末次隨訪,無進展生存期指從治療開始至肝內復發、肝外轉移、死亡或末次隨訪。肝內復發定義為肝內新發病灶或局部腫瘤復發。
1.2.4 療效評價 所有患者治療后4周復查增強CT或MRI,采用mRECIST標準,所有病灶動脈期顯影消失為完全應答(CR),所有病灶的直徑總和縮小>30%為部分應答(PR),所有病灶動脈期顯影的直徑總和增加≥20%或出現新的病灶為疾病進展(PD),病灶直徑總和縮小未達PR或增加未達PD者為穩定(SD)。
1.3 統計學方法 采用SPSS 19.0 軟件, 計量資料以均數±標準差表示,組間比較采用t檢驗或卡方檢驗,采用Kaplan-Meier生存曲線分析生存時間,Logrank檢驗。全部采用雙側檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 基本情況 患者的基線情況見表1。
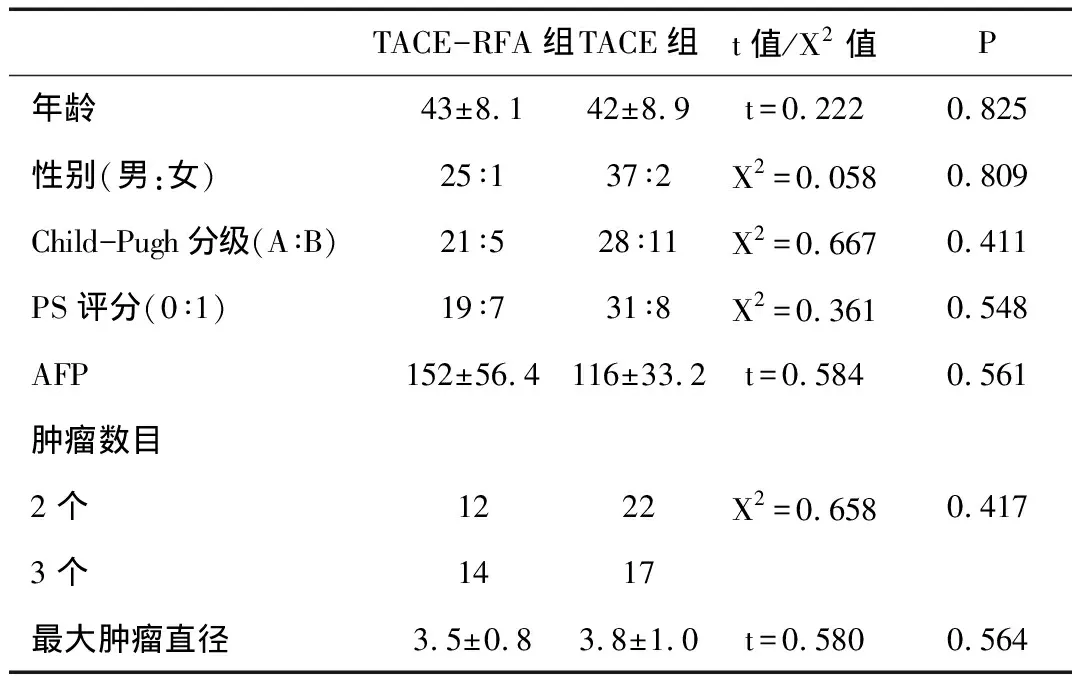
表1 患者的基線情況
2.2 應答情況 TACE-RFA組中18例經1次RFA、6例經2次RFA、2例經3次RFA獲得完全應答,3例獲得部分應答。TACE組中15例經1次TACE、11例經2次TACE、4例經3次TACE獲得完全應答,8例獲得部分應答,無人獲得穩定或疾病進展。兩組的完全應答率無統計學差異(X2=0.894,p=0.344)。
2.3 生存期情況 術后隨訪38~12個月,平均隨訪27個月。隨訪期結束時,TACE-RFA與TACE組分別有9例、21例死亡,其中TACE-RFA組第1年無人死亡,第2年死亡6人,第3年死亡3人;TACE組第1年死亡3人,第2年死亡17人,第3年死亡1人。TACE-RFA組中位生存期為25個月(95%Cl∶21.9~28.1),TACE組中位生存期為19個月(95%Cl∶16.7~21.3)。兩組生存期有顯著差異(P=0.018)。見圖1。
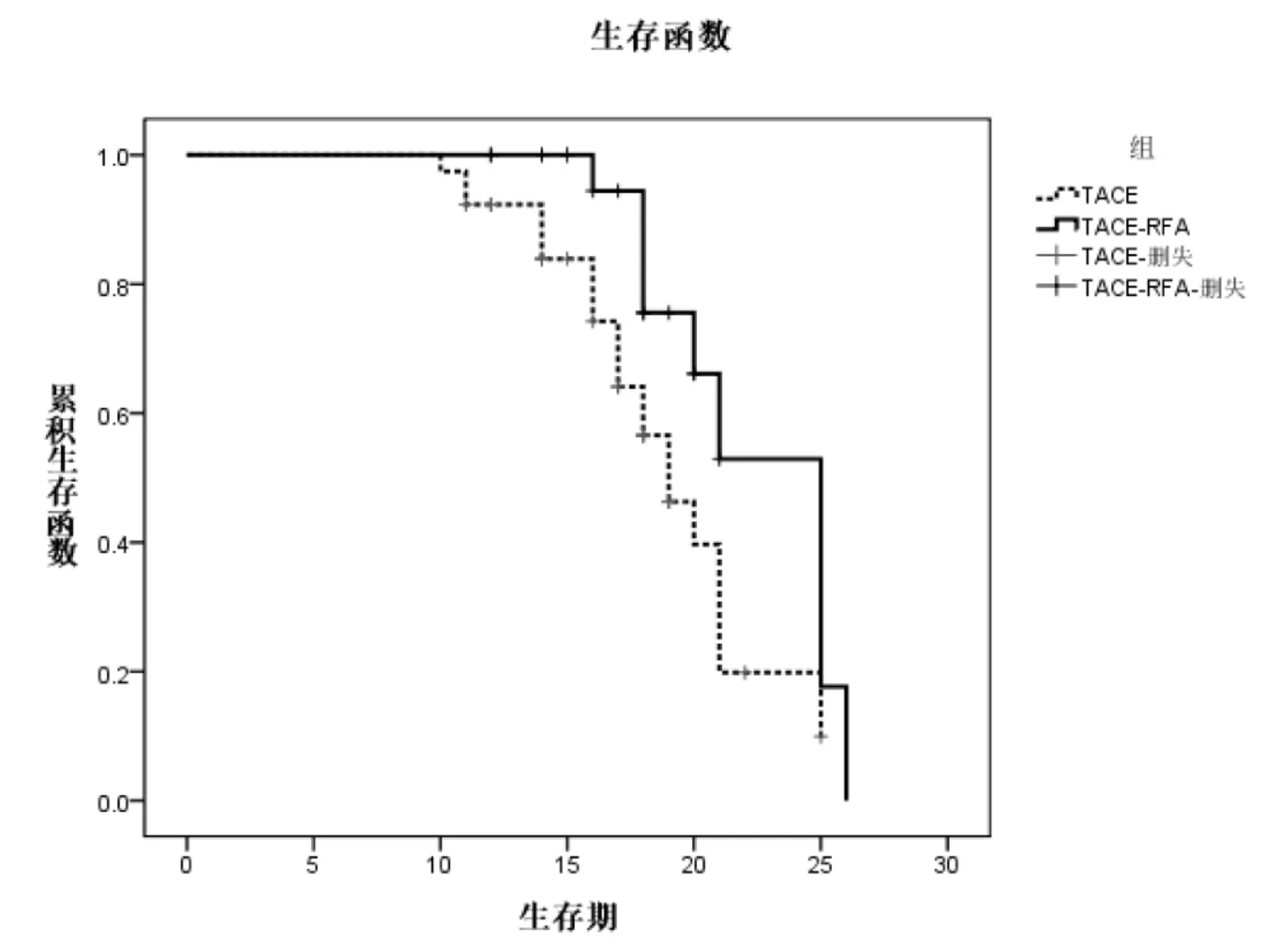
圖1 兩組患者的總體生存狀況
2.4 無進展生存期 TACE-RFA組的無進展生存期為15個月(95%Cl∶16.7~21.3),TACE組為10個月(95%Cl∶12.1~17.9),差異有統計學意義(p<0.001)。見圖2。
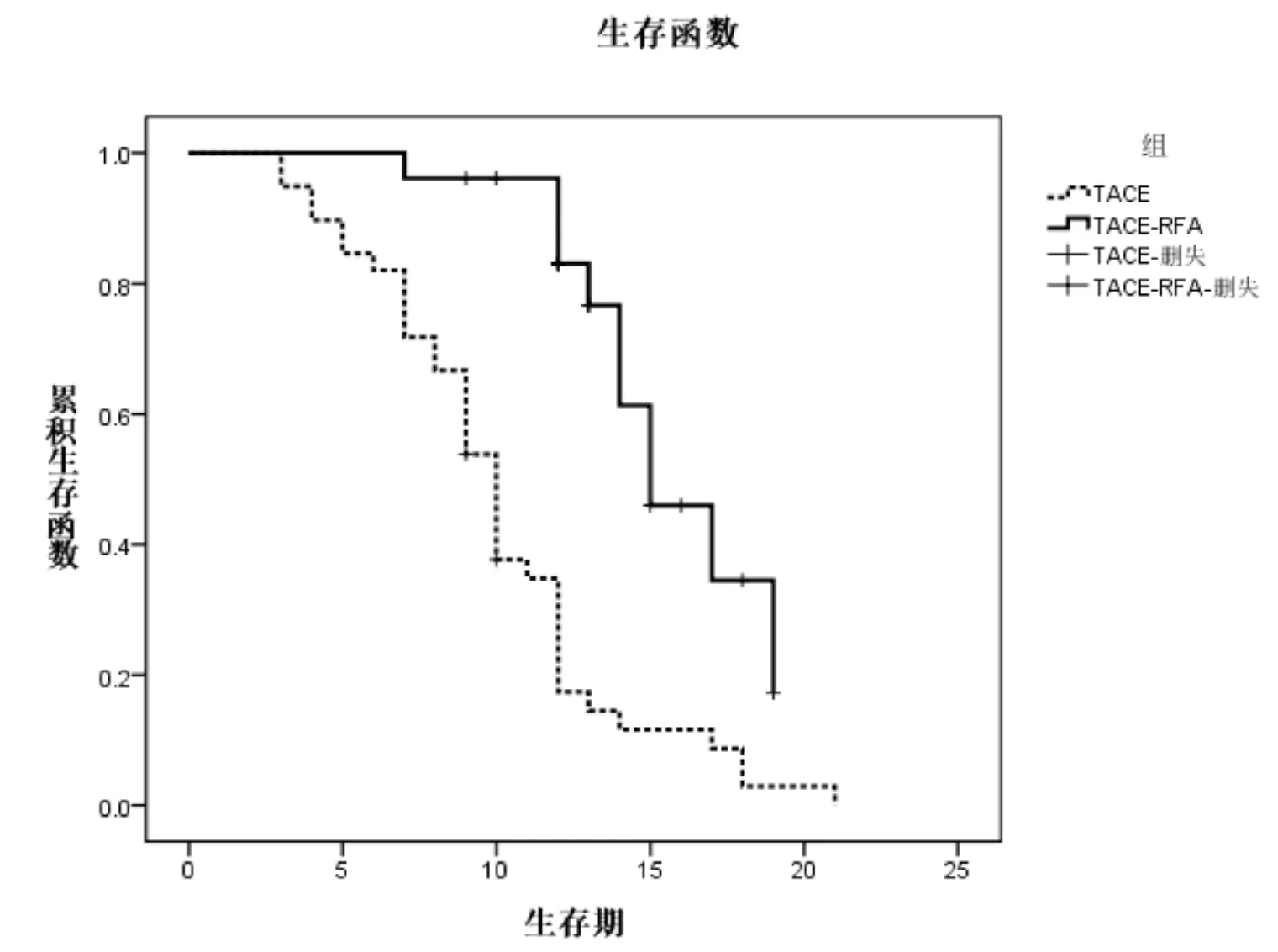
圖2 兩組患者的無進展生存期情況
2.5 不良反應 所有患者治療后均出現不同程度的發熱、疲乏、局部疼痛及一過性肝損害。需要臨床干預的不良事件見表2。
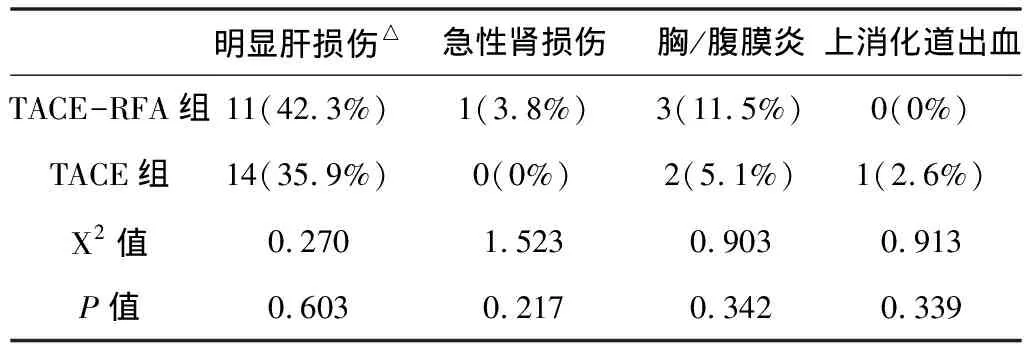
表2 需要臨床干預的不良事件
△明顯肝損傷,定義為ALT≥400U/L和/或TBil≥75umol/L
3 討論
TACE是中期HCC的標準推薦方案[1,2],但作為姑息性治療手段,因術后復發率高,遠期療效并不理想;對于有肝硬化基礎的患者,多次TACE最終可能導致肝功能惡化,從而進一步影響患者的生存期。盡管近年來開發了藥物洗脫微球肝動脈栓塞術(DEB-TACE),但除了提高患者的耐受性外,并未能進一步延長生存期[3]。探索靶向藥物聯合TACE的研究也顯示并未產生協同效應[4]。
RFA是借助影像技術的引導對腫瘤靶向定位,用物理方法殺死腫瘤組織,治療肝癌具有創傷小、治療時間短、操作技術簡便、術后并發癥少的優點。RFA對<2cm單一腫瘤的療效與手術切除效果相當[5],但對于直徑在3.1與4cm之間的HCC,RFA的局部失敗率可達24%;當直徑大于4cm時,由于血流促進了熱流失,完全消融率急劇下降[6]。
近年來多個研究探索了TACE聯合RFA的療效,發現相比于單獨TACE或RFA,聯合治療改善了患者的生存率[7,8,9,10]。推測聯合治療的優點在于:TACE的栓塞效應阻斷了HCC主要供血動脈的血流,為射頻消融治療大HCC提供了有利條件。另一方面,TACE可以發現影像學未能發現的衛星灶,更精準地確定消融范圍;經TACE治療后瘤內隔膜的破壞也使得熱消融更加徹底。因此對于較大的肝癌來說,二者有協同作用。
本研究中,我們選取有肝硬化基礎的BCLC B期患者,觀察了TACE-RFA聯合治療的安全性,結果發現與單純TACE相比,聯合治療并未增加不良反應。TACE-RFA的近期療效及副作用與TACE組無差異,但生存期明顯優于TACE組(25個月:19個月,P=0.018);無進展生存期方面較TACE組明顯延長(15個月:10個月,P<0.001),提示RFA的根治性處理能最大限度破壞癌灶,延緩復發,從而減少介入治療的次數,對于肝硬化基礎的HCC患者尤其有優勢。
由于本研究是一個單中心、回顧性研究,有關結論還需在前瞻性的多中心大樣本研究中進一步確認。

