海洋柴油降解細菌的篩選鑒定及其生物表面活性劑特性
馬斌斌,馬恒軼,李少君,鄧歡歡*
(1.溫州醫科大學 公共衛生與管理學院,浙江 溫州 325035; 2.浙江省流域水環境與健康風險研究重點實驗室,浙江 溫州 325035;3.溫州偉明環保能源有限公司,浙江 溫州 325000)
生物表面活性劑是由微生物細胞產生的具有特殊生物活性的物質,可有效地降低空氣—水、油—水和固—液之間的界面張力[1]。生物表面活性劑不但囊括了化學合成表面活性劑的所有特性,而且還具有分子結構多樣、選擇性廣泛,無毒、對生態環境友好,可生物降解,在高溫、高鹽、高pH等極端環境下能穩定存在并發生作用的特性,臨界膠束濃度低,且發酵原料在自然界分布廣泛,是典型的“綠色”生產,在除油和生物生態修復方面具有巨大的應用潛力[2]。
海洋是地球上最大的生物圈,約占地球總面積的70%,蘊藏著豐富的微生物資源,為人類生存提供了巨大的生產資源,是人類在地球上賴以生存的最重要的物質條件之一,然而它正遭受著人類生活和工業生產廢油的嚴重污染。面對這些海洋污染,人們習慣用化學方法進行簡單處理,但是大多化學治理方法對環境易造成二次污染。大量研究認為,以微生物為主的生物修復法具有更高的生物降解能力和環境兼容性。從長期受油污染的海水中篩選出能夠產生物表面活性劑的高效柴油降解菌是此類研究的關鍵[3]。本研究從浙江舟山漁場油污染嚴重的海水中分離篩選到一株柴油降解菌,現將相關研究結果報道如下。
1 材料與方法
1.1 樣品采集與處理
本研究海水樣品取自浙江舟山油污染嚴重的定海碼頭和馬峙渡口,分別標記為DH和MZ。取回的油污染嚴重的表層海水置于經滅菌處理的采樣瓶中密封低溫保存,帶回實驗室。
1.2 培養基制備
富集培養基:NaCl 24.0 g,MgSO4·7H2O 7.0 g,NH4NO31.0 g,KCl 0.70 g,KH2PO42.0 g,Na2HPO4·12H2O 3.0 g,微量元素液5 mL,經0.22 μm濾膜過濾的0#柴油2 mL,蒸餾水1 L,pH值7.4。
發酵培養基:(NH4)2SO410 g,KCl 1.1 g,NaCl 1.1 g,FeSO4·7H2O 0.28 mg,KH2PO43.4 g,K2HPO4·13H2O 4.4 g,MgSO4·7H2O 0.5 g,酵母膏0.5 g,微量元素液0.5 mL,經0.22 μm濾膜過濾的0#柴油2 mL,蒸餾水1 L,pH值7.4。
微量元素液:ZnSO4·7H2O 0.029 g,GaCl20.024 g,CuSO40.025 g,MnSO4·H2O 0.017 g,蒸餾水100 mL。
1.3 產生物表面活性劑柴油降解菌的篩選
1.3.1 柴油降解菌的分離和柴油降解率的測定
取10 mL海水樣品加到裝有100 mL富集培養基的錐形瓶中,28 ℃、200 r·min-1恒溫搖床培養7 d,然后移取10 mL培養液轉接到新的培養液中,如此轉接培養4次后進行平板涂布,挑選不同的單菌落劃線分離,編號,-20 ℃斜面保存。
將各單菌落分別接種于以柴油為唯一碳源的發酵培養液中,28 ℃、200 r·min-1培養7 d,然后用20 mL沸程為60~90的石油醚萃取發酵液中未降解的柴油,萃取液低溫高速離心10 min,取20 μL離心液稀釋10倍,用紫外分光光度法測定各單菌株的柴油降解率[4]。
1.3.2 排油圈直徑的測定
在直徑為90 mm的平皿中加入50 mL蒸餾水,然后將1 000 μL的液體石蠟緩緩加在蒸餾水表面,待其均勻鋪開形成油膜,在油膜中心加20 μL離心除去菌體的細菌發酵液,待其推開油膜形成排油圈,測定排油圈直徑[5]。
1.3.3 表面張力的測定
利用全自動表/界面張力儀測定發酵液的表面張力(空白樣的表面張力為74 mN·m-1),每個樣品組測定3次取平均值[6]。
1.3.4 免疫溶血實驗
將純化的各單菌株點樣接種于血平板上,28 ℃恒溫培養24 h,觀察單菌落周圍有無透明的溶血圈,并比較溶血圈直徑大小[7]。
1.4 菌種鑒定
通過形態學觀察、生理生化實驗和16s rRNA序列分析,對篩選得到的產表面活性劑的菌株進行菌種鑒定。首先將菌株接種于DifcoTMMatine Agra 2216培養基,28 ℃純化培養1 d,提取基因組DNA,將DNA稀釋至70 ng·μL-1用作PCR擴增模板,利用正向引物(5′-3′,AGAGTTTGATCCTG GCTCAG)和反向引物(5′-3′,GGTTACCTTGTTA CGACTT)進行擴增。擴增體系25 μL為模板DNA 0.5 μL,10×buffer 5 μL,25 mmol·L-1MgCl24 μL,dNTP 1 μL,正反向引物各1 μL,TaqDNA聚合酶0.25 μL。擴增結束后測序,測序結果利用細菌模式網站(http://eztaxon-e.ezbiocloud.net/)和NCBI進行對比,找出同源性最高的已知菌種,從GenBank數據庫中找出近源菌株的16s rRNA序列,與測定序列共同進行Clustal X程序校準多序列比較,再用MEGA6軟件以鄰接法構建系統發育樹。
1.5 生物表面活性劑的鑒定及特性分析
1.5.1 表面活性劑的提取
發酵液在4 ℃、12 500 r·min-1條件下離心30 min去除菌體,用6 mol·L-1的HCl調上清液pH值至小于2.0,4 ℃過夜。然后將相同體積上清和氯仿-甲醇(V∶V為4∶1)溶液共同加到梨形分液漏斗中萃取沉淀,有機相減壓蒸餾得到表面活性劑粗品,將粗品溶于0.5 mol·L-1的NaHCO3溶液中過濾,用6 mol·L-1的HCl調濾液pH值為2.0,4 ℃靜置24 h,4 ℃、12 500 r·min-1再次離心15 min收集沉淀,真空冷凍干燥得成品。
1.5.2 薄層色譜
將表面活性劑純品溶于甲醇溶液,點樣于硅膠板,以氯仿-甲醇-水(V∶V為4∶3∶2)為流動相進行表面活性劑展層。然后在硅膠板上均勻噴灑酸性茚三酮溶液,110 ℃條件下顯色10 min,脂質表面活性劑顯紅色斑點[8]。
1.5.3 傅里葉變換紅外光譜
取1 mg表面活性劑純品壓片于4 000~400 cm-1光區進行紅外光譜掃描。
1.5.4 氣相質譜脂肪酸分析
取5 mg的表面活性劑純品,用1 mL 6 mol·L-1的HCl溶液90 ℃水解24 h,然后加入5 mL的超純水,用1 mL乙醚萃取3次,合并萃取相并吹干,加入1 mL體積分數為10%的硫酸甲醇溶液,55 ℃條件下酯化360 min。加入5 mL的超純水,乙醚萃取3次,合并吹干,加入0.5 mL甲醇超聲溶解,過濾,進行GC/MS分析。氣相色譜條件:高純度氦氣(99.999%),進樣口溫度250 ℃,流速1 mL·min-1,分流比10∶1,進樣量1 μL。程序升溫條件:起始溫度120 ℃維持3 min,10 ℃·min-1升溫至260 ℃,維持5 min。質譜條件:EI離子源溫度230 ℃,電力電壓70 eV,四極桿溫度150 ℃[9]。
1.5.5 乳化性能和臨界膠束濃度測定
取各菌株發酵液和液狀石蠟各5 mL分別加入試管中,漩渦振蕩2 min混勻,室溫靜置24 h后測量乳化層高度,乳化穩定值(E24)=乳化層高度/液體總高度×100[10]。
將表面活性劑純品配成100%~0梯度濃度的溶液,用表面張力儀于室溫下測定各濃度的表面張力,繪制濃度-表面張力曲線,確定臨界膠束濃度。
2 結果與分析
2.1 降解菌的篩選
經過富集培養、測定各菌株的柴油降解率,初步篩選出7株柴油降解菌,依次標記為DHA、DHB、DHC、DHE、MZA、MZB、MZC(表1),其中,菌株DHA對柴油的降解率最高,達82.7%,且免疫溶血為陽性(圖1),排油圈直徑為6.0 cm,高于其他菌,發酵液體表面張力可從74 mN·m-1降至21.66 mN·m-1,明顯低于其他菌株的表面張力。綜合以上結果,判定菌株DHA產生了表面活性劑。
2.2 降解菌株的鑒定
DHA菌株的生理生化實驗結果如下:革蘭氏染色,陽性;MR反應,陰性;VP反應,陰性,蔗糖發酵,陽性;檸檬酸實驗,陰性;明膠液化,陰性;吲哚實驗,陰性;硫化氫實驗,陰性。對菌株DHA的16s rRNA序列進行比對分析,選取同源性高的16s rRNA序列,利用MEGA 6軟件進行統計分析,并將結果構建系統發育樹(圖2),結合泊杰氏細菌鑒定手冊,DHA被最終鑒定為不動桿菌(Acinetobacter)。

表1 柴油降解率、免疫溶血、排油圈、 表面張力實驗結果
注:+表示陽性反應,-表示陰性反應。

圖1 DHA菌株的免疫溶血實驗結果
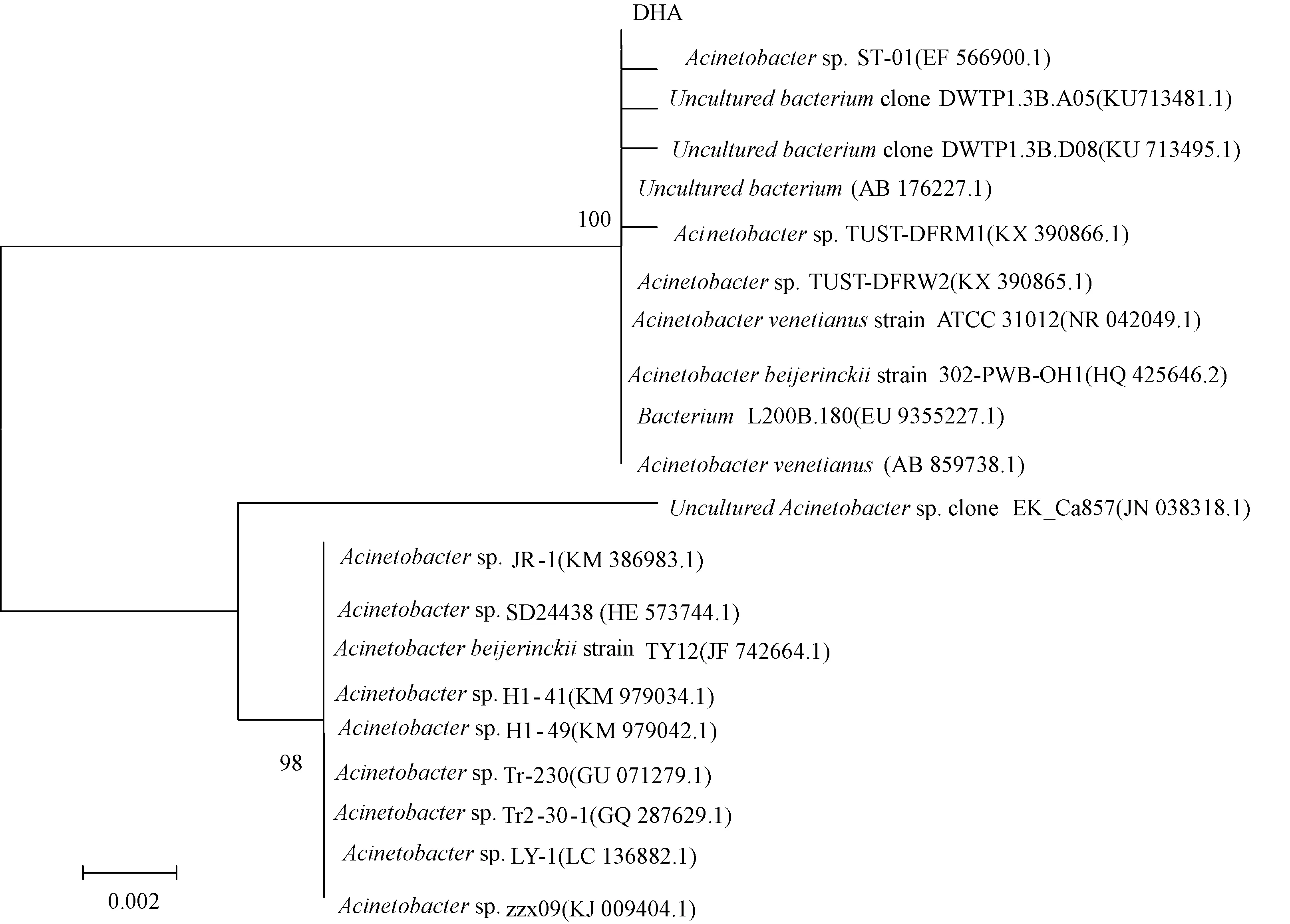
圖2 菌株DHA的系統發育樹
2.3 表面活性劑的鑒定

2.4 表面活性劑的組成
通過GC/MS對脂肽脂肪酸進行結構組成分析,總離子色譜圖如圖5所示,質譜圖如圖6所示。圖中質核比m/z=103的基峰為典型的β-羥基脂肪酸甲脂的特征峰,即[CH(OH)CH2COOCH3]+離子碎片。β-羥基脂肪酸甲脂離子峰失去(CH3OH+H2O)、H2O和H分別產生M-50、M-18、M-1的離子碎片峰,據此可得出,脂肪酸甲脂為C15β-羥基脂肪酸甲脂,所以菌株DHA產生的表面活性劑主要是由C15β-羥基脂肪酸構成的。
2.5 表面活性劑的特性
經測定和計算,菌株DHA產生的生物表面活性劑乳化效率高達64.7%,臨界膠束濃度為52.2 mg·L-1(圖7)。

圖3 產物的薄層色譜
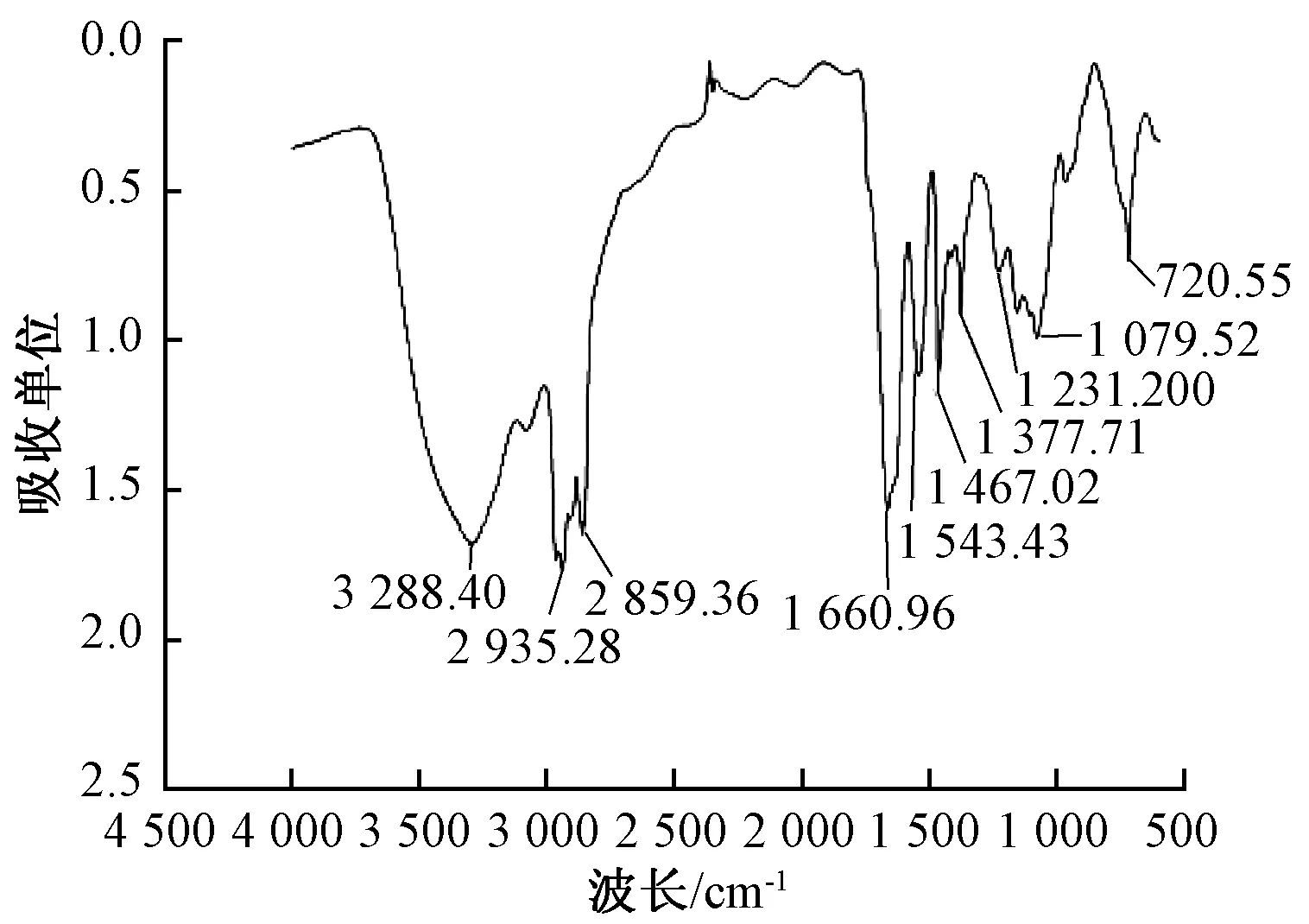
圖4 產物的紅外光譜掃描
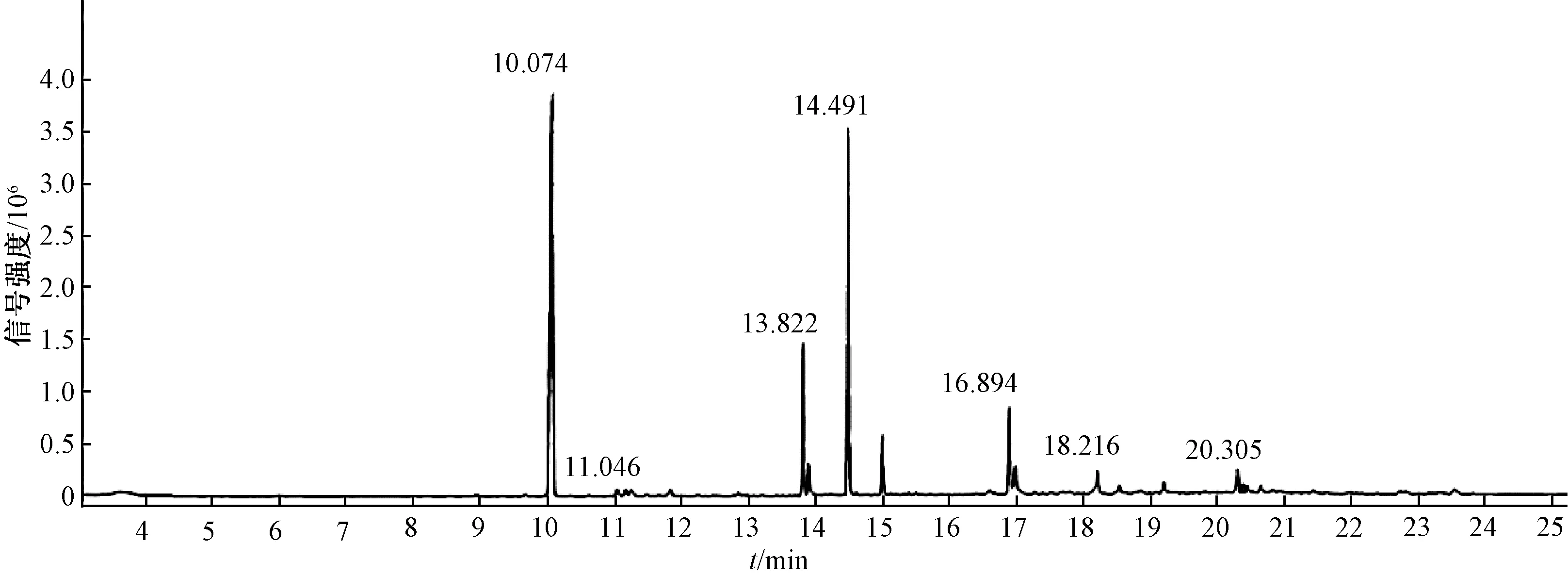
圖5 產物水解酯化后的總離子色譜
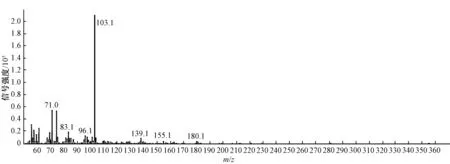
圖6 脂肪酸甲脂的質譜
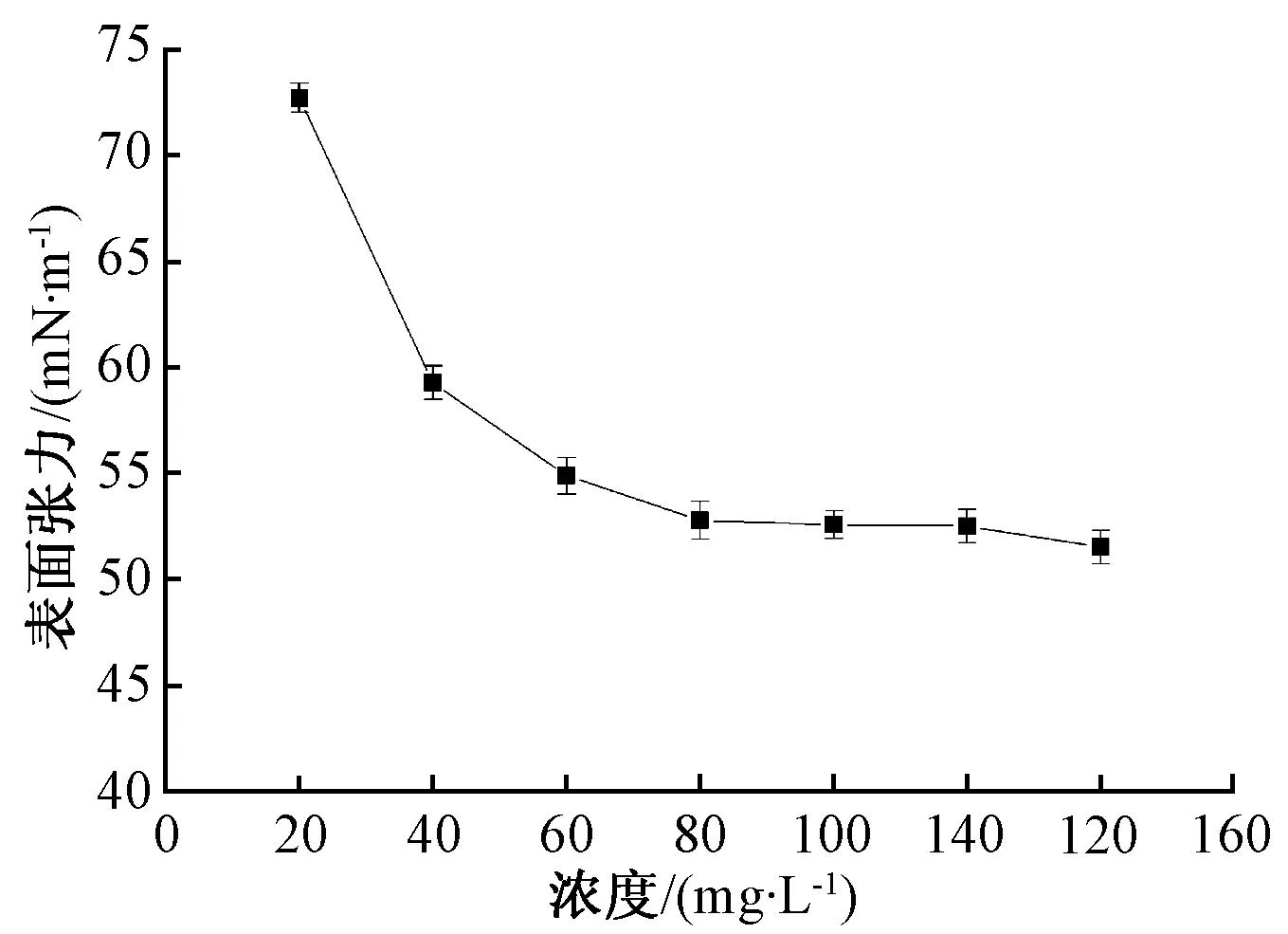
圖7 表面活性劑表面張力曲線
3 小結與討論
本研究從浙江省舟山漁場柴油污染的海水中篩選得到1株產脂肽類生物表面活性劑的高效柴油降解菌株DHA,經鑒定為不動桿菌(Acinetobacter),其對柴油的降解率達82.7%,發酵產生的表面活性劑為脂肽,乳化效率為64.7%,臨界膠束濃度為52.2 mg·L-1,主要由C15長鏈脂肪酸構成。
生物表面活性劑具有化學表面活性劑不具備的特殊性能,對疏水性有機化合物具有很好的乳化作用,因而能有效地提高環境中難降解有機污染物的生物降解速率;因此,產生物表面活性劑的微生物在生態環境修復中具有很好的應用潛力。產生物表面活性劑的微生物廣泛存在于自然環境中,尤其是在有機污染物污染的環境中,比如煉油廠的地面土壤、廢水和廢油中[11]。從被原油污染的海水中分離篩選出產生物表面活性劑微生物的研究已有報道:Hassanshahian等[12]從波斯灣和里海被污染的海水中分離得到25株原油降解菌株,其中有11株可產生生物表面活性劑;Yateem等[13]從被柴油污染的土壤中篩選到1株可降解柴油的枯草芽孢桿菌,該菌株可產生脂肽類生物表面活性劑。本研究證明,舟山海洋生態系統中存在廢油降解微生物,這些廢油降解微生物可產生脂肽類生物表面活性劑,這為浙江近岸海域油污染海水的生物修復提供了生物材料與科學依據,對進一步治理海洋環境污染具有一定的參考價值和應用潛力。
[1] YU M, LIU Z, ZENG G, et al. Characteristics of mannosylerythritol lipids and their environmental potential[J]. Carbohydrate Research, 2015, 407:63-72.
[2] 劉全永, 胡江春, 薛德林,等. 海洋微生物生物活性物質研究[J]. 應用生態學報, 2002, 13(7):901-905.
[3] MEHDI H, GITI E. Investigation of alkane biodegradation using the microtiter plate method and correlation between biofilm formation, biosurfactant production and crude oil biodegradation[J]. International Biodeterioration & Biodegradation, 2008, 62(2):170-178.
[4] 武金裝, 劉紅玉, 曾光明,等. 柴油降解菌的篩選及其降解特性研究[J]. 農業環境科學學報, 2008, 27(5):1742-1746.
[5] PADMAVATHI A R, PANDIAN S K. Antibiofilm activity of biosurfactant producing coral associated bacteria isolated from gulf of mannar[J]. Indian Journal of Microbiology, 2014, 54(4):376-382.
[6] MANIVASAGAN P, SIVASANKAR P, VENKATESAN J, et al. Optimization, production and characterization of glycolipid biosurfactant from the marine actinobacterium,Streptomyces, sp. MAB36[J]. Bioprocess & Biosystems Engineering, 2014, 37(5):783-797.
[7] KESKIN N O S, HAN D, OZKAN A D, et al. Production and structural characterization of biosurfactant produced by newly isolatedStaphylococcusxylosus, STF1 from petroleum contaminated soil[J]. Journal of Petroleum Science & Engineering, 2015, 133:689-694.
[8] OJEDA-MORALES M E, DOMNGUEZ-DOMNGUEZ M, HERNNDEZ-RIVERA M A, et al. Biosurfactant production by strains ofAzospirillum, isolated from petroleum-contaminated sites[J]. Water Air & Soil Pollution, 2015, 226(12):401-416.
[9] SHARMA D, SAHARAN B S, CHAUHAN N, et al. Isolation and functional characterization of novel biosurfactant produced byEnterococcusfaecium[J]. Springerplus, 2015, 4(1):4-18.
[10] MNIF I, MNIF S, SAHNOUN R, et al. Biodegradation of diesel oil by a novel microbial consortium: comparison between co-inoculation with biosurfactant-producing strain and exogenously added biosurfactants[J]. Environmental Science & Pollution Research, 2015, 22(19):14852-14861.
[11] ZHOU H, CHEN J, YANG Z, et al. Biosurfactant production and characterization ofBacillus, sp. ZG0427 isolated from oil-contaminated soil[J]. Annals of Microbiology, 2015, 65(4):2255-2264.
[12] HASSANSHAHIAN M, EMTIAZI G, CAPPELLO S. Isolation and characterization of crude-oil-degrading bacteria from the Persian Gulf and the Caspian Sea[J]. Marine Pollution Bulletin, 2012, 64(1):7-12.
[13] YATEEM A, BALBA M T, AL-SHAYJI Y, et al. Isolation and characterization of biosurfactant-producing bacteria from oil-contaminated soil[J]. Soil & Sediment Contamination, 2002, 11(1):41-55.

