微型月季快繁技術體系
高 燕,鐘素飛,奉樹成
(上海植物園 上海城市植物資源開發應用工程技術研究中心,上海 200231)
微型月季(RosachinensisMinima或Rosaroelletti)為薔薇科多年生木本植物,株型矮小,整體植株不超過30 cm[1]。葉片和花朵嬌小,花朵直徑3 cm左右,色彩絢麗,單朵花期10 d左右,整株花期可達1個月,適應性強,一年內多次花芽分化,是一種優良的園林綠化和盆栽材料[2]。微型月季因小巧玲瓏、花量大、不間斷開花、花色絢爛等原因備受人們喜愛。但因株型矮小、節數少,加之受種苗數量、季節等諸多因素的制約[3],常規扦插和嫁接繁殖方法的繁殖系數低、繁殖速度慢、成本高[4]。為此,特開展微型月季組織培養體系研究,以提高育苗產量,降低成本。
1 材料與方法
1.1 材料
試驗于2016—2017年在上海植物園進行。材料取自上海植物園薔薇園。2016年3月初,取微型月季莖尖部位作為外植體,進行組織培養。
主要試劑包括75%乙醇、0.1% HgCl2、體積分數0.5%的吐溫20。純凈水、裝有50 mL純凈水的100 mL三角瓶、鑷子、托盤、濾紙,121 ℃滅菌18 min備用。
1.2 方法
取微型月季莖段上部較柔軟部分1~2 cm(帶腋芽),去除葉片,在加洗潔精的水中清洗20 min,再用流水沖洗1 min。在超凈工作臺中,將沖洗干凈的微型月季莖尖投入裝有50 mL純凈水的100 mL三角瓶中清洗1次,然后用75%乙醇振蕩清洗30 s、無菌水沖洗2次,再用0.1% HgCl2+體積分數0.5%的吐溫20消毒,最后無菌水沖洗5次,濾紙吸干莖段表面水分。
以下培養基配置中如無特殊說明,均須添加蔗糖30 g·L-1、瓊脂7.8 g·L-1,并調節pH值至5.8。
1.3 處理設計
1.3.1 滅菌
按1.2節方法操作至加入HgCl2和吐溫20,分別滅菌3、6、9 min,用無菌水沖洗外植體5次以盡量減少HgCl2對外植體的傷害。然后,用無菌濾紙吸干外植體表面水分待用。比較不同滅菌時間下微型月季莖尖的污染率和出芽率。
1.3.2 誘導培養
以MS為基本培養基,添加不同濃度的6-BA和NAA,以誘導微型月季莖尖出芽。6-BA濃度分別設定為0、1、2 mg·L-1,NAA濃度分別設定為0、0.1、0.2 mg·L-1。
1.3.3 增殖培養
增殖過程是促進微型月季細胞不斷分裂、分化,形成大量芽的過程。以MS為基本培養基,添加不同濃度的6-BA和NAA,對誘導培養基上誘導出的芽進行增殖培養,觀察微型月季發育情況,確定最佳增殖培養基。6-BA濃度分別設定為0、1、2 mg·L-1,NAA濃度分別設定為0、0.06、0.12 mg·L-1。
1.3.4 生根培養
英國史上最糟糕的麥克風政治風波發生在1993年,主角是時任首相梅杰。他罵內閣部分成員是“野種”,聲稱他們會被“釘死在十字架上”。事后,他遭到了國內嚴厲的指責。
以1/2 MS為基本培養基,對比添加0.3 mg·L-1IBA和不添加IBA條件下微型月季的生根情況。
1.4 煉苗和移栽
獲得帶根的健康微型月季組培苗后,將苗移植入大棚。選擇最適合的基質和最佳生長條件,以保證微型月季正常生長。
2 結果與分析
2.1 滅菌
滅菌3 min,污染率為93.3%,基本整個莖尖受到污染;滅菌6 min,污染率降低到13.3%,繼續培養20 d,出芽率可達73.3%,長出的新芽發育狀況良好;滅菌9 min,污染率僅為6.7%,但繼續培養20 d,出芽率降至20.0%。綜上,以滅菌6 min較適宜。
2.2 誘導培養
由表1可以看出,不添加6-BA,NAA濃度分別為時0、0.1、0.2 mg·L-1時,基本無法誘導出芽或者誘導率很低。當6-BA為1 mg·L-1、NAA為0.1、0.2 mg·L-1時,誘導率分別為83.3%和73.3%,誘導22 d左右可出芽,芽生長速度快,發育正常。當6-BA為2 mg·L-1、NAA為0.2 mg·L-1時,誘導率為60.1%,但誘導出的芽培養一段時間后,有玻璃化傾向,特別是芽基部畸形,個別出現芽連在一起且透明化的情況。綜上,MS+6-BA 1 mg·L-1+NAA 0.1 mg·L-1適合微型月季誘導出芽,經過22 d培養,83.3%的莖段可誘導出芽,新芽生長速度快,發育正常,生長健康。
2.3 增殖培養
幼苗生長至1.5 cm左右時,從基部切下,轉至增殖培養基中。由表2可知,MS培養基中不添加6-BA時,其伸長和增殖速度緩慢。添加1 mg·L-16-BA+0.06 mg·L-1NAA時,芽的生長速度明顯加快,伸長倍率達到3.84,增殖倍率為4.20,植株健康,芽生長迅速、粗壯,增殖速度快。添加1 mg·L-16-BA+0.12 mg·L-1NAA時,伸長倍率為3.51,對應的增殖倍率為3.93,芽生長迅速,少數有畸形,個別有生根。當6-BA為2 mg·L-1時,生長速度較快,但是苗不粗壯,并隨著NAA濃度的升高,逐漸出現玻璃化現象。由此可知,最佳增殖培養基為MS+1 mg·L-16-BA+0.06 mg·L-1NAA,此時芽生長迅速且健康,節間短,增殖速度快。

表1 6-BA和NAA濃度對微型月季誘導出芽的影響
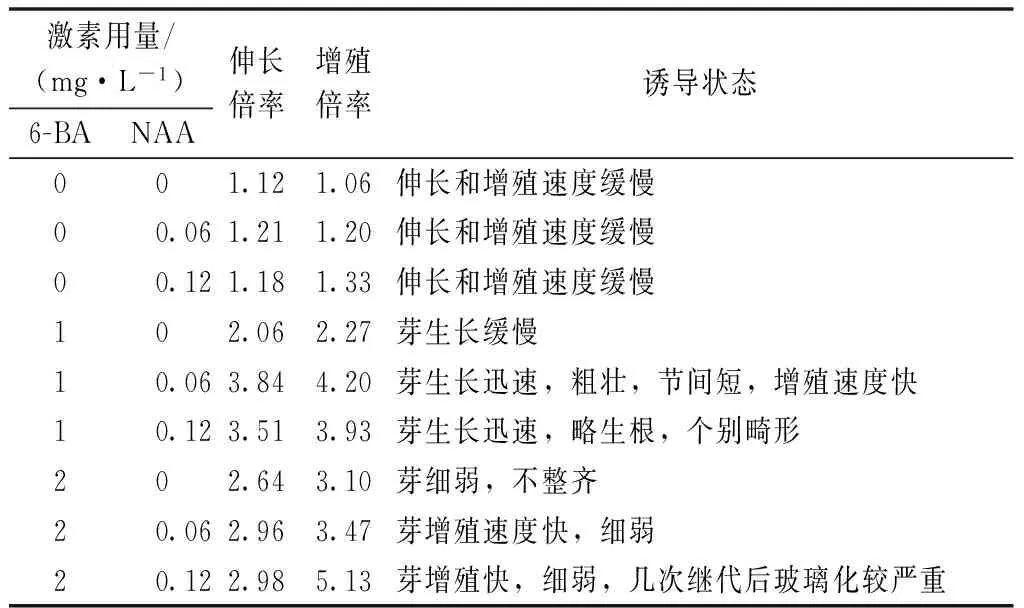
表2 繼代1個月時不同激素含量對微型月季 增殖的影響
2.4 生根培養
叢生芽長到3~4 cm時,轉至生根培養基。從表3可以看出:不添加激素,僅用基本培養基1/2MS情況下,平均生根數為3.69,平均根長為4.12 cm,此時植株伸長系數為1.46倍,生根率為86%。在基本培養基1/2 MS中添加IBA 0.3 mg·L-1,生根數有了很大提升,接近無激素培養基的2倍,達7.24,平均根長略短于無激素培養基,為3.79 cm,莖段伸長倍率為1.98,生根率為98%。由此可知,1/2 MS+IBA 0.3 mg·L-1是更適宜的生根培養基。
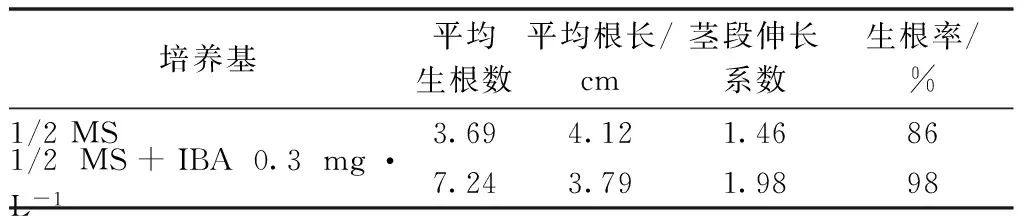
表3 繼代1個月時不同培養基對微型月季增殖和 生根的影響

圖1 生根2個月后根的生長情況
2.5 煉苗和移栽
在生根培養基上生長1個月后,植株健康且健壯,待植株生長至4 cm左右、有大量健康根時,可以煉苗、移栽。在培養間揭去瓶蓋放置3 d后,用清水沖洗根,除掉黏附其上的培養基,略微整理并種植于內置珍珠巖的穴盤中,穴盤規格45 cm×45 cm,每個穴盤種植150株左右。2個月后觀察,主根發育明顯,生長健壯,成活率可達98%。每個月噴灑2次0.1%多菌靈。經過2個多月,由于珍珠巖無法保存營養成分,且受密植條件限制,須將健康植株轉至新的營養缽中。營養缽內基質為草炭∶珍珠巖3∶1(體積比),移栽20 d后每月施1/1 000氮磷鉀肥(圖2)。

圖2 煉苗移栽后微型月季開花
3 小結與討論
組織培養是利用植物細胞全能性原理實施的技術[5]。從原理上來說,植物的每個細胞都可以發育成一個獨立的個體,但由于現有技術的局限性,目前還不能完全實現。實際操作中,一般會選擇植物分生能力較強的部位作為外植體進行培養,例如莖尖、腋芽、根尖等,細胞的分裂和分化能力直接決定了組織培養中細胞的繁殖速度和繁殖效率。本試驗中選取微型月季莖段帶腋芽的幼嫩部位,即選取分生能力較強的部位作為外植體進行試驗,有利于后期培養過程中的快速繁殖。
組織培養要在完全無菌條件下進行。要獲得完全無菌的接種材料,一方面可以選取植物組織內部無菌的材料,另一方面,可以通過消毒處理殺死植物材料表面存在的各種微生物。一般多根據試驗材料選用合適的消毒劑及適合的濃度和處理時間,以及合適的消毒方法[6]。常規試驗中經常使用5%~10%漂白粉、70%~75%酒精、0.1%~0.2%升汞,及2%~10%次氯酸鈉等滅菌液脫毒[7]。本試驗采用添加了體積分數0.5%吐溫20的0.1%升汞溶液作為滅菌溶液,滅菌6 min,隨后用無菌水多次沖洗,以減少升汞對外植體的毒害。吐溫主要起到增加滲透性、提高滅菌效率的作用。在此條件下,污染率降至13.3%。20 d后出芽率可達73.3%,且新出芽體健康,色澤翠綠,生長迅速。
生長素和細胞分裂素在組織培養中是常用的激素。激素的正確配比可以促進外植體的生長,在組織培養過程中具有決定性作用。生長素和細胞分裂素不一定適用于組織培養的每個步驟,其使用情況取決于植物各階段發育情況。本試驗中,誘導和增殖步驟均使用生長素NAA和細胞分裂素6-BA,而生根過程采用的是生長素IBA。采用6-BA 1 mg·L-1和NAA 0.1 mg·L-1是比較適合微型月季誘導的配比,在此配比下,經過22 d的生長,莖段誘導率可達83.3%,芽生長情況較好。增殖過程中最佳的激素方案為MS+6-BA 1 mg·L-1+NAA 0.06 mg·L-1+蔗糖 30 g·L-1+瓊脂7.8 g·L-1,此時伸長倍率3.84,對應增殖倍率4.20,植株健康,莖段粗壯,節間短,生長旺盛。在快速增殖過程中,除了基部分化不定芽外,伸長的每個節間也可以切斷用于增殖,繁殖速度大大提高。過高的生長素或分裂素會引起植株的玻璃化。植物組織玻璃化,即植物結構發育畸形,是一種生理失調或生理病變,很難繼續用于繼代培養和擴繁材料[8]。IBA是人工合成生長素,在促進生根過程中起重要作用。本試驗中,添加IBA與無激素添加培養基生根效果差異明顯,添加IBA的培養基生根量接近無激素培養基的2倍,生根率也從原來的86%提高到98%。
植株在生根培養基上促進根生長,但是過長的根會導致其纏繞,增加煉苗難度,且過長的根在轉移到基質后會腐爛。因此培養1個月,根長至3~5 cm即可取出煉苗。為了逐漸適應外界環境,首先在培養室下開蓋3 d,適應外部環境后,取出幼苗并用流水沖洗去除培養基,用于煉苗。培養基徹底清除才能防止苗發霉長菌,但不是去除培養基即可保證后期不會發霉長菌,因此在煉苗后須定期噴灑多菌靈溶液,同時須保證通風良好。煉苗最初采用珍珠巖固定根部,大孔隙可以保持根部生長環境良好,但珍珠巖保水性較差,因此需要每天澆水。隨后生長2個月,根得到了足夠生長,主根明顯,此時需要寬松、保水和提供養分的基質,因此將植株轉移到草炭∶珍珠巖3∶1(體積比)基質中,并定期施加薄肥。大的營養缽可以提供足夠的土壤空間和肥力,有利于植物的正常發育。
[1] 蒲建霞. 微型月季組培快繁技術[J]. 北方園藝, 2006(4):156.
[2] 牟會斌. 微型月季微繁體系的構建及組培生根機理研究[D]. 南京:南京農業大學, 2001.
[3] 張作梅. 微型月季組培快繁技術體系的研究[D]. 合肥:安徽農業大學, 2009.
[4] 劉慧. 微型月季莖段組培快繁技術研究[J]. 北方園藝, 2011(14):114-116.
[5] 高燕, 宋垚, 葉康,等. 礬根歐布西迪昂組培快繁技術[J]. 浙江農業科學, 2015 (6):895-898.
[6] 高燕, 魏宇昆, 奉樹成. 貴州鼠尾草組織培養育苗技術[J]. 浙江農業科學, 2017, 58(3):407-411.
[7] 楊海蓮, 孫曉潞, 宋未. 植物內生細菌的研究[J]. 微生物學通報, 1998, 25(4):224-227.
[8] 胡彥, 趙艷. 植物組織培養技術的應用以及在培養過程中存在的問題[J]. 陜西師范大學學報(自然科學版), 2004,32(專輯):130-134.

