巴迪亞壽的組織培養及育苗技術
茅汝佳,高 燕
(上海植物園 上海城市植物資源開發應用工程技術研究中心,上海 200231)
壽為百合科瓦葦屬(Haworthia)多年生草本植物[1],原產于南非。大多數壽葉片呈蓮座狀緊密排列,有線狀脈紋[2]。巴迪亞壽(Haworthiamirabilisvar. badia)是近些年雜交出的新的園藝品種,屬于硬葉類植株,葉緣有白色小刺,葉表面有白色條紋,呈現透明或半透明的窗[3],松散總狀花序,白色小花。由于其外形可愛、生長緩慢,備受園藝工作者和花卉愛好者的喜愛。
瓦葦屬植物很多品種自交不親和[4]。目前市面上的大多為分株繁殖和葉插繁殖,這類方法都存在繁殖速度慢、繁殖系數低、生長速度慢等問題,而采用組織培養的方法可以很好地解決。近些年,同屬部分多肉品種組培獲得成功,目前有康平壽[5]、截型十二卷[6]、克里克特壽[7]、冰沙糖壽[8]等多肉品種組織培養的相關報道。
1 材料與方法
1.1 材料
實驗于2015—2016年在上海植物園科研中心實施。巴迪亞壽取自上海植物園多肉館,如圖1。在幼嫩花序抽長并且花蕾尚未展開時,截取整個花莖部位作為起始材料。
圖1 巴迪亞壽幼嫩花序
1.2 方法
取巴迪亞壽幼嫩花序部位,去除閉合花蕾的外苞片,將花蕾連同花柄逐個分離,放置玻璃瓶中,紗布封口。花序部位先用洗潔精溶液浸泡30 min,后在流水下沖洗2 h。準備酒精燈、75%乙醇、2%次氯酸鈉溶液、0.1%升汞溶液。提前滅菌以下材料:玻璃瓶裝ddH2O、封口100 mL三角瓶、紗布、鑷子、手術刀、濾紙。
1.2.1 滅菌
以下工作均在超凈工作臺中完成:外植體放置于無菌三角瓶中,用無菌水沖洗2次后,75%乙醇振蕩清洗30 s,再用無菌水沖洗2次。隨后用2%次氯酸鈉溶液和0.1%升汞溶液兩種消毒液對外植體消毒,再用無菌水沖洗6次后,濾紙吸干水分,放置于培養基上。消毒液和消毒時間的差異對外植體誘導有不同的影響,根據誘導階段出芽的差異確定最佳消毒辦法。
1.2.2 誘導培養
利用MS為基本誘導培養基,添加不同濃度的激素。激素采用細胞分裂素6-BA和生長素NAA形成不同組合,6-BA的濃度范圍為0~2 mg·L-1,NAA的濃度范圍為0~0.2 mg·L-1。根據誘導結果確定最佳誘導培養基組合。
1.2.3 增殖培養
利用MS為基本培養基,添加不同激素,配置增殖培養基。激素采用細胞分裂素6-BA和生長素NAA形成不同組合,6-BA的濃度范圍為0~2 mg·L-1,NAA的濃度范圍為0~0.04 mg·L-1。根據增殖階段植物的生長狀態和增殖率確定最佳增殖培養基。
1.2.4 生根培養
以1/2MS為基本培養基,添加不同濃度激素,激素分別采用IAA、IBA、NAA 3種,濃度范圍為0~1 mg·L-1,配置成不同的生根培養基。根據苗生長狀態、根生長狀態、生根率和根長等確定最佳生根培養基。
1.2.5 馴化移植
組培生根后,在自然光照下培養1周,揭開瓶蓋放置3 d。取出組培苗放置水盆中,清洗附著在苗上的培養基。將清洗過的組培苗放置陰干一周后,整理根并種植于穴盤中。
1.2.6 育苗培養
組培苗在馴化移植成功后,從穴盤轉至營養缽中。基質仍然采用草炭∶火山石∶鹿沼土∶赤玉為3∶1∶1∶2(V∶V)。室內溫度保持20 ℃左右,濕度85%,每1個月澆水使用多菌靈溶液起到殺菌的功效。如有條件,可以每月施加薄肥一次。
2 結果與分析
2.1 滅菌方法的篩選
滅菌材料為壽幼嫩花序,每1.0~1.5 cm截取成一小段,分離單個未展開花蕾,去除苞片。在經過初步洗潔精和流水浸泡沖洗后,先用75%乙醇浸泡30 s,清水沖洗2次,再嘗試2種滅菌液滅菌,分別為2%次氯酸鈉溶液和0.1%升汞溶液。由于兩種滅菌液的滅菌效率不同,對外植體的傷害也不同,選取適合的滅菌時間尤為重要。實驗中,用2%次氯酸鈉溶液分別對外植體滅菌6、12和18 min,用0.1%升汞溶液分別對外植體滅菌5、8和11 min,獲得不同的污染率和出芽率。如表1所示,用2%次氯酸鈉溶液滅菌12 min時,相比較同滅菌液的另外兩個滅菌時間,出芽率最高為35%,此時對應的污染率為12.5%。當用2%次氯酸鈉溶液滅菌18 min時,污染率比12 min的滅菌時間更低,僅為2.5%,但是由于滅菌液對外植體的滅菌時間過長,出芽率降低為7.5%。與之對應,采用0.1%升汞溶液作為滅菌液,滅菌8 min時,污染率為7.5%,此時的出芽率為75%,而滅菌時間達到11 min后,污染率為0,此時的出芽率降低為5%。綜合比較,以高出芽率和正常出芽形態為目的,用0.1%升汞溶液滅菌8 min為最佳的滅菌方法,此時污染率為7.5%,而出芽率達到75%。
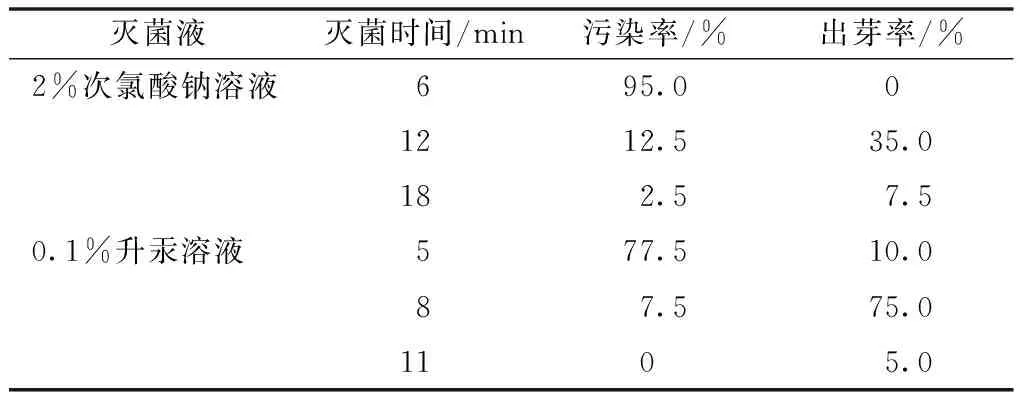
表1 不同滅菌液和滅菌時間對巴迪亞壽誘導 脫菌的影響
2.2 誘導階段激素選擇
以MS為基本培養基,添加6-BA和NAA兩種激素。生長素和細胞分裂素是組織培養誘導階段常使用的激素,適當的激素濃度配比可以促進組織誘導。
滅菌后的起始材料接種于誘導培養基上,培養基添加細胞分裂素6-BA和生長素NAA。如表2所示,6-BA 1 mg·L-1和NAA 0.1 mg·L-1時,誘導率最高為66.7%。此時,15 d左右可以出芽,生長速度較快且芽體發育正常。不添加激素的基本培養基上未能誘導出芽,最后起始材料呈灰褐色。只添加了NAA的情況下,誘導情況不理想,僅在NAA 0.1 mg·L-1時,有少量芽出現,誘導率僅為6.7%,且芽生長極為緩慢。當6-BA 1 mg·L-1時,少量細弱的芽出現,且生長較慢。6-BA 1 mg·L-1和NAA 0.2 mg·L-1時,15 d左右誘導出芽,在此情況下誘導出的芽生長較快且發育正常,此時誘導率為26.7%,基部有少量球形綠色愈傷形成。6-BA 2 mg·L-1時,芽的誘導率僅為13.3%,同時有少量綠色愈傷組織。當6-BA 2 mg·L-1,而NAA的含量升高達到 0.2 mg·L-1時,芽開始出現畸形的現象,芽體變形,芽膨大,玻璃化明顯,基部有愈傷。
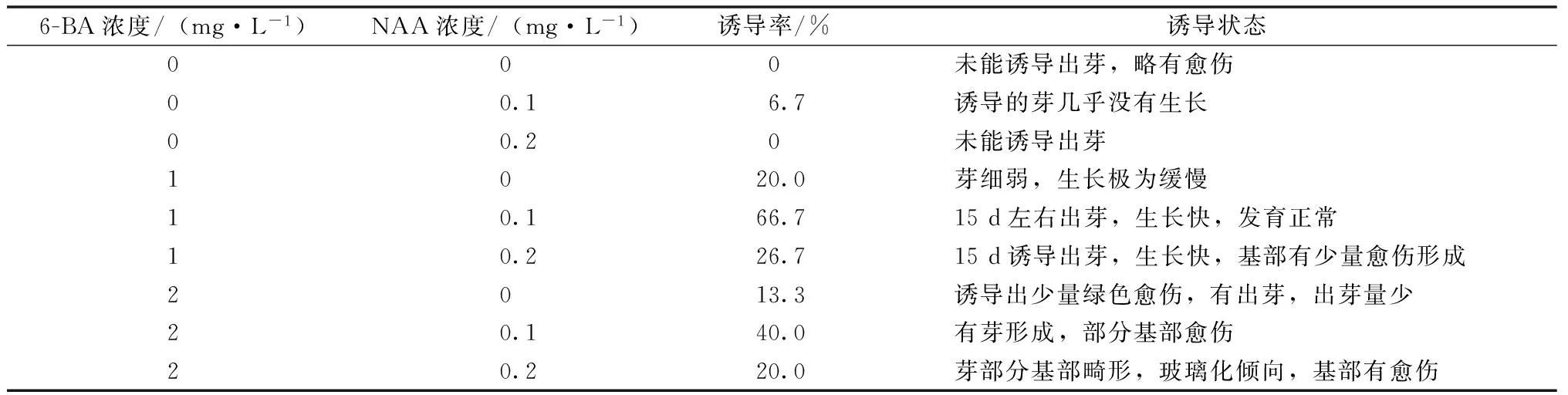
表2 不同激素含量對壽誘導的影響
由此可以看出,6-BA 1 mg·L-1和NAA 0.1 mg·L-1是最適合芽誘導的培養基組合,此時芽誘導率66.7%,沒有形成愈傷組織。
2.3 增殖階段激素選擇
經過誘導培養基接近1個月的培養,將誘導的芽轉至增殖培養基。如果芽基部有愈傷,撥除干凈再轉至培養基。
表3看出,不同激素濃度對巴迪亞壽的芽增殖有不同的影響。當不含6-BA時,增殖率較低,最高的只有1.85倍,苗伸長倍率最高也僅為1.39倍,整體來說略有生長,但是生長較弱。當6-BA 1 mg·L-1和NAA 0.02 mg·L-1時,芽的伸長倍率為2.65倍,對應的增殖倍率達到最大,為4.62倍,葉片生長明顯,形成大量新芽。當6-BA為2 mg·L-1時,芽的伸長和增殖倍率都略有下降,葉片細長,部分出現基部愈傷的現象。特別當6-BA和NAA濃度較高的時候,芽膨大變形成為綠色半透明的畸形苗,出現玻璃化現象。圖2看出,在增殖培養基(6-BA 1 mg·L-1和NAA 0.02 mg·L-1)上培養25 d,芽生長健壯,沒有畸形和玻璃化的情況。
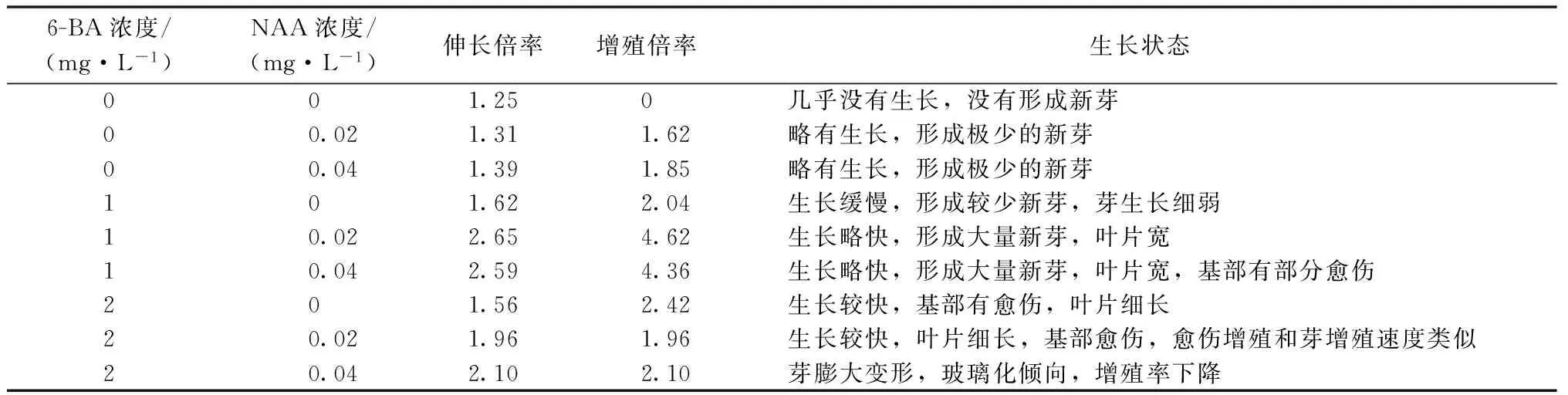
表3 不同激素含量對巴迪亞壽芽增殖的影響
2.4 生根培養
將增殖的芽分成單株取出轉接于生根培養基。基本培養基為1/2MS,添加IAA、IBA、NAA 3種激素,觀察壯苗結果和生根情況。
根據表4可以看出,3種不同激素對植株影響有較大差異。完全不添加激素的情況下,僅1/2MS培養基使植株略有生長,但非常有限,植株整體基本沒有粗壯,沒有形成根。添加IBA后,苗上部分生長正常(圖3),但是無法形成或者僅少量形成根,IBA 0.5 mg·L-1時,根的長度為0.5~1.0 cm。添加 NAA后,植株下端形成愈傷,且無法形成根。添加IAA 0.5 mg·L-1的情況下,植株粗壯,形態正常,部分生長良好可以看到窗,且形成粗壯根,根平均數量6~10根,長度2~7 cm。

表4 不同激素含量對巴迪亞壽壯苗和生根的影響
注:起始材料為莖段。

圖2 壽增殖培養25 d的植株

圖3 生根培養1個月后形成根
2.5 馴化移植
組培苗形成完整植株后,可以轉至穴盤煉苗。穴盤中裝入的基質為草炭∶火山石∶鹿沼土∶赤玉為3∶1∶1∶2(V∶V)。種植組培苗于穴盤后,少量澆水,上方安置遮光網,放置于大棚內,溫度20 ℃,濕度85%左右(圖4)。生長2個月,壽成活率可達98%。從土中挖出根,可以看到根相比較前期伸長明顯,且部分形成新根。

圖4 馴化移植3個月后的巴迪亞壽
2.6 育苗技術培養
巴迪亞壽喜歡涼爽通風的半陰環境。在自然狀態下培養時,一般春、秋兩季養護較易,而高溫的夏季或者低于0 ℃的冬季,巴迪亞壽處于半休眠至休眠狀態,生長緩慢或停止。養護時,要注意通風、涼爽和干燥,可選擇適當遮陰,避免烈日暴曬和長期雨淋。巴迪亞壽喜歡空氣濕度略高的環境,但不可頻繁澆水或積水,防澇防浸泡。初期的小苗可以用帶蓋的育苗盤種植,用以保持空氣中的水分。但是夏季高溫時需要去除育苗盤的蓋子,防止植物因悶濕而死亡。
巴迪亞壽對光照較敏感。植株的生長于光照有直接關系。光照過強會導致葉片灼傷,而光照太弱會導致植株生長散漫不緊湊,并且“窗”透明度差。恰當的光照才能讓巴迪亞壽有完美的株型和明亮的“窗”。
3 小結與討論
植物組織培養是植物快速繁殖最有效的辦法,相比較葉插、播種等方法有很多優勢,例如繁殖速度快,繁殖系數大;繁殖后代整齊,遺傳性狀得以保持;可獲得脫毒苗等。植物組織培養需要選用適合的外植體,外植體可以從新生側芽、葉片、花序和種子等方面選擇。但因為新芽發生部位在根部接近土壤處,難滅菌,葉片分生能力較差,后期分化也比較弱;種子為雜交產物,母體的優良性狀難以保持,因此細胞分裂旺盛的花序是很好的起始材料[9]。花序經過滅菌后可以作為誘導材料。次氯酸鈉利用分解的氯氣殺菌,毒性較小。升汞是一種劇毒物質,利用其重金屬汞離子破壞微生物蛋白質的方法殺菌。在本實驗中,利用0.1%升汞振蕩滅菌8 min是比較適合的滅菌方法,污染率為7.5%,出芽率為75%。升汞滅菌后,需要用滅菌水多次振蕩沖洗,本實驗中沖洗6次,盡可能漂洗升汞殘留物,減少升汞對外植體的傷害。
將滅菌的壽接種至誘導培養基,誘導培養基添加了6-BA 1 mg·L-1和NAA 0.1 mg·L-1,此組合可以獲得較高的誘導率,同時誘導出的芽體發育正常,沒有出現膨大或者玻璃化,可以保證后續過程中芽的正常發育。
分離芽體轉至適宜的增殖培養基。增殖培養基添加6-BA 1 mg·L-1和NAA 0.02 mg·L-1,可以保證芽體正常發育,沒有出現膨大或者玻璃化,另外也保證了巴迪亞壽的增殖率和伸長率。在此培養條件下,伸長率為2.65倍,增殖率為4.62倍,植株正常發育。
實驗后期的生根過程中,分別添加3種激素對比后,發現1/2MS附加激素IAA 0.5 mg·L-1,組培苗生長健壯,發育正常,沒有畸形和愈傷發生,并且可以形成粗壯根,每株平均6~10根,長度2~7 cm。另外,每瓶種植少量苗可以促進植株發育。實驗中每瓶種植1~2棵明顯比種植4~6棵的粗壯。組培壯苗的過程可以促進巴迪亞壽快速生長,打破自然狀態下壽長勢緩慢的特點。
常規多肉繁殖方法有分株繁殖、葉插繁殖和播種繁殖。分株和葉插兩種繁殖方法有很多相似的地方,例如取得健康植株上部或者肉質葉后,放置在干燥的地方,涂抹多菌靈,防止傷口腐爛。在傷口晾干后,直接扦插入土,保持土壤濕潤可以促進基部生根、植株成活。本實驗中嘗試生根苗種植和未生根苗瓶外生根兩種方法。實驗過程中為防止植物長菌,可以用稀釋的多菌靈浸泡10 min再晾干。未生根苗的生根方法與葉插法一致。在隨后兩個月的觀察中發現,未生根苗的根可以在土中生長出,但是生長速度較慢,且根相比較已生根苗細軟。半年后觀察兩種苗,生根苗長勢旺盛,而未生根苗相比弱很多。因此,組培中生根的步驟值得保留。
馴化成功后,將生長健壯的苗從營養缽中轉至盆中生長,但是夏季高溫的時候不適合巴迪亞壽的轉移。轉苗時,盆底放置5~6粒奧綠緩釋肥(意大利撒得盼化學公司Sadepan Chimicas.r.l),再添加基質草炭∶火山石∶鹿沼土∶赤玉為3∶1∶1∶2(V∶V)。通透性較好的基質有助于根的健康生長。轉盆初期不加其他肥料,防止植物不耐受。轉盆兩個月后,每月噴施氮、磷、鉀有效養分各為20%的通用型花多多水溶速效肥,稀釋濃度為1%。生長期澆水掌握不干不澆,澆則澆透的原則,避免積水,更不能淋雨,尤其不能長期淋雨,以避免爛根,但也不宜長期干旱,否則葉片干癟,葉色黯淡[10]。
[1] 宋曉濤,沈萌,左志宇,等.十二卷屬植物西山壽的組織培養與快速繁殖[J].植物生理學通訊,2007,43(5):883-884.
[2] 王燕,牟豪杰,呂永平,等.壽錦的離體植株再生及組培產業化增殖[J].植物學報,2017,52(3):331-336.
[3] 高越, 王婭欣, 孫濤, 等. 毛玉露的組織培養與快速繁殖[J].生物學通報,2010,45(6):54-55.
[4] 陸文佳.淺談多肉軟葉十二的雜交繁殖[J].花卉,2016(11):34-35.
[5] 孫濤,金蕊,李德森. 康平壽的組織培養與快速繁殖[J].植物生理學報,2003,39(3):232.
[6] 孫濤,李德森. 截型十二卷的組織培養與快速繁殖[J].植物生理學報,2002,38(6):586.
[7] 左志宇,李建希,安曉云,等.克里克特壽的組織培養與快速繁殖[J].植物生理學報,2007,43(2)311-312.
[8] 牟豪杰,王燕,呂永平,等.冰沙糖壽組培快繁研究[J].安徽農業科學,2016,44(32):140-141,157.
[9] 郭生虎, 朱永興,關雅靜.百合科十二卷屬玉露的組培快繁關鍵技術研究[J].中國農學通報,2016,32(34):85-89.
[10] 兌寶峰.玉露的栽培繁殖[J].中國花卉園藝,2009, 3(6): 34-35.

