丹參酮生物合成分子調控機制的研究進展
李 珅,林愛真,楊 媛,沈亞芳,饒 盈,羊 健,劉云輝,王 洋,周 偉
(1.浙江農林大學 農業與食品科學學院 浙江省農產品品質改良技術研究重點實驗室,浙江 杭州311300; 2.浙江省泰順縣西旸鎮農業公共服務中心,浙江 泰順 325509;3.臨安天目山林場,浙江 杭州311311;4.浙江省農業科學院 農業部/浙江省植保生物技術重點實驗室,浙江 杭州 310021)
丹參Salvia miltiorrhiza是傳統的中藥材,其主要藥用成分包括脂溶性的丹參酮類化合物和水溶性的酚酸類化合物。其中丹參酮是一類松香烷二萜化合物。20世紀30年代末,有學者首次發現丹參酮ⅡA和丹參酮ⅡB是天然的抗氧化劑。隨后幾十年,又連續發現了丹參酮Ⅰ、隱丹參酮、二氫丹參酮Ⅰ、異丹參酮、去甲基丹參酮等脂溶性有效成分。其藥理作用主要表現在抗菌消炎、抗氧化、抗腫瘤、抗心肌缺氧、激素樣活性等方面,并能夠改善學習記憶能力,在臨床上主要用于心腦血管疾病的治療[1-2]。丹參有效成分產量較低,可利用資源有限,使其應用推廣受到很大的限制。因此,篩選獲得高丹參酮產量的優良品種或是通過其他方法解決藥源問題是很有必要的。筆者從丹參酮生物合成途徑及其分子調控機制等方面展開綜述,同時總結了以往研究中存在的問題,并結合自身對研究前景進行了分析,為后續深入研究提供參考。
1 丹參酮的生物合成途徑
丹參酮是一類二萜類化合物,其代謝合成方式有2條途徑(圖1),分別為位于細胞質中的甲羥戊酸途徑 (mevalonate,MVA)[3]和位于質體中的非甲羥戊酸途徑(2-C-methyl-d-erythritol-4-phosphate,MEP)[4]。MVA合成途徑的上游基因包括AACT,HMGS,HMGR,MK,PMK和MDC;MEP合成途徑上游基因包括DXS,DXR,CMS,CMK,MCS,HDS和 IDS;中游合成酶基因包括IPPI,GPPS,FPPS和GGPPS;下游合成酶基因包括CPS,KSL,CYP76AH1,CYP76AH3,CYP76AK1以及未知的P450s基因;在下游合成途徑中柯巴基焦磷酸(copalyl diphosphate,CPP)經類貝殼杉烯合酶(KSL)催化形成丹參酮二烯(miltiradiene),丹參酮二烯經細胞色素 P450家族蛋白CYP76AH1催化合成鐵銹醇(ferruginol),鐵銹醇經過CYP76AH3和CYP76AK1的多步催化生成11,20-二羥基鐵杉醇和11,20-二羥基柳杉酚,最后在其他CYP家族或其他酶作用下產生次丹參酮(miltirone),進而合成丹參酮類成分[5]。目前,從鐵杉醇合成丹參酮之間的多步催化反應步驟仍不清楚,需要進一步的研究。
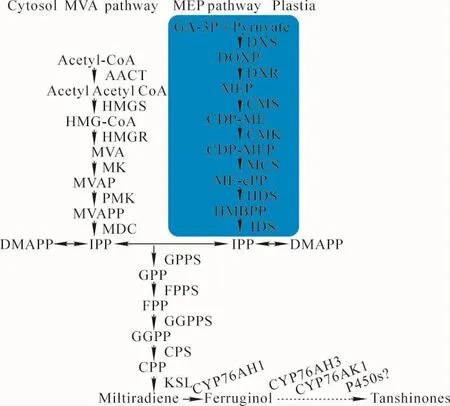
圖1 丹參酮代謝合成路徑Figure 1 Biosynthetic pathway involved in the biosynthesis of tanshinone in Salvia miltiorrhiza
2 誘導子對丹參酮生物合成的調控作用
誘導子能誘發植物次生代謝過程中酶的活性,從而增加次生代謝物的產量,有時可以誘導出新的代謝化合物。依據來源可劃分為生物誘導子和非生物誘導子兩大類。生物誘導子是指植物體在防御過程中為對抗微生物入侵而產生的防御性物質,如分生孢子、分解細胞壁的酶、細胞壁的碎片。非生物誘導子是指所有非植物細胞的固有成分,但能觸發植物細胞形成抗毒素信號的物質[6]。
2.1 生物誘導子對丹參酮合成的影響
研究人員圍繞生物誘導子對丹參酮合成的影響做了許多研究。晏瓊等[6-7]利用酵母提取物(YE)、寡聚半乳糖醛酸和真菌誘導子等3種生物誘導子分別處理丹參毛狀根,發現都能顯著提高丹參酮的產量。施加100 g·L-1的真菌誘導子,總丹參酮的產量提升4.70倍;施加100 g·L-1的YE,總丹參酮的產量提升3.20倍;施加100 g·L-1的寡半乳糖醛酸,總丹參酮的產量提升4.20倍。GE等[8]考察了不同濃度的β-氨基丁酸(BABA)和YE單獨或是協同對丹參酮代謝合成的影響,與對照相比最多可提高4.50倍。BABA+YE協同作用,在BABA處理3 d后再加入YE,對丹參酮的積累更加有效。YAN等[9]發現密旋鏈霉菌Streptomyces pactum處理丹參毛狀根后,GGPPS,HMGR,DXS,DXR等4個關鍵酶基因的表達量顯著提升,總丹參酮產量提高12.61倍[9]。研究發現,丹參毛狀根中丹參酮ⅡA和隱丹參酮的積累和產量受YE誘導。丹參酮的產量經誘導處理6 d后測得的最大值為0.64 mg·g-1,其中HMGS,DXR,DXS2,CMK,IPPI,CPS等6個關鍵酶基因的表達量顯著上調。YE和銀離子(Ag+)共同誘導處理表明,丹參酮ⅡA和隱丹參酮的產量顯著增加。丹參酮誘導處理9 d后測得的丹參酮的最大值為2.08 mg·g-1,其中AACT,HMGS,DXR,IPPI,CMK,FPPS,GGPPS,CPS等8個關鍵酶基因表達顯著上調[10]。 上述研究表明,生物誘導子對于丹參酮的合成具有促進作用。因此,新型高效生物誘導子的挖掘和開發利用將是后續重要研究方向之一。
2.2 非生物誘導子對丹參酮合成的影響
非生物誘導子能引起或者促進植物細胞與防御機制有關的次生代謝產物的生物合成。目前,已證實的非生物誘導子約有100多種,主要包括茉莉酸甲酯(methyljasmonate,MeJA),茉莉酸(jasmonate,JA),水楊酸(alicylic acid,SA),重金屬鹽類和稀土元素。郭肖紅等[11]研究發現,低濃度的銅離子(Cu2+), 鎂離子(Mg2+), 鋅離子(Zn2+), 亞鐵離子(Fe2+), 錳離子(Mn2+)以及稀土元素均能促進丹參酮ⅡA的合成。KAI等[10]研究了0.10 mmol·L-1MeJA誘導處理丹參毛狀根后丹參酮ⅡA和隱丹參酮的積累變化。處理9 d后,HMGR,DXR,DXS2,GGPPS,CPS和KSL等基因的表達顯著上調,丹參酮的產量達到最大值 0.93 mg·g-1干質量(DW), 相比于對照組 0.16 mg·g-1(DW)增加了約 5.78 倍。 HAO 等[12]發現SA處理丹參毛狀根36 h后,丹參酮產量上升1.63倍。銀離子處理毛狀根后,HMGR,DXS2,IPPI,GGPPS等基因的表達顯著上調;丹參酮ⅡA和隱丹參酮的積累逐漸增加,處理9 d后測得的丹參酮的最大產量為 0.35 mg·g-1, 相比于對照組的 0.16 mg·g-1(DW)增加約 2.20 倍。 晏瓊等[6-7]利用銀離子(Ag+),鈷離子(Co2+)和α-氨基異丁酸(AIB)等3種非生物誘導子分別處理丹參毛狀根,通過檢測丹參酮的產量發現,此3種非生物誘導子都能提高丹參酮的積累,但誘導能力比生物誘導子弱;其中50.00 mmol·L-1鈷離子獲得了最高的丹參酮產量(1.75 mg·g-1),是對照組產量的4.10倍;30.00 mmol·L-1銀離子處理后總丹參酮的產量提高了2.10倍;50.00 mmol·L-1AIB處理后總丹參酮產量提高了2.30倍。ZHOU等[13]利用金屬元素0.01 mmol·L-1鑭(La)對丹參毛狀根進行誘導處理,結果表明丹參酮代謝途徑上關鍵酶基因包括HMGR,HMGS,KSL,DXR,CMK的表達量均上調,丹參酮Ⅰ,丹參酮Ⅱ和隱丹參酮的產量均升高。由此可推測鑭可能通過促進丹參酮代謝途徑上游關鍵酶基因的表達而增加丹參酮的積累。房翠萍[14]研究了外源激素對丹參毛狀根生長和丹參酮ⅡA生物合成的影響,結果顯示在1/2MS培養基中單獨施加2.00 mg·L-16-芐氨基腺嘌呤(6-BA)能使丹參酮ⅡA產量增加3.01倍;同時添加3.00 mg·L-16-BA與0.20 mg·L-1NAA能使丹參酮ⅡA產量增加0.93倍;同時添加1.00 mg·L-16-BA與2 mg·L-1赤霉素(GA)能使丹參酮ⅡA濃度增加1.69倍;同時添加1.00 mg·L-1激動素(KT)與1.00 mg·L-1吲哚丁酸(IBA)能使丹參酮ⅡA產量增加0.21倍;此外還研究了pH值對丹參毛狀根生長和丹參酮ⅡA生物合成的影響,結果發現培養基pH值為pH 9時,丹參酮產量最高。YANG等[15]利用聚乙二醇(PEG)和脫落酸(ABA)對丹參毛狀根進行誘導處理,發現PEG和ABA通過增加毛狀根中活性氧含量促進丹參酮的代謝合成,推測PEG和ABA可能通過ABA途徑誘導丹參毛狀根中內源茉莉酸(JA)的活性,從而刺激丹參酮的代謝積累[15-16](表1)。
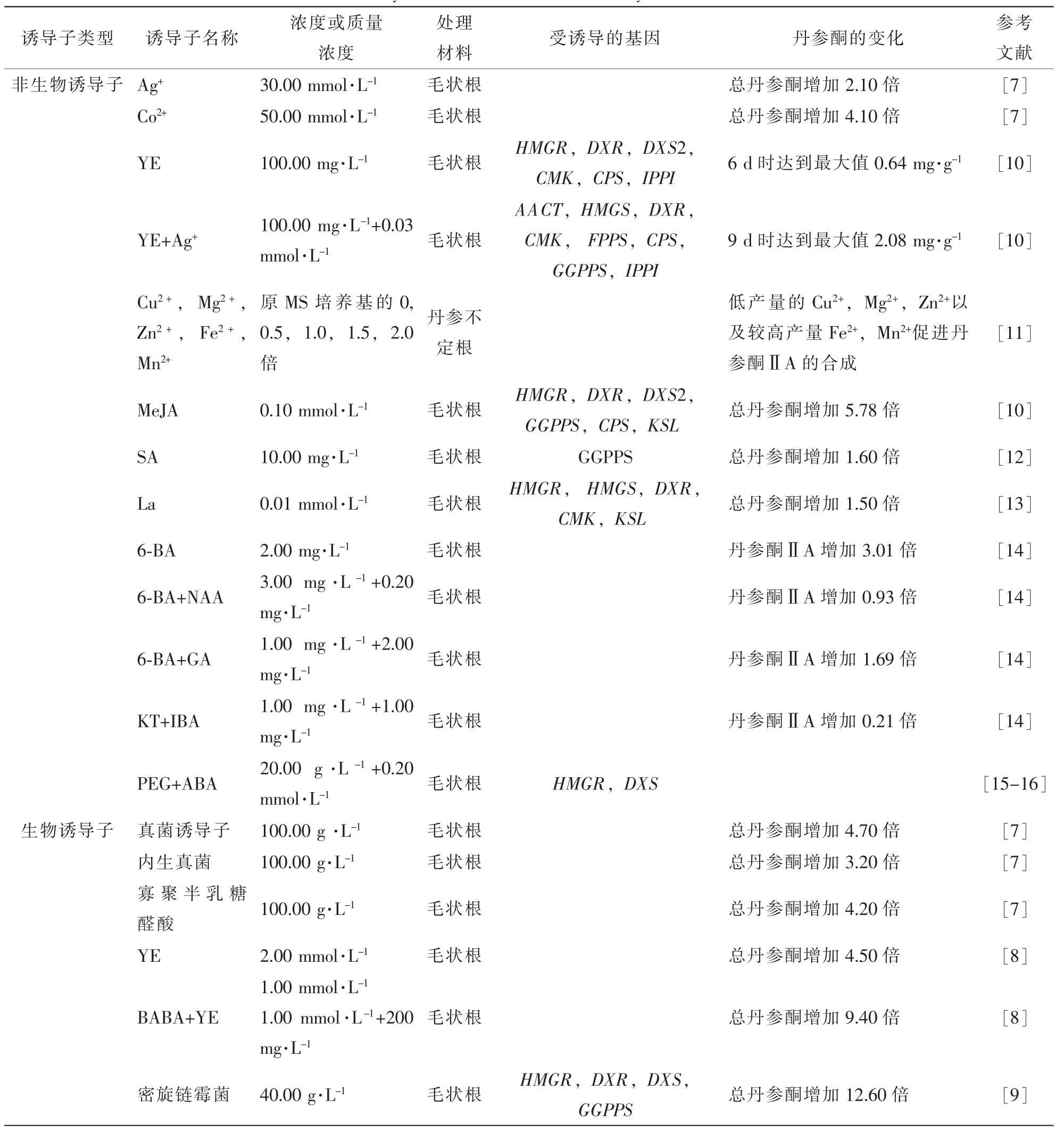
表1 誘導子對丹參酮代謝合成的影響Table 1 Effect on the biosynthesis of tanshinone induced by elicitors in Salvia miltiorrhiza
3 轉錄因子對丹參酮代謝合成的調控作用
轉錄因子又稱為反式作用元件,是能夠特異結合真核基因啟動子區域順式作用元件的脫氧核糖核酸(DNA)結合蛋白,通過蛋白與基因之間、蛋白與蛋白之間的相互作用激活或抑制轉錄[17]。近年來,隨著對植物轉錄因子研究和認識的不斷深入,轉錄調控被認為是一種能有效調控植物次生代謝途徑的新手段。超表達轉錄因子能夠有效地克服多基因共轉化存在的弊端,全面調節相關基因的表達,對整個代謝途徑的調控效果要優于單純提高單個或多個結構基因的表達。目前,研究人員對轉錄因子在丹參次生代謝調控方面進行了深入研究,研究較多的轉錄因子有基本螺旋-環-螺旋(basic helix-loop-helix,bHLH)、植物中髓細胞組織增生蛋白(myelocytomatosis,MYCs),WRKY和JAZ等幾個類型(表2)。
3.1 bHLH類轉錄因子
植物bHLH轉錄因子家族因其成員含有高度保守的bHLH區域而被命名為bHLH轉錄因子。bHLH結構域由50~60個左右氨基酸組成,包含10~15個氨基酸組成的堿性氨基酸區和40個左右氨基酸構成的HLH區[18]。50%以上的植物堿性氨基酸區含有高度保守的His5-Glu9-Arg13序列,這使得堿性氨基酸區能夠識別 DNA 上 E-box(5′-CANNTG-3′)和 G-box(5′-CACGTG-3′)位點, 并與之結合[19-20]。 由于 HLH結構域中疏水氨基酸之間常常互作從而促進蛋白二聚體的形成,因此bHLH蛋白常以二聚體的形式發揮作用[21]。目前已報道的植物bHLH家族轉錄因子已有很多,其中擬南芥Arabidopsis thaliana中報道的bHLH家族成員有164個,水稻Oryza sativa中bHLH家族成員有180個[22],而煙草Nicotiana tabacum和葡萄Vitis vinifera中bHLH轉錄因子分別有190個和191個以上[23-24]。通過轉錄組測序,127個丹參bHLH類轉錄因子已被分離,其中7個成員被發現能響應甲基茉莉酸 (MeJA)信號誘導。SmbHLH37,SmbHLH74和SmbHLH92被證實與丹參萜類物質的代謝合成密切相關[25]。由此推測,bHLH類轉錄調控因子在JA信號途徑中調控丹參酮和丹酚酸的生物合成具有重要的作用。此外,丹參轉錄因子SmbHLH1和SmbHLH93的全長基因被相繼克隆,分析表明此2個基因的表達與丹參酮的代謝合成密切相關[26-27],這些研究為從分子水平全面解析bHLH類轉錄因子調控丹參酮的代謝合成機制奠定了扎實的工作基礎。
3.2 MYC類轉錄因子
MYC類轉錄因子是植物茉莉酸類激素響應途徑中的核心轉錄因子。MYC具有多種調節功能,廣泛存在于動植物中。MYC類轉錄因子中MYC2研究最為深入。MYC2轉錄因子含有bHLH保守結構域,屬于bHLH類轉錄因子家族成員。MYC2在N端含有1個JID結構域,與JAZ結合相關[28]。ZHOU等[29]研究發現,丹參SmMYC2a能和丹酚酸代謝途徑的結構基因SmHCT6,SmCYP98A14的E-BOX互作;而SmMYC2b能和SmCYP98A14的E-BOX互作,直接調控丹酚酸而間接調控丹參酮的代謝合成。王曉榮[30]研究發現,SmMYC2-like能和SmJAZ3互作,在丹參毛狀根中過表達AtMYC2后,丹參酮代謝合成關鍵酶基因SmGGPPS的表達上調,總丹參酮產量達16.00 mg·g-1(DW),高出對照5.40倍。而過表達SmMYC2-like后,總丹參酮產量增加3.50倍。
3.3 WRKY類轉錄因子
WRKY轉錄因子家族是高等植物十大轉錄因子家族成員之一。WRKY轉錄因子的保守結構域約由60個氨基酸殘基組成,其中靠近氨基酸N端的7個保守氨基酸殘基WRKYGQK為WRKY結構域的核心序列,它們的變異會導致DNA結合活性減弱或者喪失;羧基C末端的鋅指類似結構在植物的進化中可能起到重要的作用[31-32]。
在植物進化過程中,WRKY轉錄因子家族成員不斷擴大。 LI等[33]克隆了61個WRKYs基因,發現其中42個WRKYs成員能夠響應MeJA和銀離子(Ag+)脅迫,與丹參酮的代謝合成密切相關。郝小龍[34]研究發現,在丹參毛狀根中過表達SmWRKY3后,丹參酮合成關鍵酶基因SmCPS表達上調,總丹參酮產量達3.98 mg·g-1(DW),相比于對照提高了1.83倍;而抑制表達SmWRKY3后,SmCPS的表達下調,總丹參酮產量僅為1.98 mg·g-1(DW)。因此,WRKY轉錄因子能夠促進丹參酮的合成,是丹參酮合成的正向調控因子。
3.4 JAZ類轉錄因子
含有ZIM結構域的基因稱為JASMONATE ZIM-DOMAIN(JAZ)基因。ZIM結構域一般位于JAZ蛋白的中間,主要由28個氨基酸組成;在N端含有(TIF[F/Y]XG)結構域,在C末端有2個不變的丙氨酸。Jas結構域(SLX2FX2KRX2RX5PY)位于JAZ蛋白的C端,在JAZ蛋白中極其保守。研究發現,擬南芥的SCFCOI1復合體依賴JA-Ile,并通過Jas結構域與JAZ1,JAZ3,JAZ9,JAZ10蛋白結合;Jas結構域是JAZ蛋白核定位信號的關鍵結構。JAZ參與JA信號介導的次生代謝物的合成在擬南芥中研究得比較透徹。JAZ在擬南芥中有12個成員,其中至少8個JAZ蛋白成員都與MYC2相互作用。擬南芥MYC2的同源基因MYC2-LIKE成員JAM1,JAM2和 JAM3也參與JA信號途徑的次生代謝合成(表2);其中JAM1和JAM2分別與6個不同的JAZ成員相互作用,而JAM3卻不能與任何JAZ蛋白成員互作。近期丹參JAZ蛋白參與JA信號介導的次生代謝物的合成機制研究也取得一些進展。在丹參中超表達JAZ3和JAZ9基因能使毛狀根中丹參酮的產量急劇降低;酵母雙雜試驗證實SmJAZ9蛋白能與bHLH類轉錄因子擬南芥的AtMYC2互作,而SmJAZ3不能與AtMYC2互作,推測SmJAZ9通過與bHLH類轉錄因子互作,SmJAZ3通過與其他bHLH類轉錄因子互作而調控丹參酮的生物合成[5]。研究證實將SmJAZ8遺傳轉化丹參,超表達SmJAZ8的轉基因毛狀根系表現出對JA信號不敏感的表型;SmJAZ8的超表達導致SmJAZ1,SmJAZ2和SmJAZ3的表達量急劇下調,從而提高丹參酮和花青素的代謝合成;究其原因發現,SmJAZ8蛋白跟擬南芥的AtJAZ8類似,缺少LPIARR的結構域,而此結構域是JA信號誘導JAZ蛋白降解釋放正向調節因子的關鍵區域。可見擬南芥JAZ蛋白在JA信號介導的次生代謝合成作用機制的解析為在丹參中研究JAZ調控丹參酮和丹酚酸的合成提供了很好的參考。丹參JAZ家族其他成員的功能有待于進一步地解析。

表2 轉錄因子對丹參酮代謝合成的影響Table 2 Effect on the biosynthesis of tanshinone regulated by transcription factors in Salvia miltiorrhiza
4 可變剪接的分子調控作用
真核生物基因轉錄產生的mRNA前體大多數只按一種方式進行剪接,產生一種成熟的mRNA分子,只翻譯成一種蛋白質。但有的基因mRNA前體通過不同的剪接方式(按不同的剪接位點)產生不同的mRNA剪接異構體,此過程稱為可變剪接。RNA可變剪接不涉及遺傳信息的永久性改變,是真核基因表達調控的重要手段,是調節基因表達和產生蛋白質多樣性的重要機制,是導致人類基因和蛋白質數量變異的重要原因。
現如今可變剪接作為代謝和發育另一個重要的調節機制已在許多植物中被鑒定,如擬南芥[36-37],大豆 Glycine max[38], 蔓越橘 Brachypodium distachyon[39]和水稻[40]。 而在丹參中, 利用短讀高通量測序技術(NGS)和單分子實時(SMRT)長讀測序技術,結合對根部各組織進行測序發現,KSL1,HDR,HMGR,AACT3,MK和 PMK基因存在著選擇性剪接調控的現象[41]。由此可見,丹參酮代謝合成途徑中關鍵合成酶基因的可變剪接對丹參酮的代謝合成起到了重要的調節作用。某些轉錄調控因子是否也存在可變剪接的調控方式有待進一步研究。
5 總結與展望
丹參這種傳統的中草藥具有重要的藥用價值。近年來野生丹參品質嚴重退化,瀕臨滅絕,導致丹參原藥的供應極不穩定,解決藥源問題已成為研究的熱點。目前,對丹參酮次生代謝合成的研究重點主要包括以下幾個方面:①丹參酮代謝合成途徑的解析。分離丹參酮代謝合成酶或是修飾酶,通過底物與產物的鑒定,解析丹參酮次生代謝化合物的合成途徑。②轉錄因子及其調控機制和調控網絡的解析。轉錄因子可同時調控代謝途徑上的1個或是多個基因的表達,在丹參酮次生代謝合成中起重要的調控作用。為闡明丹參酮代謝合成的調控機制,利用誘導子處理丹參,結合轉錄組學、蛋白質組學和代謝組學揭示候選轉錄因子的表達與產物代謝流的分配規律,以揭示轉錄因子間的表達與互作機制對丹參酮合成代謝的調控規律。③丹參酮基因工程的研究。在代謝途徑和調控網絡充分解析的基礎上,實現代謝調控的可預測性。如采用時空特異性表達的啟動子、多基因共轉化技術,實現丹參有效成分在特異部位或是全株系大量積累和特定性狀改良的目標。
隨著研究的深入,進一步從轉錄調控水平全面解析丹參酮的代謝分子調控機制對于利用現代基因工程手段培育高品質丹參新品種/系具有重要的指導意義,也具有廣闊的應用前景。因此,應從以下幾個方面開展研究工作:①丹參酮代謝合成關鍵調控因子可變剪接的挖掘與分子機制解析。②非編碼RNA在丹參酮代謝合成過程中的調控作用。③丹參酮合成生物學的研究。通過工程酵母生產丹參酮前體物,并利用有機半合成技術體外合成丹參酮,這將改變丹參藥源生產方式,為丹參系列藥物走向國際市場奠定工作基礎,無疑將具有重要的應用前景。
[1] CHEN Xiuping,GUO Jiajie,BAO Jiaolin,et al.The anticancer properties of Salvia miltiorrhiza Bunge (Danshen):a systematic review [J].Med Res Rev,2014,34(4):768-794.doi:10.1002/med.21304.
[2] WANG Xin,LEE W,ZHOU Xuelin,et al.A pharmacodynamic-pharmacokinetic (PD-PK) study on the effects of danshen (Salvia miltiorrhiza) on midazolam,a model CYP3A probe substrate,in the rat [J].Phytomedicine,2010,17(11):876-883.doi:10.1016/j.phymed.2010.05.007.
[3] LANGE B,RUJAN T,MARTIN W,et al.Isoprenoid biosynthesis:the evolution of two ancient and distinct pathways across genomes [J].Proc Natl Acad Sci USA,2000,97(24):13172-13177.doi:10.1073/pnas.240454797.
[4] ROHMER M,KNANI M,SIMONIN P,et al.Isoprenoid biosynthesis in bacteria:a novel pathway for the early steps leading toisopentenyldiphosphate [J].Biochem J,1993,295(2):517-524.doi:10.1042/bj2950517.
[5] SHI Min,ZHOU Wei,ZHANG Jianlin,et al.Methyl jasmonate induction of tanshinone biosynthesis in Salvia miltiorrhiza hairy roots is mediated by JASMONATE ZIM-DOMAIN repressor proteinsb [J].Sci Rep,2016,6(1):20919.doi:10.1038/srep20919.
[6] 晏瓊,胡宗定,吳建勇.生物與非生物誘導子協同作用對丹參毛狀根培養生產丹參酮的影響[J].中國中藥雜志, 2006, 31(3): 188-191.YAN Qiong,HU Zongding,WU Jianyong.Synergistic effects of biotic and abiotic elicitors on the production of tanshinones in Salvia miltiorrhiza hairy root culture [J].China J Chin Mater Med,2006,31(3):188-191.
[7] 晏瓊,胡宗定,吳建勇.生物和非生物誘導子對丹參毛狀根培養生產丹參酮的影響[J].中草藥,2006,37(2): 262-265.YAN Qiong,HU Zongding,WU Jianyong.Influence of biotic and abiotic elicitors on production of tanshinones in Salvia miltiorrhiza hairy root culture [J].China Tradit Herb Drug,2006,37(2):262-265.
[8] GE Xiuchun,WU Jianyong.Induction and potentiation of diterpenoid tanshinone accumulation in Salvia miltiorrhiza hairy roots by β-aminobutyric acid [J].Appl Microbiol Biot,2005,68(2):183-188.doi:10.1007/s00253-004-1873-2.
[9] YAN Yan,ZHANG Shuncang,YANG Dongfeng,et al.Effects of Streptomyces pactum Act12 on Salvia miltiorrhizahairy root growth and tanshinone synthesis and its mechanisms [J].Appl Biochem Biotechnol,2014,173(4):883-893.doi:10.1007/s12010-014-0876-4.
[10] KAI Guoyin,LIAO Pan,XU Hui,et al.Molecular mechanism of elicitor-induced tanshinone accumulation in Salvia miltiorrhiza hairy rootcultures [J].Acta Physiol Plant,2012,34(4):1421-1433.doi:10.1007/s11738-012-0940-z.
[11] 郭肖紅,高文遠,陳海霞,等.金屬離子對丹參酮ⅡA和原兒茶醛生物合成的影響[J].中國中藥雜志,2005, 30(12): 885-888.GUO Xiaohong,GAO Wenyuan,CHEN Haixia,et al.Effects of mineral cations on the accumulation of tanshinoneⅡA and protocatechuic aldehyde in the adventitious root culture of Salvia miltiorrhiza [J].China J Chin Mater Med,2005,30(12):885-888.
[12] HAO Xiaolong,SHI Min,CUI Lijie,et al.Effects of methyl jasmonate and salicylic acid on tanshinone production and biosynthetic gene expression in transgenic Salvia miltiorrhiza hairy roots [J].Biotechnol Appl Biochem,2015,62(1):24-31.doi:10.1002/bab.1236.
[13] ZHOU Jie,FANG Lei,WANG Xiao,et al.La dramaticaly enhances the accumulation of tanshinones in Salvia miltiorrhiza hairy root cultures [J].Earth Sci Res,2012,2(1):187-192.doi:http://dx.doi.org/10.5539/esr.v2n1p187.
[14] 房翠萍.丹參多倍體誘導、毛狀根培養及其丹參酮產量提高的研究[D].合肥:安徽農業大學,2011.FANG Cuiping.Polyploidy Induction,Hairy Root Culture and Improve the Yield of Tanshinone in Salvia miltiorrhiza[D].Hefei:Anhui Agriculture University,2011.
[15] YANG Dongfeng,SHENG Dongfeng,DUAN Qimei,et al.PEG and ABA trigger the burst of reactive oxygen species to increase tanshinone production in Salvia miltiorrhiza hairy roots [J].J Plant Growth Regul,2012,31(4):579-587.doi:10.1007/s00344-012-9268-6.
[16] YANG Dongfeng,MA Pengda,LIANG Xiao,et al.PEG and ABA trigger methyl jasmonate accumulation to induce the MEP pathway and increase tanshinone production in Salvia miltiorrhiza hairy roots [J].Physiol Plantarum,2012,146(2):173-183.doi:10.1111/j.1399-3054.2012.01603.x.
[17] 李潔.植物轉錄因子與基因調控[J].生物學通報,2004, 39(3): 9-11.LI Jie.Plant transcription factors and gene regulation [J].Bull Biol,2004,39(3):9-11.
[18] 張鑫,宋經元,胡鳶雷,等.bHLH轉錄因子調控植物活性成分生物合成的研究進展[J].藥學學報,2014, 49(4): 435-442.ZHANG Xin,SONG Jingyuan,HU Yuanlei,et al.Research progress of the regulation on active compound biosynthesis by the bHLH transcription factors in plants [J].Acta Pharm Sin,2014,49(4):435-442.
[19] WANG Jinyan,HU Zhongze,ZHAO Tongmin,et al.Genome-wide analysis of bHLH transcription factor and involvement in the infection by yellow leaf curl virus in tomato (Solanum lycopersicum)[J].BMC Genom,2015,16(1):1-14.doi:10.1186/s12864-015-1249-2.
[20] PIRES N,DOLAN L.Origin and diversification of basic-helix-loop-helix proteins in plants [J].Mol Biol Evol,2010,27(4):862-874.doi:10.1093/molbev/msp288.
[21] FERRé-D’AMARé A R,PRENDERGAST G C,ZIFF E B,et al.Recognition by max of its cognate DNA through a dimeric b/HLH/Z domain [J].Nature,1993,363(6424):38-45.doi:10.1038/363038a0.
[22] XIONG Yuqing,LIU Tieyan,TIAN Chaoguang,et al.Transcription factors in rice:a genome-wide comparative analysis between monocots and eudicots [J].Plant Mol Biol,2005,59(1):191-203.doi:10.1007/s11103-005-6503-6.
[23] RUSHTON P J,BOKOWIEC M T,HAN Shengcheng,et al.Tobacco transcription factors:novel insights into transcriptional regulation in the Solanaceae [J].Plant Physiol,2008,147(1):280-295.doi:https://doi.org/10.1104/pp.107.114041.
[24] JAILLON O,AURY J M,NOEL B,et al.The grapevine genome sequence suggests ancestral hexaploidization inmajor angiosperm phyla [J].Nature,2007,449(7161):463-467.doi:10.1038/nature06148.
[25] ZHANG Xin,LUO Hongmei,XU Zhichao,et al.Genome-wide characterisation and analysis of bHLH transcription factors related to tanshinone biosynthesis in Salvia miltiorrhiza [J].Sci Rep,2015,5:11244.doi:10.1038/srep11244.
[26] 汪琬宜,蔣喜紅,張利華,等.丹參轉錄因子 SmbHLH1基因的克隆和表達分析[J].中國中藥雜志,2011, 36(24): 3416-3420.WANG Wanyi,JIANG Xihong,ZHANG Lihua,et al.Isolation and characteristics of SmbHLH1 gene in Salvia miltiorrhiza [J].China J Chin Mater Med,2011,36(24):3416-3420.
[27] 周宏駿,武玉翠,晉鑫鑫,等.丹參轉錄因子SmbHLH93的克隆及表達模式分析[J].中草藥,2014,45(23): 3449-3455.ZHOU Hongjun,WU Yucui,JIN Xinxin,et al.Cloning and expression pattern analysis of transcription factor SmbHLH93 from Salvia miltiorrhiza [J].Chin Tradit Herb Drug,2014,45(23):3449-3455.
[28] HONG Gaojie,XUE Xueyi,MAO Yingbo,et al.Arabidopsis MYC2 interacts with DELLA proteins in regulating sesquiterpene synthase gene expression [J].Plant Cell,2012,24(6):2635-2648.doi:10.1105/tpc.112.098749.
[29] ZHOU Yangyun,SUN Wei,CHEN Junfeng,et al.SmMYC2a and SmMYC2b played similar but irreplaceable roles in regulating the biosynthesis of tanshinones and phenolic acids in Salvia miltiorrhiza [J].Sci Rep,2016,6:22852.doi:10.1038/srep22852.
[30] 王曉榮.丹參bHLH類轉錄因子MYCs的基因克隆及功能初步研究[D].上海:上海師范大學,2015.WANG Xiaorong.Isolation and Function Analysis of bHLH Translation Factor in Salvia miltiorrhiza [D].Shanghai:Shanghai Normal University,2015.
[31] RUSHTON P J,TORRES J T,PARNISKE M,et al.Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes [J].Embo J,1996,15(20):5690-5700.
[32] XIE Zhen,ZHANG Zhonglin,ZOU Xiaolu,et al.Annotations and functional analyses of the rice WRKY gene superfamily reveal positive and negative regulators of abscisic acid signaling in aleurone cells [J].Plant Physiol,2005,137(1):176.doi:https://doi.org/10.1104/pp.104.054312.
[33] LI Caili,LI Dongqiao,SHAO Fenjuan,et al.Molecular cloning and expression analysis of WRKY transcription factor genes in Salvia miltiorrhiza [J].BMC Genom,2015,16(1):200.doi:10.1186/s12864-015-1411-x.
[34] 郝小龍.丹參SmWRKY3和SmWRKY70轉錄因子的功能研究[D].上海:上海師范大學,2014.HAO Xiaolong.The Functional Study of SmWRKY3 and SmWRKY70 Transcription Factor in Salvia miltiorrhiza [D].Shanghai:Shanghai Normal University,2014.
[35] 李磊磊.丹參WRKY轉錄因子SmWRKY54的功能初步研究[D].上海:上海師范大學,2016.LI Leilei.The Functional Study of SmWRKY54 Transcription Factor in Salvia miltiorrhiza [D].Shanghai:Shanghai Normal University,2016.
[36] FILICHKIN S A,PRIEST H D,GIVAN S A,et al.Genome-wide mapping of alternative splicing in Arabidopsis thaliana [J].Genome Res,2010,20(1):45-58.doi:10.1101/gr.093302.109.
[37] MARQUEZ Y,BROWN J W,SIMPSON C,et al.Transcriptome survey reveals increased complexity of the alternative splicing landscape in Arabidopsis [J].Genome Res,2012,22(6):1184-1195.doi:10.1101/gr.134106.111.
[38] SHEN Yangting,ZHOU Zhengkui,WANG Zheng,et al.Global dissection of alternative splicing in paleopolyploid soybean [J].Plant Cell,2014,26(3):996-1008.doi:https://doi.org/10.1105/tpc.114.122739.
[39] BRADEN W,GENGKON L,GAURAV S,et al.Genome-wide landscape of alternative splicing events in brachypodium distachyon [J].DNA Res,2013,20(2):163-171.doi:10.1093/dnares/dss041.
[40] ZHANG Guojie,GUO Guangwu,HU Xueda,et al.Deep RNA sequencing at single base-pair resolution reveals high complexity of the rice transcriptome [J].Genome Res,2010,20(5):646-654.doi:10.1101/gr.100677.109.
[41] XU Zhicao,PETERS R J,WEIRATHER J,et al.Full-length transcriptome sequences and splice variants obtained by a combination of sequencing platforms applied to different root tissues of Salvia miltiorrhiza and tanshinone biosynthesis [J].Plant J,2015,82(6):951-961.doi:10.1111/tpj.12865.

