薄荷組織培養及抗除草劑基因的遺傳轉化
梁文潔, 張 麗, 郭新勇, 王愛英, 向本春, 祝建波
(石河子大學生命科學學院農業生物技術重點實驗室,新疆石河子 832003)
全世界薄荷屬植物(MenthaL.)約有30種,140多個變種,其中有20多個變種在世界各地栽培[1-2]。我國約有12種,其中6種為野生品種,其余為引進栽培品種[3]。薄荷屬植物常見的栽培種有薄荷(M.haplocalyxBriq.)、留蘭香(M.spicataL.)、椒樣薄荷(M.piperitaL.)、唇萼薄荷(M.pulegiumL.)、水薄荷(M.aquaticaL.)及檸檬留蘭香(M.citrataL.)等。結合本種形態特征和地理分化趨勢,可將薄荷劃分為兩大種群且作為2個種處理,即歐洲、西亞及北美地區的薄荷種群,用學名M.arvensisL.,東亞及熱帶亞洲的薄荷種群,用學名M.haplocalyxBriq.。
薄荷屬植物是一種用途廣泛的中藥材,也是世界上主要的香料植物之一[4-6]。薄荷屬植物種間雜交十分普遍,有性繁殖極易造成品種混雜,難以區分。一般都采用無性繁殖,但長期采用無性繁殖,導致病毒病十分普遍,引起品種的退化和產量、質量的下降。通過組織培養可以對植株進行脫毒復壯,并且可以保持植物優良性狀遺傳的穩定性,防止品種過快退化[7]。組織培養技術還可以用來進行薄荷的誘變育種和種質保存,如方曉志等在組織培養條件下進行了薄荷化學試劑和射線輻射誘變育種技術的研究,獲得了多個薄荷株系[8];Hirai等利用留蘭香組培苗的腋芽低溫貯藏,尋找到一種新的種質資源保存方法[9]。組織培養技術在薄荷屬植物的生產中應用十分廣泛。雖然針對薄荷屬植物組織培養技術研究在國內外已有一些報道[10-12],但在某些技術環節方面還存在一些限制因素,如外植體的污染、褐變、組培苗玻璃化現象以及病毒檢測等。
本試驗以薄荷莖段為外植體,建立高再生率的薄荷離體培養植株再生體系,確定草甘膦篩選的選擇壓,并將帶除草劑標記的植物表達載體pBI121-Ubi-epsps通過農桿菌介導轉化薄荷,用PCR和RT-PCR法對轉化薄荷進行分子鑒定。獲得能夠耐受除草劑的轉基因薄荷,該試驗對后期雜種優勢的利用、種質資源的保存以及植物新品種的培育奠定基礎,具有重要的理論與實踐意義。
1 材料與方法
1.1 植物材料與菌株
薄荷苗、pBI121-Ubi-epsps農桿菌菌株均由石河子大學生命科學學院農業生物技術重點實驗室保存。
1.2 分子生物學試驗材料
TaqDNA Polymerase、DNAsecure Plant Kit及普通瓊脂糖凝膠DNA回收試劑盒等購自于北京天根生化科技有限公司;引物合成、序列測定由北京華大基因科技股份有限公司完成;其他試劑均為分析純。
1.3 薄荷除草劑耐受性分析
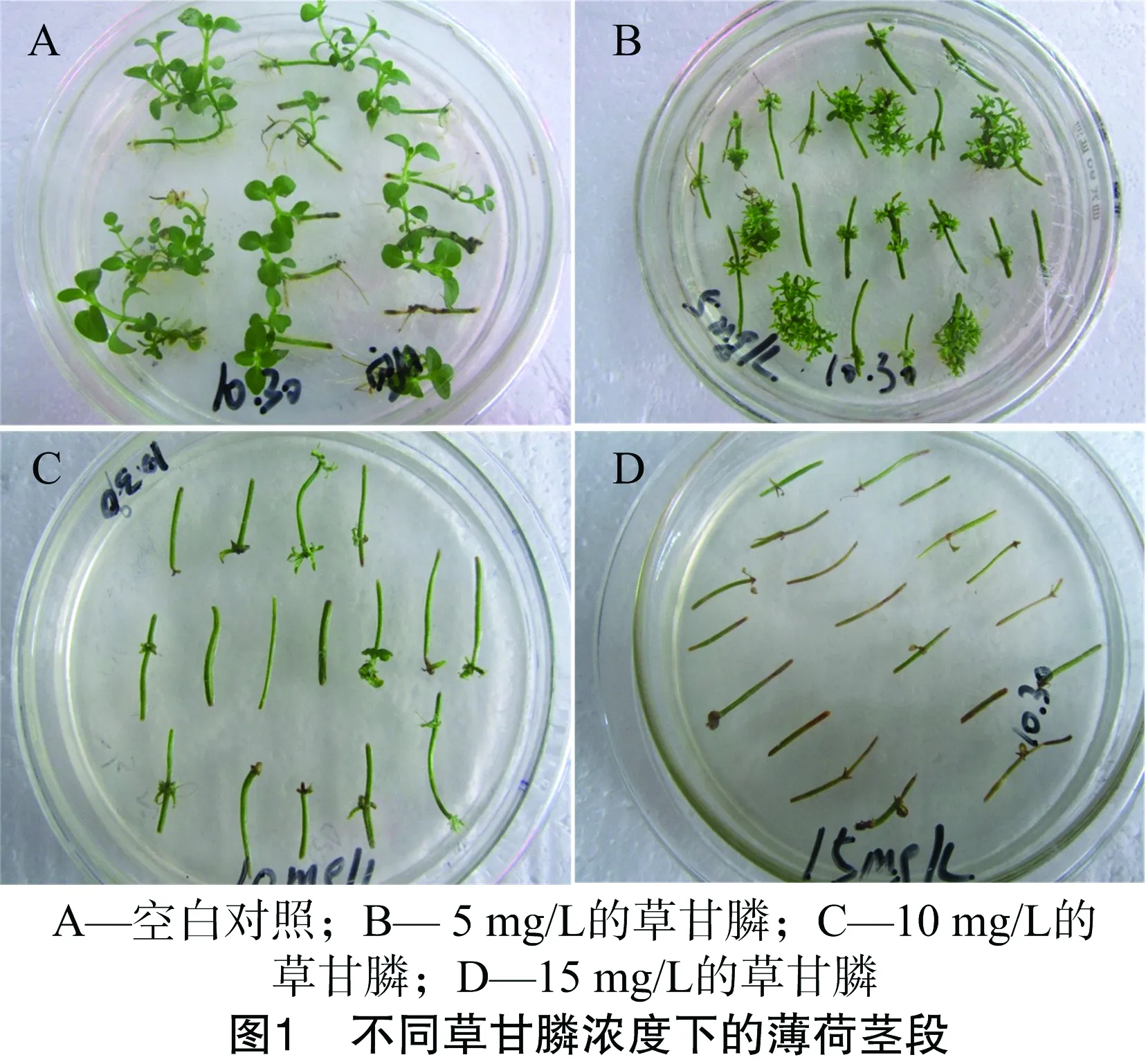
設置不同濃度梯度的草甘膦濃度(0、5、10、15 mg/L),并將薄荷莖段接種到不同濃度梯度(100 mL MS中含草甘膦0、50、100、150 μL)的分化篩選培養基上,培養5 d觀察篩選結果。
1.4 薄荷的遺傳轉化
剪取薄荷無菌苗的莖段,在預培養基上培養2 d,通過農桿菌介導將pBI121-Ubi-epsps整合進薄荷基因組中,莖段侵染后接種于鋪有濾紙的共培養基(MS+100 mg/L AS)上暗培養3 d,之后轉接到延遲篩選培養基(MS+0.5 mg/L 6-BA+0.05 mg/L NAA+300 mg/L Cb)中培養4~5 d。然后,在選擇培養基(MS+0.5 mg/L 6-BA+0.05 mg/L NAA+300 mg/L Cb+10 mg/L PPT)中進行培養,當出現抗性叢生芽長至2~3 cm時,切取分別放入生根培養基(1/2MS+1.0 mg/L NAA+300 mg/L Cb+10 mg/L PPT)中誘導生根。待根系長至2~3 cm時移栽至花盆。
1.5 薄荷的分子檢測
采用CTAB法[13]提取薄荷葉片基因組總DNA,以pBI121-Ubi-epsps質粒為陽性對照,野生型薄荷的DNA為陰性對照,PCR檢測目標基因。用TRNzol法[13]提取陽性植株的總RNA,以pBI121-Ubi-epsps質粒為陽性對照,相應的野生型薄荷為陰性對照,進行RT-PCR檢測。
2 結果與分析
2.1 空白薄荷抗除草劑耐受性分析結果
以0、5、10、15 mg/L的草甘膦濃度梯度對薄荷莖段進行培養。由圖1可知,在草甘膦濃度為10 mg/L的情況下,薄荷莖段的生長是最好的。所以草甘膦濃度為10 mg/L時最適宜。
2.2 薄荷的遺傳轉化
經過鑒定為陽性pBI121-Ubi-epsps的載體通過莖段法轉化普通野生型薄荷。侵染后培養2 d,將其轉接到篩選分化培養基上進行芽分化,10~15 d莖段兩端長出黃綠色的愈傷組織(圖2-A),延遲培養30~50 d,莖段兩端分化長出不定芽(圖2-B)。待不定芽生長到2~3 cm后剪下不定芽,將其插入到篩選生根培養基中進行篩選培養。其中一部分不定芽白化,繼續培養會死亡,這部分為逃逸芽;還有一部分出現白綠各半的現象,這部分為嵌合體;最后一部分在篩選培養基中正常生長,為轉化植株(圖2-C)。將篩選出的轉化植株移至生根培養基上,待正常轉化的植株生長到株高8~10 cm、根長2~4 cm時(圖2-D),提取該轉化薄荷的DNA進行PCR檢測。將檢測為陽性的植株移栽至高20 cm、直徑18 cm的花盆中,在光照度10 000 lx、光照16 h、黑暗8 h、溫度26 ℃、相對濕度70%的培養室生長,并挑選生長相似的普通野生型薄荷種植在相同條件下培養觀察(圖2-E),一直培養至開花(圖2-F)。
2.3 pBI121-Ubi-epsps對薄荷的轉化及轉基因植株的分子檢測
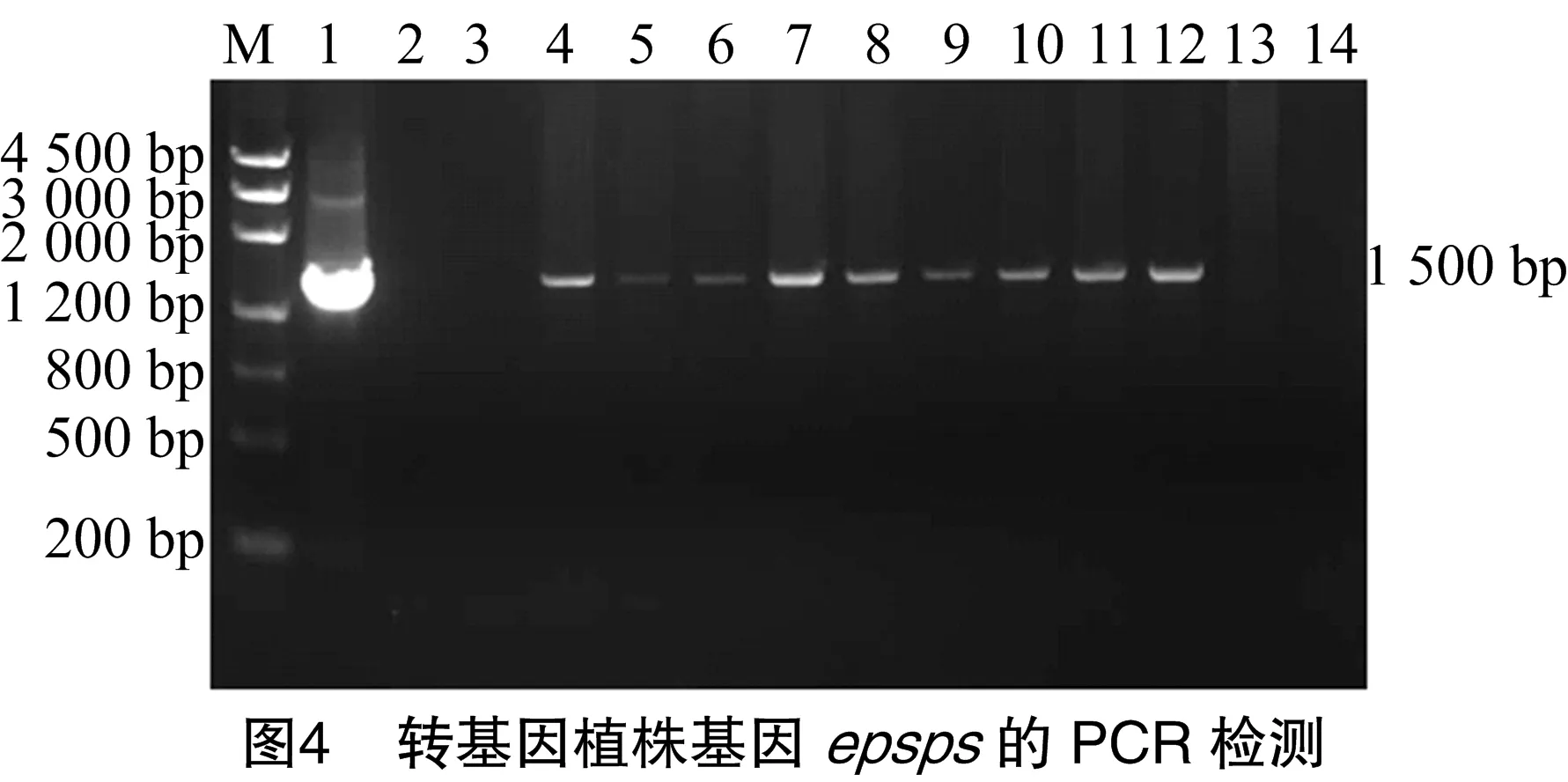
CTAB法提取薄荷基因組總DNA,在PCR過程中,要分別以植物表達載體為模板的PCR擴增產物作陽性對照,野生型植株基因組DNA為模板的PCR擴增反應產物為陰性對照。結果表明,轉基因株系中均能擴增出目的片段,野生型薄荷中未能擴增出目的片段的條帶,說明目的基因完全插入薄荷基因組DNA(圖3、圖4)。
3 結論與討論
通過對薄荷抗除草劑耐受性的分析,結果表明草甘膦濃度為10 mg/L時是最適宜的。導入外源抗除草劑基因是培育抗除草劑植株新品種的有效途徑,本試驗將抗除草劑基因應用于經濟作物中,為改良作物的品種以及保持優良品種的優勢奠定基礎。
隨著植物分子生物學、細胞學等學科的迅速發展及其研究水平的不斷提高, 必將有助于我們了解植物雄性不育。對于植物雄性不育的研究,不要僅從單一的生理生化方面進行研究,應該和分子生物學等相結合,更加全面地研究其發生機理。相信隨著技術的不斷發展,將進一步深化植物雄性不育的研究,揭示其發生機理,選育出綜合性狀更加優良的不育系,充分發揮雜種優勢。


草甘膦是一種廣譜滅生性、內吸傳導型的優秀除草劑,其殺草機理是抑制植物必需氨基酸合成途徑中5-烯醇式丙酮酰-莽草酸-3-磷酸合成的活性,從而使雜草致死。但在其應用過程中,對普通農作物同樣具有非選擇性的毒殺作用,植物中epsps合成酶的過量表達或某些活性位點氨基酸的突變對高劑量的草甘膦有較強的耐受性。近年來,抗草甘膦轉基因作物在全球范圍內的廣泛應用得到了人們越來越多的關注。
本試驗中將抗除草劑基因構建植物表達載體,并轉化薄荷,為改良作物的品種以及保持優良品種的優勢奠定了基礎。本試驗是以具有商業價值的薄荷為材料,將構建好的帶有除草劑標記的植物表達載體pBI121-Ubi-epsps轉化薄荷,獲得轉基因薄荷植株,導入外源抗除草劑基因是培育抗除草劑植株新品種的最有效途徑,該方法大大節省了人力以及財力等,具有更強的實用性。期望通過本試驗最終為創造具有商業推廣前景的作物提供一個技術平臺。
[1]戴克敏. 國產薄荷屬(MenthaLinn.)的栽培種類的初步研究[J]. 藥學學報,1981,16(11):349-353.
[2]黃士誠. 薄荷屬植物的染色體數目及其栽培種的起源[J]. 香料香精化妝品,1997(3):24-25.
[3]中國植物志組委會.中國植物志:第66卷[M]. 北京:科學出版社,1972:260-274.
[4]全國中草藥匯編編寫組.全國中草藥匯編:上冊[M]. 北京:人民衛生出版社,1975:924.
[5]中華人民共和國衛生部藥典委員會.中華人民共和國藥典(一部)[M]. 北京:人民衛生出版社,1985.
[6]魯朝暉,張少艾. 唇萼薄荷屋頂草坪建植與養護技術研究[J]. 草原與草坪,2004(1):58-59.
[7]汪茂斌,馬宗新,趙 紅,等. 薄荷品種提純途徑及程序[J]. 安徽農業科學,2000,28(2):235-236.
[8]方曉志,高山林,趙夢晗. 薄荷誘導株系田間農藝性狀鑒定及揮發油含量測定[J]. 藥物生物技術,2005,12(2):93-97.
[9]Hirai D,Sakai A. Cryopreservation of in vitro-grown axillary shoot-tip meristems of mint(MenthaspicataL.)by encapsulation vitrification[J]. Plant Call Reports,1999,19(2):150-155.
[10]柴明良. 留蘭香的試管繁殖[J]. 植物生理學通訊,1994,30(1):30.
[11]李 格,呂國華,賈曉鷹,等. 6-BA、NAA及其組合對誘導薄荷莖段分化與增殖的影響[J]. 石河子大學學報(自然科學版),22(4):305-308.
[12]Bhat S,Maheshwari P,Kumrr S. Mentha species:invitroregeneration and genetic transformation[J]. Molecular Biology Today,2002,3(1):11-23.
[13]F.M.奧斯伯. 精編分子生物學實驗指南[M]. 顏子穎,王海林,譯.北京:科學出版社,1998.

