自動QuEChERS方法結合液相色譜串聯質譜對玉米中133種農藥的多殘留分析
王濟世,賀澤英,徐亞平,王 璐,彭 祎,劉瀟威
(農業部農產品質量安全環境因子控制重點實驗室/農業部環境保護科研監測所,天津 300191)
玉米是重要的糧食作物和重要的飼料來源。在現代農業生產中,為了減少病蟲草害[1-2],保證玉米產量,不可避免地需要使用農藥[3]。然而,當食用農產品中的農藥殘留量超過一定水平,就可能會對人類的健康造成危害[4-5]。為了保障農產品質量安全和食用者身體健康,我國明確規定了食品中的農藥最高殘留限量(MRLs)。快速檢測農產品中農藥殘留是保證食品安全的重要手段,而快速、簡便、靈敏的分析方法,將成為農藥殘留檢測的主要目標[6]。
Anastassiades等[7-8]在2003年首次提出了QuECh-ERS(快速、簡單、廉價、高效、耐用、安全)方法,并對其在農藥多殘留檢測中的簡便性和廣泛適用性進行了驗證,現已得到廣泛認可。該方法主要分為兩個步驟:提取和凈化。在基質前處理過程中常用乙腈作為提取溶劑,并加入專用萃取鹽包去除基質中的水分等干擾物,離心后將上清液轉移至凈化材料中,利用分散固相萃取技術進行凈化[9]。為了使QuEChERS方法適用范圍更廣,研究人員不斷對提取溶劑,凈化材料等步驟進行改進和完善[10-13]。
目前,國外也研究開發了一些自動化比較強的QuEChERS方法,但價格昂貴。而我國本立科技公司新研發的自動QuEChERS前處理設備價格低,簡單快捷,具有很好的應用前景。本研究在QuEChERS方法的基礎上,借助自動QuEChERS前處理設備,建立了一個更加簡單、便捷的方法——高通量自動QuECh-ERS方法。為保證方法的適用性,在自動QuEChERS方法建立過程中,選擇了基質較復雜的谷物——玉米進行添加回收實驗,結合LC-MS/MS進行檢測,并對該方法的實用性進行了驗證。
1 材料和方法
1.1 材料和試劑
乙腈、甲醇(色譜純,Fisher);乙酸(優級純,中國國藥集團化學試劑有限公司);實驗用水為實驗室一級水;EN法(歐盟標準)萃取鹽包(美國Agilent公司):內含4 g無水硫酸鎂、1 g氯化鈉、1 g檸檬酸鈉、0.5 g檸檬酸氫二鈉;AOAC法(美國標準)萃取鹽包(美國Agilent公司):內含6 g無水硫酸鎂,1.5 g醋酸鈉;陶瓷均質子(美國Agilent公司);凈化材料:無水硫酸鎂、N-丙基乙二胺(PSA)及C18150 mg(美國Agilent公司);鋯珠(R101、R104)和雙層提取凈化管(本立科技公司);針管式過濾膜(0.22 μm,美國 Agilent公司)。
農藥標準溶液(美國Chem Service公司和德國Dr.Ehrenstorfer公司),純度大于98%。將133種農藥標準溶液用丙酮作溶劑配成5 mg·L-1混標溶液,-20℃儲存備用。
玉米面粉購自天津市的超市。
1.2 儀器
渦旋振蕩器(Thermo,美國);高速冷凍離心機(Heal Force,香港);Qtrap 4500三重四級桿質譜儀和Acquity LC100高效液相色譜儀(美國AB Sciex公司);C18色譜柱(1.8 μm,2.1 mm×100 mm)購于美國Waters公司。
1.3 自動前處理設備
自動QuEChERS前處理設備是一款自動程序控制分析樣品制備的設備,利用強力立體“8”字振蕩造成渦旋效果,實現提取效能;再與電機單向運動實現的離心功能相結合,來完成樣品中待測成分的提取和凈化。與配套提取管組合,開發出全新的自動QuEChERS處理方法,其流程示意圖見圖1。
自動QuEChERS前處理設備專用提取管由內外兩層管組成,內管側壁開若干小孔,孔上覆有只允許提取溶劑通過的半透性微孔膜。使用時,先將樣品加入外管,再加入提取劑,并放入鋯珠,將裝有凈化材料的內管插入外管內,擰緊放入提取儀中。儀器自動順序實現兩次振蕩和離心。振蕩時,在鋯珠的幫助下,樣品與提取劑充分接觸混合。當振蕩提取結束,開始離心時,樣品受到離心力的作用,提取液與提取殘渣分離,提取液透過微孔濾膜進入到內管,迅速得到潔凈的上清液,再經過二次振蕩與凈化劑充分作用得到凈化。圖2為提取管的抑制滲透效果及對實際樣品的處理效果。
1.4 檢測條件
1.4.1 液相條件
柱溫40℃,流動相A為甲醇,流動相B為0.2%醋酸銨,進樣量 5 μL,流速 0.3 mL·min-1。梯度洗脫程序見表1。
上式中,和分別表示非耐用品與耐用品的價格;Ht表示消費者新購買的耐用品;Bt表示無風險債券;與分別表示非耐用品部門與耐用品部門名義工資;與表示消費者在非耐用品部門與耐用品部門的就業;Rt表示名義利率;為物質資本租金率;常量K表示物質資本,與Barsky et al. 相同,[17]我們將物質資本設定為常數,原因在于任意時期經濟中可供使用的物質資本數量是一定的(取決于上一時期末物質資本存量);Ot表示消費者獲得的其他收入。定義δ為耐用品的折舊率,耐用品Dt的動態積累過程為:
1.4.2 質譜條件
氣簾氣(CUR)25 psi(1 psi=6.895 kPa),碰撞活化參數(CAD)中等,離子噴霧電壓5.5 kV,離子源溫度500℃,離子源氣體1(GS1)50 psi;離子源氣體2(GS2)50 psi。目標化合物的保留時間、離子對、去簇電壓、碰撞能質譜條件見表2。
1.5 樣品的制備
EN法:(1)稱取玉米樣品5 g于離心管外管中,加入混標溶液(外標法),靜置30 min;(2)加入10 mL水渦旋混勻,靜置 30 min;(3)加入10 mL乙腈,加入EN萃取鹽包及10顆鋯珠,擰緊內管(內含無水硫酸鎂 450 mg,PSA 75 mg,C1875 mg);(4)放入自動QuEChERS前處理設備開始處理。處理結束后從內管中取清液1 mL過0.22 μm微孔濾膜,待測。
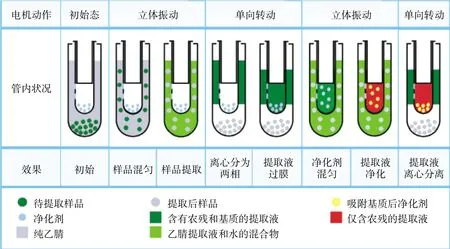
圖1 自動QuEChERS方法流程示意圖Figure 1 Diagram of automated QuEChERS method

圖2 提取管的抑制滲透效果圖Figure 2 Diagram of double centrifuge tubes prevent the osmosis
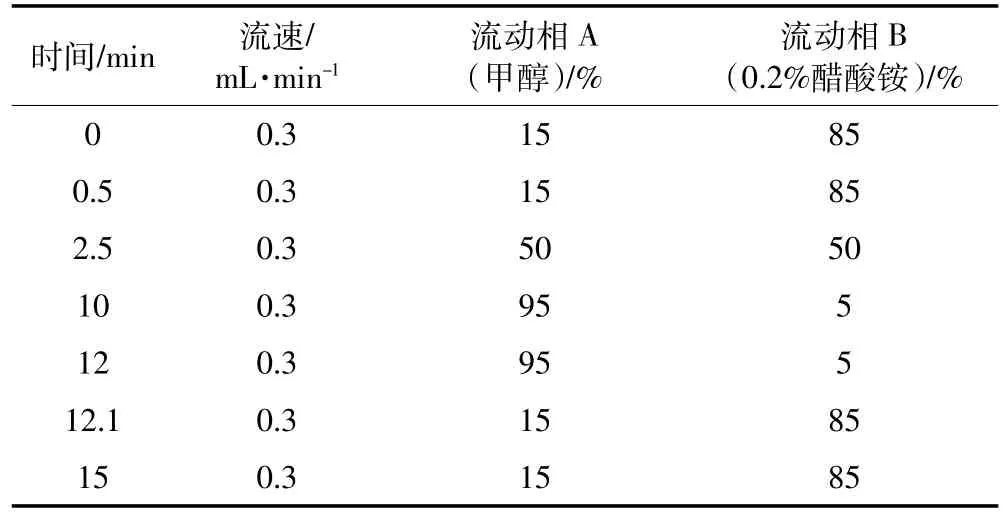
表1 流動相梯度洗脫參數Table 1 The gradient elution procedure of mobile phase
AOAC法:與EN法不同的是(3)加入10 mL乙腈(含1%乙酸),加入AOAC萃取鹽包及10顆鋯珠,擰緊內管(內含無水硫酸鎂600 mg、PSA 200 mg、C18200 mg);其他步驟相同。
2 結果與討論
2.1 提取時間的優化
為了探索最優的提取時間,對均質分離工作站第一階段的振蕩時間進行優化比較。本實驗將第一階段振蕩時間分別設置1、2、3 min進行對比,轉速1000 r·min-1,保持后面三個階段處理時間不變:第二階段離心 5 min,轉速 4000 r·min-1;第三階段振蕩 3 min,轉速1000 r·min-1;第四階段離心3 min,轉速4000 r·min-1。結果如圖3所示,當第一階段的振蕩時間為2 min和3min時,回收率相近。基于效率最優化,第一階段的振蕩時間定為2 min。實驗過程中,對第二至第四階段離心振蕩時間也進行了優化,但對結果影響不大。
2.2 提取方法的比較
實驗對兩種提取方法(EN和AOAC)進行了比較。從兩種方法得到的色譜圖(圖4)可以發現,兩種方法提取效果差異不大。但AOAC方法提取溶劑中需加入1%的乙酸,且凈化材料用量較大,所以本實驗采用EN提取方法。
2.3 與傳統QuEChERS方法的比較
本研究將自動QuEChERS方法與傳統QuECh-ERS方法進行了回收率的比較。傳統方法步驟:準確稱取5 g玉米于50 mL離心管中,加入混標溶液,靜置30 min,加入10 mL水渦旋混勻,靜置30 min,加入10 mL乙腈。加入EN萃取鹽包及1顆陶瓷均質子,擰緊蓋子,劇烈振蕩1 min,于8000 r·min-1下離心5 min,取6 mL上清液到凈化用離心管中,渦旋混勻1 min,于 8000 r·min-1下離心5 min。取上清液1 mL過0.22 μm微孔濾膜,待測。圖5給出了兩種方法在3個添加濃度下的回收率比較。從圖中可以看出,自動QuEChERS方法與傳統QuEChERS方法回收率相差不大,幾乎所有受測農藥回收率在70%~120%之間,通過兩種方法的比較,進一步說明了自動QuEChERS方法在玉米農藥多殘留分析中的可行性和適用性。
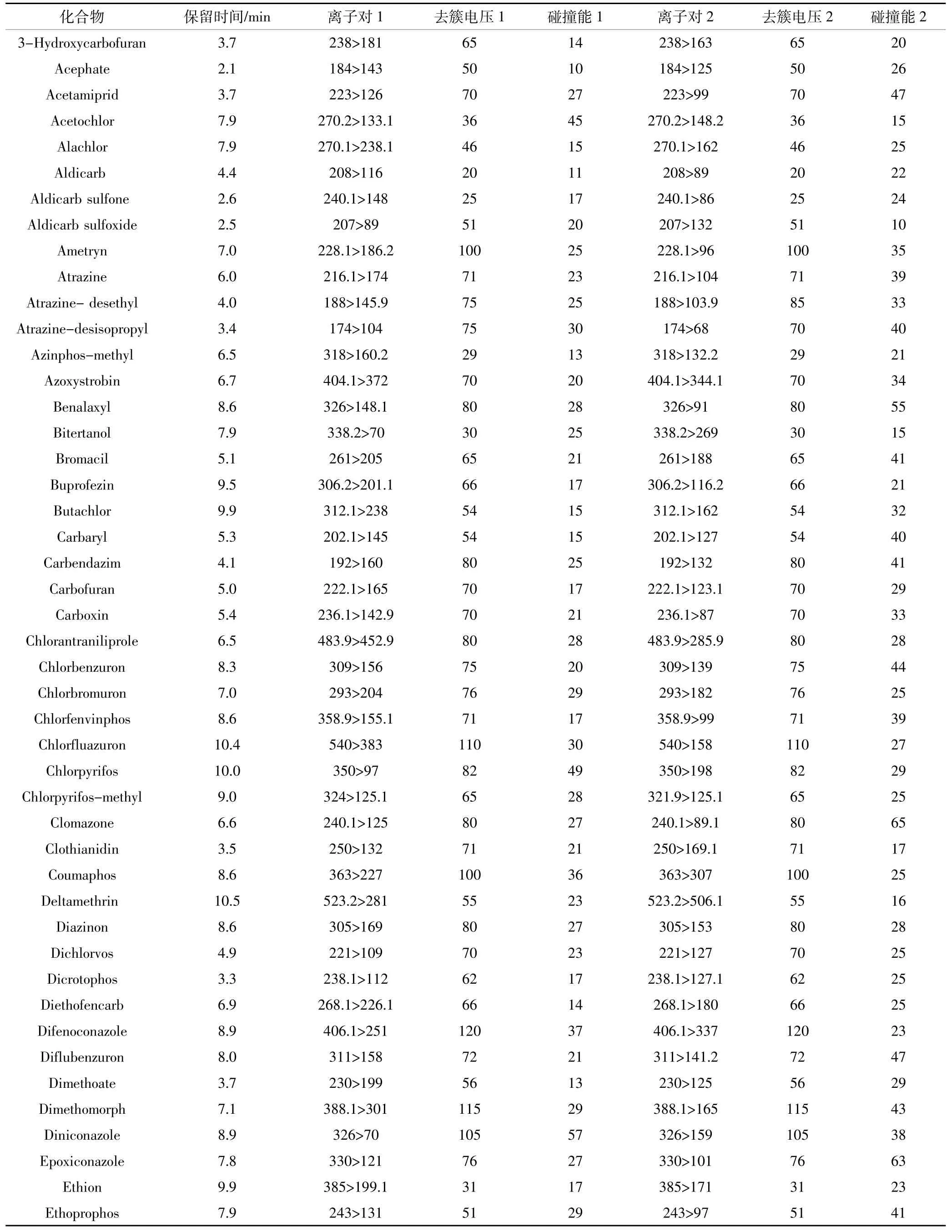
表2 目標化合物的質譜參數Table 2 Optimized chromatographic parameters for the selected antibiotics
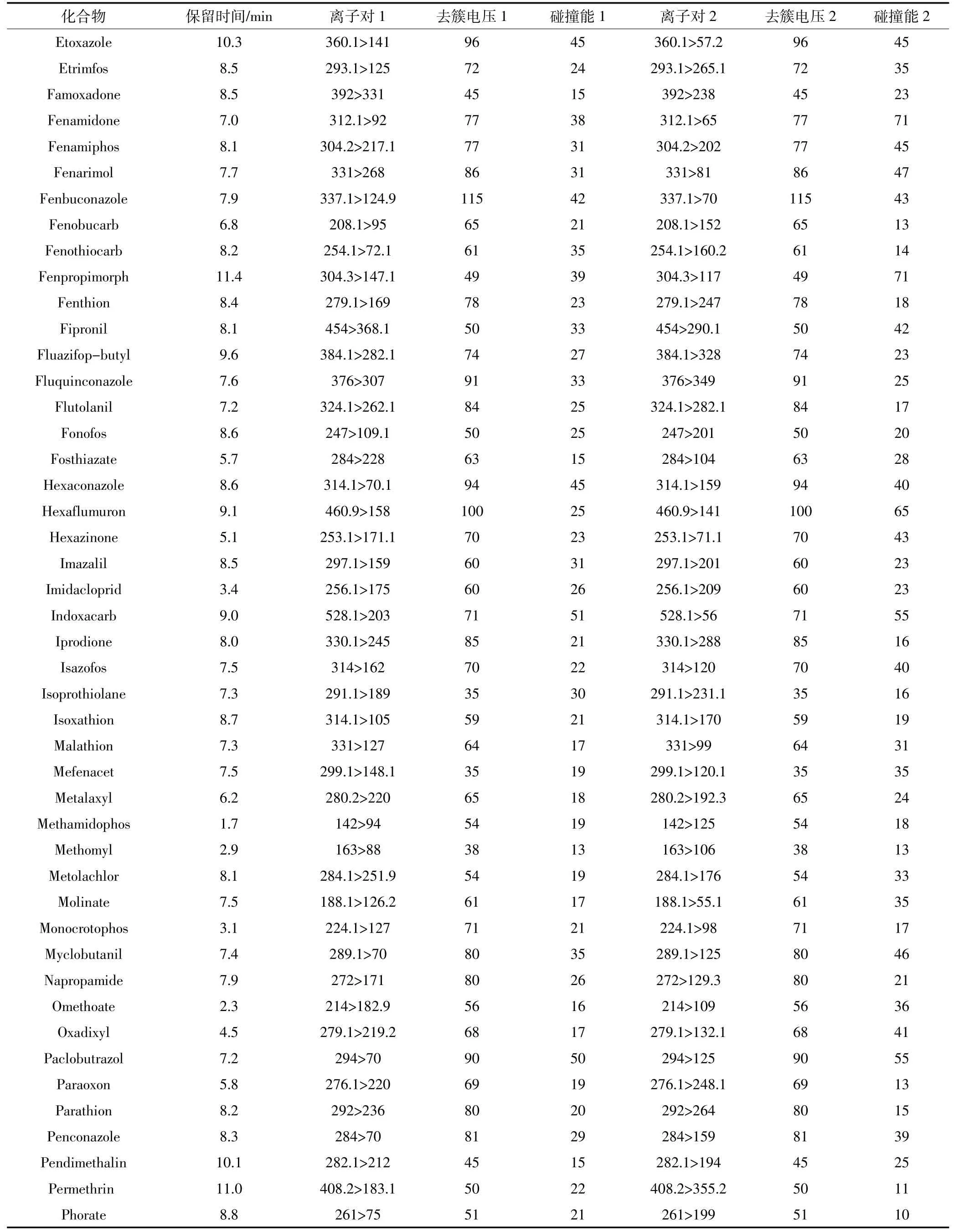
續表2目標化合物的質譜參數Continued table 2 Optimized chromatographic parameters for the selected antibiotics
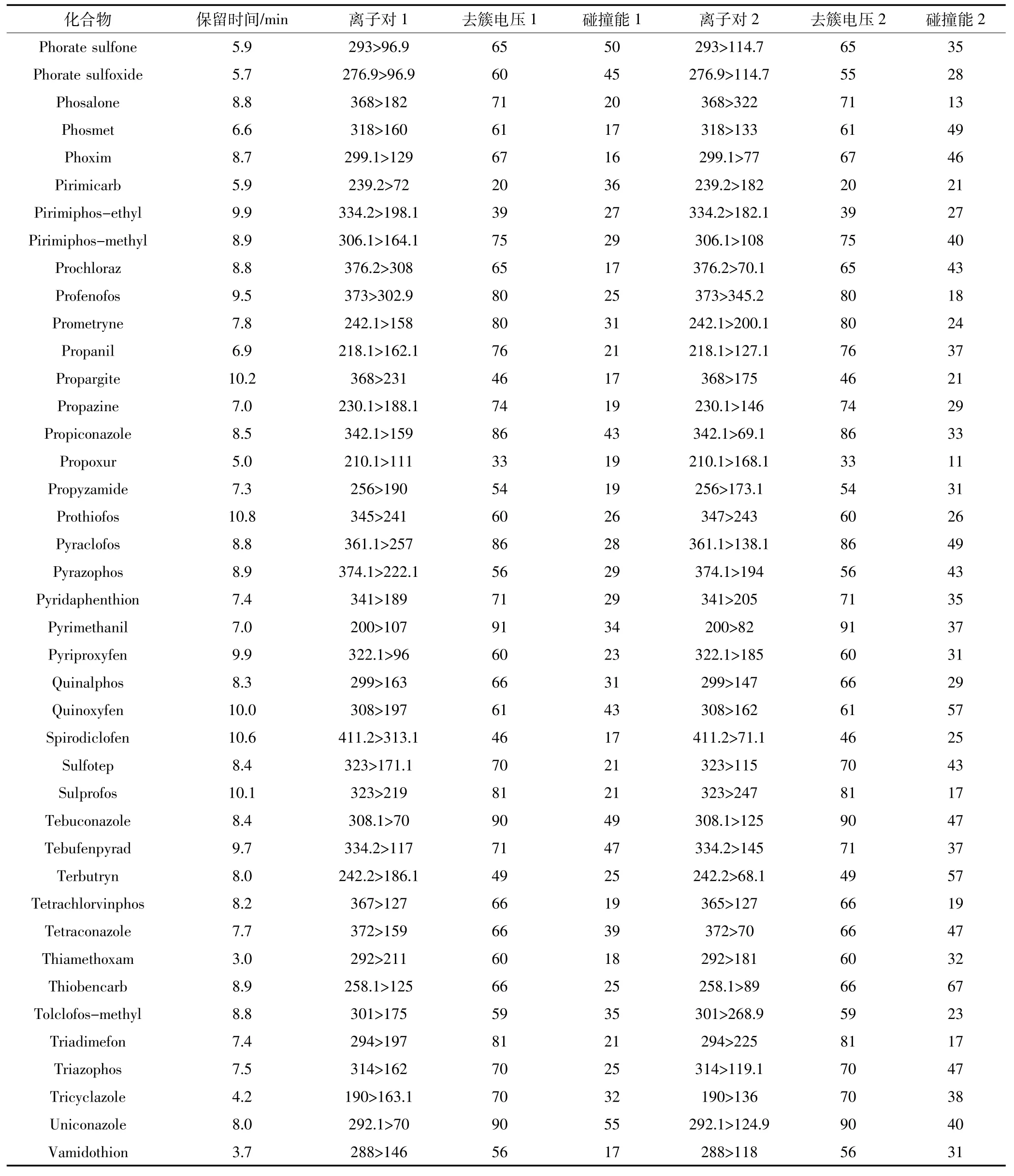
續表2目標化合物的質譜參數Continued table 2 Optimized chromatographic parameters for the selected antibiotics
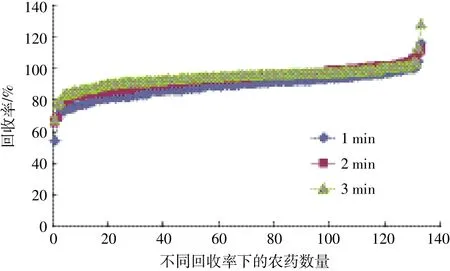
圖3 不同振蕩時間下玉米中133種農藥的回收率比較Figure 3 Recoveries of 133 pesticides in corn at different oscillation time
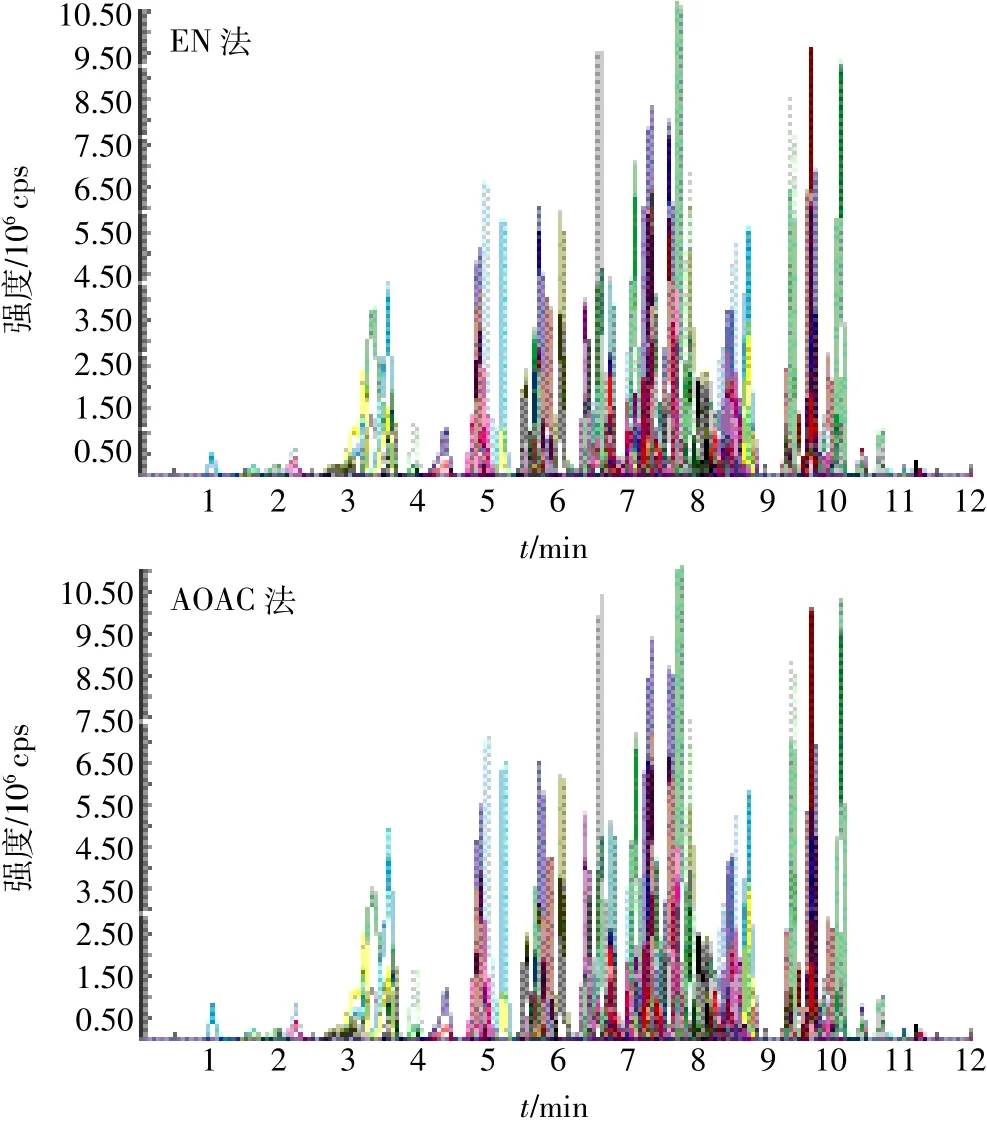
圖4 EN和AOAC提取方法得到的玉米提取化合物色譜圖Figure 4 The chromatogram of corn extracts using EN and AOAC method
2.4 基質效應
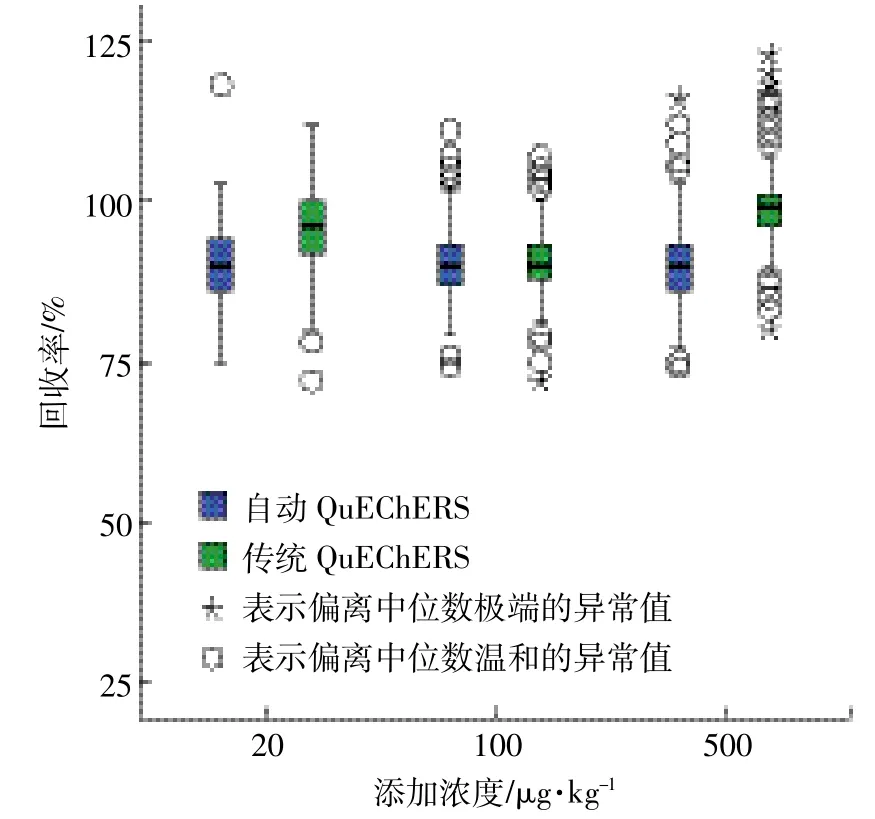
圖5 傳統方法和自動方法在3個添加水平時的回收率箱圖Figure 5 Boxplot of the recovery values obtained with the manual method and automatic method at three spiking level
式中:Sm和Ss分別表示基質標曲和溶劑標曲的斜率,當ME為-20%~20%、-50%~-20%或 20%~50%、<-50%或>50%時,分別表示輕微、中等、較強的基質效應。本研究基質效應(圖6)的評估結果表明,69%受測農藥基質效應在-20%~20%,屬于弱基質效應;而溴氰菊酯、芐氯菊酯等農藥表現為中等或強基質效應,所以在定量分析中使用基質標準校正曲線是必要的。
2.5 方法驗證
在實驗中,通過回收率、線性、定量限對自動QuEChERS方法進行了驗證。
待測農藥 3 個添加濃度為 20、100、500 μg·kg-1,每一濃度5個平行,得到的回收率在70%~120%,相對標準偏差低于15%。
用玉米空白基質配制 8個濃度水平(2、5、10、20、50、100、200、500 μg·kg-1),通過液相色譜-串聯質譜得標準工作曲線,呈現良好的線性,相關系數在0.990~0.999。
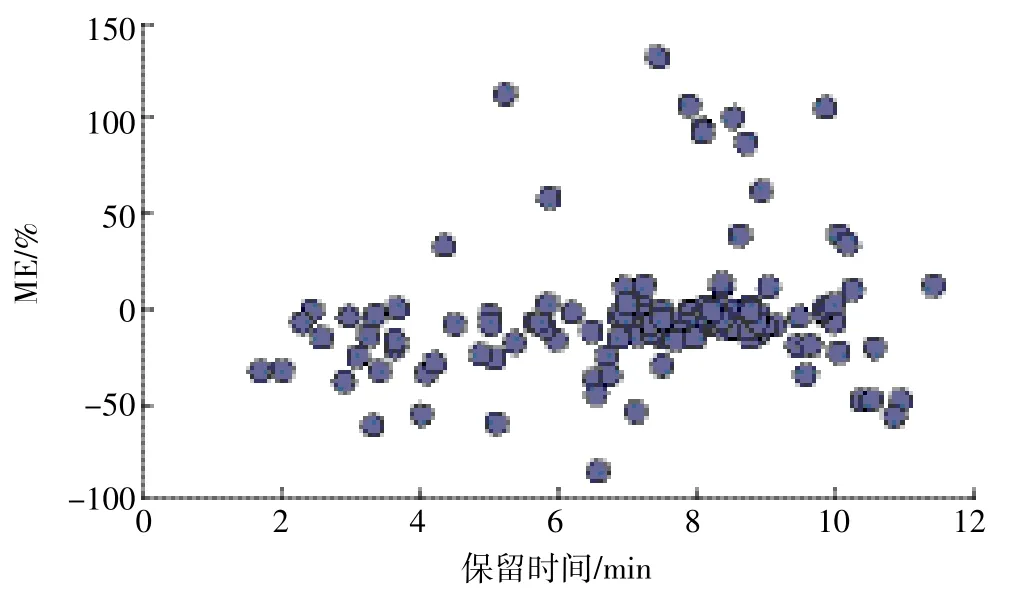
圖6 在玉米基質中受測農藥的基質效應Figure 6 Matrix effects(ME)of the test pesticides in corn
本實驗以目標化合物回收率在70%~120%、相對標準偏差小于20%時的最小添加濃度為定量限,在對玉米133種農藥檢測結果中,有119種農藥的定量限為 2 μg·kg-1,相比 He 等[16]所報道的更低。
2.6 實際樣品測定
對山東省10個玉米樣品(S-1~S-10),采用自動QuEChERS方法進行農藥殘留測定。其中S-3、S-5、S-6、S-9中未檢出農藥殘留,S-1中莠去津、乙草胺有檢出,濃度分別為 20.8 μg·kg-1和 10.1 μg·kg-1;S-2中乙草胺檢出濃度為6.2 μg·kg-1,毒死蜱檢出濃度低于檢出限;S-4 檢出甲草胺 16.2 μg·kg-1,毒死蜱2.7 μg·kg-1,S-7 檢出甲草胺 4.2 μg·kg-1,三唑酮 3.1 μg·kg-1,除蟲脲 2.7 μg·kg-1,克百威低于檢出限;S-8中檢出莠去津、氯蟲苯甲酰胺濃度分別為9.8、4.6 μg·kg-1;S-10 中檢出 3-羥基克百威 2.9 μg·kg-1,莠去津8.3 μg·kg-1。結果表明,本方法適用于玉米中農藥殘留的測定。
3 結論
(1)在本研究中,通過對提取方法的比較、提取時間的優化,以及方法的驗證,建立了自動QuEChERS結合液相色譜-串聯質譜對玉米中133種農藥的多殘留分析方法。
(2)通過與傳統QuEChERS方法的比較,該方法耗時短、效率高,受測農藥總體回收率在70%~120%之間,相對標準偏差在15%以下,符合殘留檢測的要求。
(3)該方法成功應用于玉米實際樣品的檢測,為玉米中農藥多殘留檢測提供方法依據。
[1]Pizzutti I R,De K A,Zanella R,et al.Method validation for the analysis of 169 pesticides in soya grain,without clean up,by liquid chromatography-tandem mass spectrometry using positive and negative electrospray ionization[J].Journal of Chromatography A,2007,1142(2):123-136.
[2]Andreu V,Picó Y.Determination of pesticides and their degradation products in soil:Critical review and comparison of methods[J].Trends in Analytical Chemistry,2004,23(10):772-789.
[3]Fernandes V C,Lehotay S J,Geisasteggiante L,et al.Analysis of pesticide residues in strawberries and soils by GC-MS/MS,LC-MS/MS and two-dimensional GC-time-of-flight MS comparing organic and integrated pest management farming[J].Food Additives&Contaminants Part A Chemistry Analysis Control Exposure&Risk Assessment,2014,31(2):262-270.
[4]Sinha S N,Rao M V V,Vasudev K,et al.A liquid chromatography mass spectrometry-based method to measure organophosphorous insecticide,herbicide and non-organophosphorous pesticide in grape and apple samples[J].Food Control,2012,25(2):636-646.
[5]Sack C,Smoker M,Chamkasem N,et al.Collaborative validation of the QuEChERS procedure for the determination of pesticides in food by LC-MS/MS[J].Journal of Agricultural&Food Chemistry,2011,59(12):6383-6411.
[6]Zhao M A,Feng Y N,Zhu Y Z,et al.Multi-residue method for determination of 238 pesticides in Chinese cabbage and cucumber by liquid chromatography-tandem mass spectrometry:Comparison of different purification procedures[J].Journal of Agricultural&Food Chemistry,2014,62(47):11449-11456.
[7]Anastassiades M,Lehotay S J,Stajnbaher D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and"dispersive solid-phase extraction"for the determination of pesticide residues in produce[J].Journal of AOAC International,2003,86(2):412-431.
[8]Anastassiades M,Mastovská K,Lehotay S J.Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides[J].Journal of Chromatography A,2003,1015(1):163-184.
[9]賀澤英,劉瀟威.農產品中農藥殘留分析技術研究進展[J].農業資源與環境學報,2016,33(4):310-319.HE Ze-ying,LIU Xiao-wei.Research progress on pesticide residue analysis techniques in agro-products[J].Journal of Agricultural Resources and Environment,2016,33(4):310-319.
[10]Zhang K,Wong J W,Yang P,et al.Multiresidue pesticide analysis of agricultural commodities using acetonitrile salt-out extraction,dispersive solid-phase sample clean-up,and high-performance liquid chromatography-tandem mass spectrometry[J].Journal of Agricultural&Food Chemistry,2011,59(14):7636-7646.
[11]Walorczyk S,Droz·dz·yński D.Improvement and extension to new analytes of a multi-residue method for the determination of pesticides in cereals and dry animal feed using gas chromatography-tandem quadrupole mass spectrometry revisited[J].Journal of Chromatography A,2012,1251(2):219-231.
[12]Lehotay S J,Kyungae S,Hyeyoung K,et al.Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables[J].Journal of Chromatography A,2010,1217(16):2548-2560.
[13]劉滿滿,康 澍,姚 成.QuEChERS方法在農藥多殘留檢測中的應用研究進展[J].農藥學學報,2013,15(1):8-22.LIU Man-man,KANG Shu,YAO Cheng.Research progress of QuECh-ERS method in pesticide mult-residue analysis[J].Chinese Journal of Pesticide Science,2013,15(1):8-22.
[14]He Z Y,Chen S S,Wang L,et al.Multiresidue analysis of 213 pesticides in leek and garlic using QuEChERS-based method and gas chromatography-triple quadrupole mass spectrometry[J].Analytical&Bioanalytical Chemistry,2015,407(9):2637-2643.
[15]Rajski ?,Lozano A,Uclés A,et al.Determination of pesticide residues in high oil vegetal commodities by using various multi-residue methods and clean-ups followed by liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A,2013,1304(16):109-120.
[16]He Z Y,Wang L,Peng Y,et al.Multiresidue analysis of over 200 pesticides in cereals using a QuEChERS and gas chromatography-tandem mass spectrometry-based method[J].Food Chemistry,2015,169:372-380.

