枯草芽孢桿菌HAINUP40水質凈化作用的研究
劉樹彬,王新銳,林壯其,蔡 巖,吳 越,劉 象,周永燦,王世鋒
(1.海南大學,南海海洋資源利用國家重點實驗室,海南 海口 570228;2.海南大學 海洋學院,熱帶生物資源教育部重點實驗室,海南 海口 570228;3.海南大學 海洋學院,海南省水生生物技術重點實驗室,海南 海口 570228;4.海南省藍色海洋生物科技有限公司,海南 海口 570100)
隨著水產養殖業迅速發展,集約化養殖規模日益擴大和養殖密度的不斷提高[1],養殖過程中產生的大量魚蝦排泄物和殘餌,使得水體中的有機物、亞硝酸鹽氮、氨氮等有害物質含量增加,使得養殖動物免疫力降低,生長速度減慢,導致疾病爆發和死亡[2],嚴重限制了水產養殖業的可持續發展。近年來,水產養殖業者通過使用益生菌,一方面通過向水體中添加微生態制劑,促進水體中有機物等污染物的礦化與分解,改善養殖池塘的水質,降低對環境的污染[3],取得了良好的效果。另一方面,向水產動物飼料中添加益生菌,提高了水產動物的生長速度和免疫力,并在增強水產動物抵抗病原侵染的能力等方面取得了重要的研究進展。
目前,水產上廣泛使用的具有水質改良效果的益生菌種類繁多,包括芽孢桿菌、光合細菌、復合EM菌、硝化細菌、乳酸菌等[4]。其中,芽孢桿菌屬中的枯草芽孢桿菌(Bacillussubtilis)由于具有多種優良特性而在水產養殖中得到了廣泛應用[5]。首先,枯草芽孢桿菌能夠分泌大量的淀粉酶、蛋白酶和脂肪酶等胞外酶,能迅速降解殘餌和排泄物中的淀粉、蛋白質和脂肪等有機物,加快水體中有機物的礦化與分解,從而達到凈化水質的目的[6];其次,枯草芽孢桿菌可分泌多肽類物質和細菌素類物質等,能抑制病原菌的滋生,提高動物的免疫力[7];另外,枯草芽孢桿菌可形成芽孢,從而表現出對環境較強的耐受性,以便于儲存和運輸等。已有研究表明,枯草芽孢桿菌具有較好的凈化水質的作用[8-10]。
本實驗室從天然水體中分離篩選到一株枯草芽孢桿菌HAINUP40[11],該菌株對魚源致病性無乳鏈球菌(Streptococcusalactolyticus)具有較強拮抗作用,拌料投喂可提高尼羅羅非魚(Oreochromisnilloticus)的非特異免疫力和抵抗無乳鏈球菌感染能力;而且枯草芽孢桿菌HAINUP40具有較強的胞外蛋白酶和淀粉酶活性[12]。因此,筆者對枯草芽孢桿菌HAINUP40的水質凈化效果進行研究,以期為研制同時具有預防無乳鏈球菌疾病和水質改良效果的微生態制劑奠定基礎,亦為水產養殖多功能微生態制劑的開發和利用提供優良的菌種資源。
1 材料與方法
1.1 試驗材料
1.1.1 菌種來源
試驗所用枯草芽孢桿菌菌種(菌株編號:HAINUP40,NCBI序列號:KY244143.1)為本實驗室分離并鑒定,-80 ℃保存備用。
1.1.2 培養基配方
枯草芽孢桿菌HAINUP40生長曲線測定的培養基配方:
(1)普通淡水培養基:酵母粉1 g,牛肉膏3 g,蛋白胨5 g,氯化鈉5 g,蒸餾水1000 mL。pH:7.6~7.8。
(2)普通海水培養基:酵母粉1 g,牛肉膏3 g,蛋白胨5 g,氯化鈉30 g,蒸餾水1000 mL。pH:7.6~7.8。
(3)細菌基礎培養基:胰蛋白胨10 g,酵母粉5 g,氯化鈉10 g,蒸餾水1000 mL。
(4)2216E培養基:蛋白胨5 g,酵母粉1 g,磷酸高鐵0.01 g,陳海水1000 mL。pH:7.6~7.8。
(5)氨氮降解菌篩選培養基:酵母粉1 g,牛肉膏3 g,氯化銨0.078 g,硫酸銨0.1 g,氯化鈉5 g,蒸餾水1000 mL。pH:7.6~7.8。其中氨氮含量約為30 mg/L[13]。
1.1.3 模擬廢水配制
(1)模擬廢水基礎配方參考張峰峰等[14-15]的配方并加以改進:豆粕粉0.6 g,麥麩0.6 g,氯化銨0.078 g,硫酸銨0.1 g,磷酸二氫鉀0.018 g,硝酸鉀0.6 g,七水合硫酸鎂0.013 g,二水合氯化鈣0.043 g,七水合硫酸亞鐵0.005 g,氯化鈉0.0016 g,無菌水1000 mL。pH:7.0~8.5。
(2)高含量氨氮和化學需氧量模擬廢水配方:在模擬廢水基礎配方的基礎上,每升模擬廢水氯化銨和硫酸銨添加量各提高至4倍,豆粕粉和麥麩添加量各提高至2倍。
1.2 試驗方法
1.2.1 菌株活化
取-80 ℃保藏的枯草芽孢桿菌HAINUP40,用普通淡水培養基活化后,在37 ℃生化培養箱中倒置培養24 h,挑取單個菌落接種于100 mL 普通淡水液體培養基中,37 ℃,180 r/min恒溫振蕩培養24 h,形成種子液。
1.2.2 最適培養基篩選
利用全自動生長曲線測定儀(Bioscreen C 型,芬蘭Bioscreen公司)測定枯草芽孢桿菌HAINUP40在37 ℃下在4種液體培養基(細菌基礎液體培養基、普通淡水液體培養基、普通海水液體培養基、2216E液體培養基)中的生長曲線,以空白培養基為對照,每隔1 h測定一次吸光值,并在試驗結束時繪制生長曲線,選出該菌株最適生長的液體培養基。
1.2.3 枯草芽孢桿菌HAINUP40對氨氮降解培養基的作用
試驗在6個500 mL錐形瓶中進行,在每個錐形瓶中加入300 mL氨氮降解菌篩選培養基,滅菌后放置在陰涼處。靜置2 d后隨機分為2組,對照組不添加枯草芽孢桿菌HAINUP40,試驗組添加枯草芽孢桿菌HAINUP40,添加終密度為4.74×106cfu/mL,分別在試驗開始的第0、6、12、24、48、72、96 h無菌操作取水樣,經0.22 μm濾膜過濾后測定氨氮和亞硝酸鹽氮含量。
1.2.4 枯草芽孢桿菌HAINUP40接種密度對模擬廢水的凈化作用
試驗在12個玻璃缸(直徑23.00 cm,高33.00 cm,容積12 L)中進行。在每個玻璃缸中加入5 L模擬廢水,缸口用紗布遮蓋,放置在陰涼處。靜置2 d后隨機分為4組,分別添加枯草芽孢桿菌HAINUP40使水體中菌液終密度分別為0 cfu/mL(對照組)、8.64×105cfu/mL、8.64×106cfu/mL和8.64×107cfu/mL[16],每組設3個平行。于試驗開始后的第3、6、9、12、24 h自每個缸中取水樣,經0.22 μm濾膜過濾后測定亞硝酸鹽氮、氨氮、化學需氧量、pH等水質指標,每次取水樣后補充相應量的無菌水。
1.2.5 枯草芽孢桿菌HAINUP40對高含量氨氮和化學需氧量模擬廢水的凈化作用
試驗在6個玻璃缸(直徑23.00 cm,高33.00 cm,容積12 L)中進行,在每個玻璃缸中加入5 L高含量氨氮和化學需氧量模擬廢水,缸口用紗布遮蓋,放置在陰涼處。靜置2 d后隨機分為2組,對照組不添加枯草芽孢桿菌HAINUP40,試驗組添加枯草芽孢桿菌HAINUP40,添加終密度為1.2.4中確定的凈水效果最佳的密度,每組3個平行,在試驗開始后的第0、6、12、24 h以及2、3、4、5、6、7 d測定水質指標(亞硝酸鹽氮、氨氮、化學需氧量及pH)。
1.2.6 枯草芽孢桿菌HAINUP40對養殖廢水的凈化作用
在海南大學海洋學院附近養殖池塘(采水位置為水面下0.3 m,透明度25~30 cm)采水樣5 L,靜置2 d后分裝入500 mL錐形瓶中。試驗分為A、B、C、D、E 5組。其中A組放置于室內陰涼處,C組放置于室內光照處,E組放置于暗箱內;B組和D組添加枯草芽孢桿菌HAINUP40,終密度為7.36×106cfu/mL,其中B組放置在室內光照處,D組放置在暗箱內。每組3個平行樣,分別在試驗開始后第0、6、12、24、48、72 h測定水質指標(亞硝酸鹽氮、氨氮、化學需氧量及pH)。
1.2.7 水質指標測定
參照陳國華[17]的方法,采用重氮偶氮法測定亞硝酸鹽氮,采用次溴酸鈉氧化法測定氨氮,采用堿性高錳酸鉀法測定化學需氧量,利用pH測定儀(DELTA320型,梅特勒—托利多公司)進行pH測定。對每組每個時間點取雙樣進行平行測定。
1.3 數據分析
采用 SPSS 17.0 統計軟件計算測定數據平均值、標準差以及進行差異顯著性分析。
2 結果與分析
2.1 枯草芽孢桿菌HAINUP40適宜培養基篩選
枯草芽孢桿菌HAINUP40在4種液體培養基(細菌基礎液體培養基、普通淡水液體培養基、普通海水液體培養基、2216E液體培養基)中進行培養,測定并繪制生長曲線(圖1)。結果表明,枯草芽孢桿菌HAINUP40在4種培養基中進入對數生長期的時間點為第3 h,但枯草芽孢桿菌HAINUP40在達到吸光值基本相同的穩定期所用時間不同。枯草芽孢桿菌HAINUP40在4種培養基中進入穩定期用時分別為:普通淡水培養基9 h,細菌基礎培養基13 h,2216E培養基18 h,普通海水培養基22 h。可見,枯草芽孢桿菌HAINUP40在不同培養基中的生長速度不同,由快到慢依次為普通淡水培養基>細菌基礎培養基>2216E培養基>普通海水培養基,為此,利用普通淡水培養基對枯草芽孢桿菌HAINUP40進行擴大培養為后續試驗提供菌液。
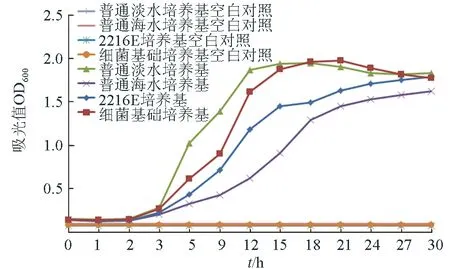
圖1 枯草芽孢桿菌HAINUP40在4種培養基下的生長曲線注:各組空白對照的數值較接近,在圖1中顯示為基本重合的直線.
2.2 枯草芽孢桿菌HAINUP40降解氨氮效果
將枯草芽孢桿菌HAINUP40添加到氨氮降解菌篩選培養基中,與對照組相比,試驗組的氨氮在第6 h有明顯的升高(P<0.05),然后氨氮質量濃度逐漸降低,并在第4 d時降至11.2 mg/L,相較于起始氨氮質量濃度26.4 mg/L,氨氮去除率達到57.58%(圖2a)。亞硝酸鹽氮質量濃度基本維持在0.01 mg/L的較低水平(圖2b),試驗組僅在第12 h亞硝酸鹽氮明顯升高(P<0.05)隨后第24 h又降至0.01 mg/L的低水平,試驗組與對照組在其余時間點并無顯著差異(P>0.05)。
2.3 枯草芽孢桿菌HAINUP40接種密度對模擬廢水凈化的作用
將密度為105、106cfu/mL和107cfu/mL的枯草芽孢桿菌HAINUP40分別添加到模擬廢水中,與對照組相比,3個試驗組在24 h內對水體中化學需氧量和pH均具有顯著的降低作用(P<0.05)。其中,在24 h時對化學需氧量去除率分別為69%、69%和81%(圖3a),水體pH隨著時間的推移逐漸降低,但菌的添加密度對pH的下降趨勢沒有影響,且下降速率基本一致,從初始的8.0降至6.8,均顯著低于對照組的pH7.9(圖3b)(P<0.05)。水體中的亞硝酸鹽氮質量濃度在試驗組和對照組間沒有明顯差異(P>0.05),在24 h內均表現出先升后降(圖3c)。水體中氨氮的質量濃度,在對照組中一直處于上升趨勢,并在第24 h時達到峰值,3試驗組則呈現先升后降的趨勢(圖3d)。其中,添加106cfu/mL試驗組在第3 h氨氮質量濃度開始增加,在第9 h達到最大值之后下降。其他組在第6 h開始升高,105cfu/mL和107cfu/mL試驗組分別在第9 h和第12 h達到峰值之后有所下降。
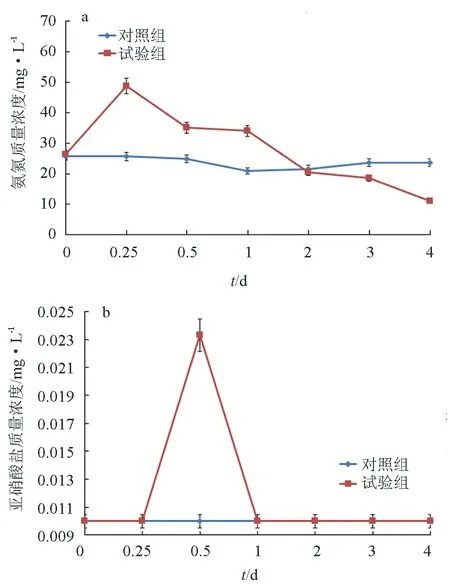
圖2 枯草芽孢桿菌HAINUP40對降解氨氮菌培養基的亞硝酸鹽氮和氨氮的影響a:氨氮;b:亞硝酸鹽氮.
可見,向模擬廢水中添加密度為106cfu/mL的枯草芽孢桿菌HAINUP40,可快速的對水體中的有機物降解,轉化為銨態氮和亞硝酸態氮等無機物,為此,后續試驗添加菌的密度均選取106cfu/mL。
2.4 枯草芽孢桿菌HAINUP40對高含量氨氮和化學需氧量模擬廢水的凈化作用
選取106cfu/mL作為接種密度來研究枯草芽孢桿菌HAINUP40對高含量氨氮和化學需氧量模擬廢水的影響,結果顯示,試驗組和對照組的化學需氧量濃度隨著時間的推移都有一個下降的趨勢,與對照組相比,試驗組下降趨勢明顯(P<0.05),7 d對化學需氧量的去除率達到90.37%(圖4a)。pH在對照組和試驗組中均顯示為先降后升的趨勢。其中,試驗組pH在第12 h時候達到最低值7.25,此后逐漸升高,在第5~7 d恢復到pH約8.0;對照組pH在第24 h達到最低值,之后逐步升高,在第7 d的時候同樣恢復到pH約8.0(圖4b)。亞硝酸鹽氮質量濃度在對照組和試驗組中均顯示為先升后降的趨勢,均在第24 h達到峰值。然而試驗組在第2 d時,其亞硝酸鹽氮質量濃度降至1.67 mg/L,而對照組則在第3 d才降到與試驗組相同水平(圖4c)。對氨氮的測定結果顯示,無論是試驗組還是對照組,氨氮質量濃度在整個試驗周期內均顯示為增高的趨勢,與對照組相比,枯草芽孢桿菌HAINUP40對高含量氨氮和化學需氧量廢水中的氨氮降解效果不顯著(P>0.05)(圖4d)。
2.5 枯草芽孢桿菌HAINUP40對養殖廢水的凈化效果
將枯草芽孢桿菌HAINUP40添加到養殖廢水中,無論是有光照的B組還是無光照的D組,與未添加菌的A組、C組和E組相比,水樣中亞硝酸鹽氮、氨氮質量濃度,pH和化學需氧量在第72 h都顯著降低(P<0.05)(圖5)。其中,B組和D組在72 h時對亞硝酸鹽氮去除率達到94.12%,而A組、C組和E組的亞硝酸鹽氮質量濃度均大幅度增加。添加枯草芽孢桿菌HAINUP40的B組和D組,氨氮和化學需氧量均有一個先升后降的過程,在第72 h之后,均顯著低于不添加菌株的A組、C組和E組(P<0.05),化學需氧量去除率達到72.13%。添加枯草芽孢桿菌HAINUP40的試驗組與對照組相比,pH顯著降低并在第48 h開始至試驗結束維持在pH7.5左右。
3 討 論
3.1 枯草芽孢桿菌HAINUP40對水體氨氮和亞硝酸鹽氮的影響
無論是淡水還是海水養殖過程中,水體中過量的氨氮、亞硝酸鹽氮等營養鹽都會影響養殖魚類的正常生長。在本研究中,將枯草芽孢桿菌HAINUP40接種到氨氮降解菌液體培養基中,4 d氨氮去除率為57.58%,可見該菌株具有較好的降低氨氮的效果。在氨氮降解菌培養基培養試驗中,添加枯草芽孢桿菌HAINUP40的試驗組與對照組相比,水體中的氨氮呈現先升(第6、12和24 h)后降(第2、3、4 d)的趨勢,在模擬廢水試驗、高含量氨氮和化學需氧量試驗和養殖廢水試驗中也都存在相同的現象。枯草芽孢桿菌屬于化能異養型微生物[18],對蛋白質等有機物的利用是通過胞外蛋白酶在細胞外將蛋白質分解為多肽、氨基酸和銨態氮,然后進行吸收與利用。水體中含氮有機物在微生物氨化作用下所形成的氨氮,會繼續在微生物的作用下,通過消耗溶解氧而進一步氧化為亞硝酸鹽氮和硝酸鹽[19]。在本研究中氨氮質量濃度呈上升趨勢,這可能是由于枯草芽孢桿菌對有機物進行水解,所產生的氨氮超出了硝化作用所能承載的量,終究導致氨氮質量濃度逐漸積累上升[20]。
水體中的氨氮會在細菌的作用下氧化為亞硝酸鹽氮和硝酸鹽[19]。在本研究中,將枯草芽孢桿菌HAINUP40接種到氨氮降解菌液體培養基中,氨氮質量濃度在第6 h達到峰值,亞硝酸鹽氮質量濃度在第12 h達到峰值,在第24 h亞硝酸鹽氮質量濃度恢復到較低水平,這可能是枯草芽孢桿菌HAINUP40具有將氨氮轉化為亞硝酸鹽氮甚至硝酸鹽的能力。在亞硝酸鹽氮去除方面,沈南南等[21]將芽孢桿菌添加到養殖水體中,5 d對亞硝酸鹽氮去除率為13.54%。李存玉等[22]利用混合的植物乳桿菌和芽孢桿菌,研究其對養殖水體亞硝酸鹽氮的去除效果,結果發現5 d對亞硝酸鹽氮去除率為57.8%。在本研究中,將枯草芽孢桿菌HAINUP40添加到養殖廢水中,試驗組的亞硝酸鹽氮質量濃度急劇下降,在第12 h降至0.01 mg/L,且維持到試驗結束,12 h對亞硝酸鹽氮去除率達到94.12%,顯示該菌對亞硝酸鹽氮具有較好的去除效果。不過在模擬廢水試驗和高含量氨氮和化學需氧量試驗研究中,與對照組相比,添加枯草芽孢桿菌HAINUP40后水體亞硝酸鹽氮質量濃度在較短時間即達峰值。這可能是由于水體中細菌對有機物的分解利用消耗大量氧氣,抑制了氨氮的硝化作用,導致氨氮和亞硝酸鹽氮在水中積累[23]。
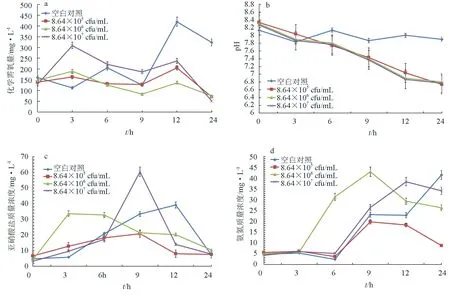
圖3 不同接種密度對化學需氧量、pH、亞硝酸鹽氮和氨氮質量濃度的影響a:化學需氧量;b:pH;c:亞硝酸鹽氮;d:氨氮.
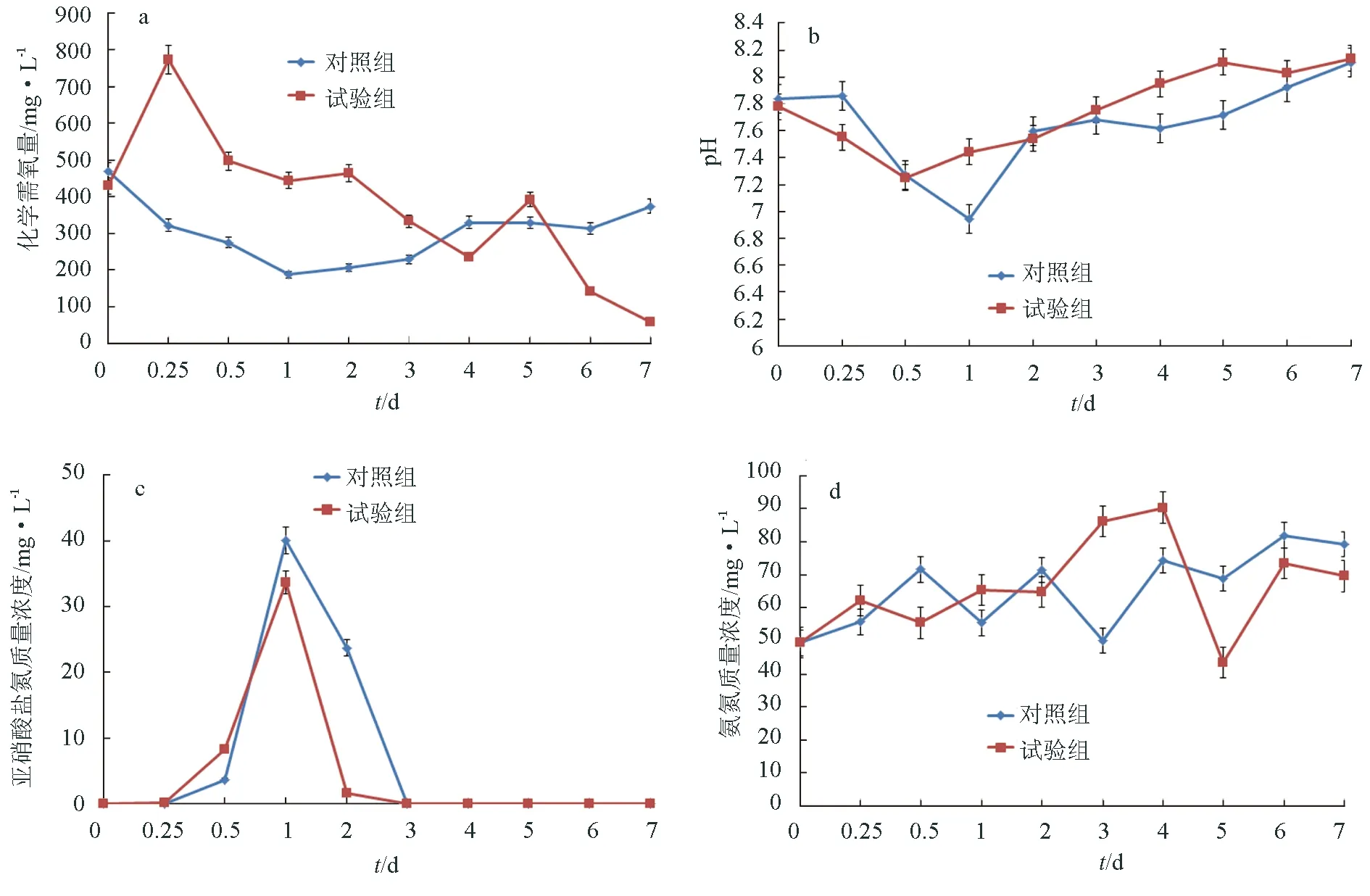
圖4 枯草芽孢桿菌HAINUP40對高含量氨氮和化學需氧量模擬廢水化學需氧量、pH、亞硝酸鹽氮和氨氮的影響a:化學需氧量;b:pH;c:亞硝酸鹽氮;d:氨氮.
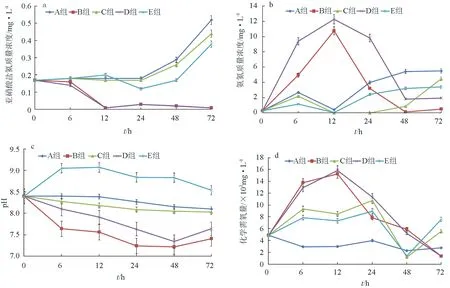
圖5 枯草芽孢桿菌HAINUP40對養殖廢水亞硝酸鹽氮、氨氮、pH和化學需氧量影響a:亞硝酸鹽氮;b:氨氮;c:pH;d:化學需氧量.
3.2 枯草芽孢桿菌HAINUP40對水體化學需氧量的影響
馬建新等[24]研究表明,養殖水體中高化學需氧量是導致養殖動物疾病爆發流行的主要原因之一。在養殖生產過程中,如能降低水體中的化學需氧量,不僅可以降低病害的發生,還可顯著提高水產養殖動物的特定增長率,降低餌料系數等[25]。胡詠梅等[26]用枯草芽孢桿菌凈化模擬廢水48 h對化學需氧量去除率為67%;孟睿等[27]用枯草芽孢桿菌和地衣芽孢桿菌(B.licheniformis)混合對養殖廢水9 d對化學需氧量去除率為67.97%。本研究將枯草芽孢桿菌HAINUP40添加到模擬廢水和養殖廢水中,在模擬廢水中24 h對化學需氧量去除率最高可達81%,7 d對化學需氧量去除率可達90.37%,在高含量氨氮和化學需氧量試驗中,7 d對化學需氧量去除率可達90.37%,在養殖廢水中72 h對化學需氧量去除率可達72.13%,可見枯草芽孢桿菌HAINUP40具有優良的降化學需氧量的能力。
3.3 枯草芽孢桿菌HAINUP40對水體pH的影響
pH是水體綜合理化因子的反映。它對水生動物滲透壓的調節及體內各種代謝的正常運轉具有重要意義,是水產養殖中的一個重要生態因子[28]。將枯草芽孢桿菌HAINUP40添加到模擬廢水和養殖廢水中,pH均有一個降低的過程。在養殖過程中,酸性環境可使養殖動物血液的pH下降,載氧能力下降,致使養殖動物缺氧死亡[29-30]。不過,在本研究中,向模擬廢水、養殖廢水中添加枯草芽孢桿菌HAINUP40可降低水體的pH,但pH最低依然在6.9以上,并且在24 h后會有一個升高的趨勢,可見枯草芽孢桿菌HAINUP40在短期內會造成pH的下降,但對水體的pH總體影響不大。
綜上所述,枯草芽孢桿菌HAINUP40可有效降低水體中的氨氮、亞硝酸鹽氮質量濃度和化學需氧量。另外,由于該菌對羅非魚源致病性無乳鏈球菌拮抗作用,通過拌料投喂可提高尼羅羅非魚的非特異性免疫力和抵抗無乳鏈球菌感染能力[12]。因此,在羅非魚養殖生產中,枯草芽孢桿菌HAINUP40不僅可以作為水質改良劑改善水體環境,還可作為飼料添加劑提高羅非魚的疾病抵抗力,預防無乳鏈球菌疾病的發生。
[1] AdesiJi Y O,Deekshit V K,Karunasagar I.Antimicrobial-resistant genes associated withSalmonellaspp.isolated from human,poultry,and seafood sources[J].Food Science & Nutrition,2014,2(4):436.
[2] Crab R,Defoirdt T,Bossier P,et al.Biofloc technology in aquaculture: beneficial effects and future challenges[J].Aquaculture,2012,356(4):351-356.
[3] 李卓佳,郭志勛,馮娟,等.應用芽孢桿菌調控蝦池微生態的初步研究[J].海洋科學,2006,30(11):28-31.
[4] 宋協法,潘玉蘭,馬真.主要微生態菌在水質凈化技術中的研究進展[J].漁業現代化,2014,41(3):36-42.
[5] Vezzulli L,Pruzzo C,Fabiano M.Response of the bacterial community to in situ bioremediation of organic rich sediments[J].Marine Pollution Bulletin,2004,49(9):740-751.
[6] Owens J D,Allagheny N,Kipping G,et al.Formation of volatile compounds duringBacillussubtilisfermentation of soya beans[J].Journal of the Science of Food and Agriculture,1997,74(1):132-140.
[7] Geraylou Z,Souffreau C,Rurangwa E,et al.Effects of dietary arabinoxylan-oligosaccharides (AXOS) and endogenous probiotics on the growth performance,non-specific immunity and gut microbiota of juvenile Siberian sturgeon (Acipenserbaerii)[J].Fish Shellfish Immunology,2013,35(3):766-775.
[8] 暴增海,孔德平,王增池,等.抗弧菌海洋細菌的分離篩選及其抗菌作用測定[J].水產科學,2009,28(1):24-27.
[9] 夏振強,暴增海,周超,等.抗真菌海洋細菌L1-9菌株的幾種胞外酶活性測定[J].河南農業科學,2009,38(7):74-77.
[10] 暴增海,馬桂珍,王淑芳,等.海洋細菌L1-9菌株在日本囊對蝦養殖池中的定殖及其抑菌和水質凈化作用[J].水產科學,2013,32(11):668-672.
[11] 趙光軍,周永燦,楊慧,等.羅非魚無乳鏈球菌拮抗菌的分離、鑒定及多樣性分析[J].熱帶生物學報,2014,5(4):312-319.
[12] Liu H T,Wang S F,Cai Y,et al.Dietary administration ofBacillussubtilisHAINUP40 enhances growth,digestive enzyme activities,innate immune responses and disease resistance of tilapia,Oreochromisniloticus[J].Fish and Shellfish Immunology,2017(60):326-333.
[13] 王娟,戴習林,宋增福,等.一株氨化細菌的分離、鑒定及氨氮降解能力的初步分析[J].水生生物學報,2010,34(6):1198-1201.
[14] 張峰峰,謝鳳行,趙玉潔,等.枯草芽孢桿菌水質凈化作用的研究[J].華北農學報,2009,24(4):218-221.
[15] Feng Y J,Li C,Zhang D W.Lipid production ofChlorellavulgariscultured in artificial wastewater medium[J].Bioresource Technology,2011,102(1):101-105.
[16] 湯保貴,徐中文,張金燕,等.枯草芽孢桿菌的培養條件及對水質的凈化作用[J].淡水漁業,2007,37(3):45-48.
[17] 陳國華.水產養殖學專業基礎課程實驗[M].北京:海洋出版社,2012:233-237,239-241,255-257.
[18] 楊世平,邱德全.水產養殖水體水質污染及水質處理微生物制劑的研究和應用現狀[J].中國水產,2004(7):81-82.
[19] 周強,崔正國,王加鵬,等.海水人工濕地脫氮效果與系統內基質酶、微生物分析[J].漁業科學進展,2015,36(1):10-17.
[20] 張慶華,封永輝,王娟,等.地衣芽孢桿菌對養殖水體氨氮、殘餌降解特性研究[J].水生生物學報,2011,35(3):498-503.
[21] 沈南南,李純厚,賈曉平,等.小球藻與芽孢桿菌對對蝦養殖水質凈化作用的研究[J].漁業科學進展, 2008,29(2):48-52.
[22] 李存玉,柳學周,徐永江,等.兩株有益菌的分離、培養、鑒定及其水質凈化效果評價[J].漁業科學進展,2017,38(1):1-8.
[23] 陳愛玲,李秋芬,張立通,等.添加營養物質提高商品水質凈化菌劑凈化能力的研究[J].水產學報,2010,34(4):581-588.
[24] 馬建新,劉愛英,宋愛芹.對蝦病毒病與化學耗氧量相關關系研究[J].海洋科學,2002,26(3):68-71.
[25] Saeed Z N,Mehran H R,Ghobad A T,et al.The effect ofBacillussp.bacteria used as probiotics on digestive enzyme activity,survival and growth in the Indian white shrimpFenneropenaeusindicus[J].Aquaculture,2006,252(2/4):516-524.
[26] 胡詠梅,葛向陽,梁運祥.枯草芽孢桿菌FY99-01菌株的凈水作用[J].華中農業大學學報:自然科學版,2006,25(4):404-407.
[27] 孟睿,何連生,席北斗,等.芽孢桿菌與硝化細菌凈化水產養殖廢水的試驗研究[J].環境科學與技術,2009,32(11):28-31.
[28] 遲明磊,闞光鋒,史翠娟,等.一株南極細菌(Pseudoalteromonassp.)對模擬海水養殖水體的凈化作用[J].極地研究,2010,22(3):313-320.
[29] 宋振鑫,陳超,吳雷明,等.鹽度與pH對云紋石斑魚胚胎發育和仔魚活力的影響[J].漁業科學進展,2013,34(6):52-58.
[30] 張甫英,李辛夫.酸性水對幾種主要淡水魚類的影響[J].水生生物學報,1997,21(1):40-48.

