外加CO2對鹽藻生長及碳酸酐酶活性的影響
穆富香,楊代宇,白飛妮,汪 瑩,楊海波,于 媛,詹世平
(大連大學 環境與化學工程學院,遼寧 大連 116622)
溫室效應是21世紀人類面臨的最嚴峻的環境危機之一,人類燃燒化石燃料所產生的CO2是引起全球溫室效應的最主要物質[1]。目前,全球每年排放CO2超過2.5×1010t,中國已達6×109t,居世界第一位[2],因此,研究CO2的轉化和利用具有重要的現實意義。
鹽藻(Dunaliellasalina)光合作用強、生長速度快、適應范圍廣,細胞內不僅含有包括人體必需8種氨基酸在內的18種氨基酸,同時含有豐富的蛋白質、多糖以及較多的Ca、P、Zn等礦物質。在適當條件下,累積油脂可達細胞干質量的40%~50%,合成的β-胡蘿卜素可達細胞干質量的10%,因此,鹽藻不僅用作魚、蝦、貝等幼體的餌料,而且在食品、醫療保健、液體燃料、環境保護等領域具有重要的應用價值[3-4]。
1 材料與方法
1.1 藻種來源
試驗所用鹽藻藻種為大連大學環境與化學工程學院海洋微藻課題組保存的藻種。
1.2 儀器和藥品
EL204電子天平[梅特勒—托利多儀器(上海)有限公司],80-2離心沉淀機(上海榮泰生化工程有限公司),LD5-2A臺式離心機(北京醫用離心機廠),UV-5200型紫外可見分光光度計(上海元析儀器有限公司),HH-S恒溫水浴鍋(江蘇金壇市醫療儀器廠),pHS-2C型精密酸度計(上海精密科學儀器有限公司),WY100Y手持式鹽度計[麥科儀(北京)科技有限公司]等;無水乙醇(天津市科密歐化學試劑有限公司),巴比妥(上海篤瑪生物科技有限公司),巴比妥鈉(上海篤瑪生物科技有限公司),均為分析純。
1.3 試驗方法
1.3.1 微藻培養及CO2通入
取5 L錐形瓶,分別加入2700 mL滅菌海水(加入氯化鈉調節鹽度為65,pH 8.10)和900 mL處在對數生長期的鹽藻藻液(A650nm=0.106),按1‰的比例加入2.7 mL的康維方營養液[8]。在25 ℃、1800 lx、光暗比為12∶12的條件下培養鹽藻。每天光照階段開始和光照階段結束時各搖瓶1次。
根據亨利定律,25 ℃時CO2在純水中的溶解度為1.24×10-5mol/L,pH 5.67[9]。為研究海水中CO2溶解度最大時鹽藻生長及碳酸酐酶活性變化趨勢,以此為依據每天在光照階段開始前向鹽藻培養體系中通入CO2至pH恒定不變(測得此時pH 6.00,表明CO2飽和)。
試驗開始時,每天在光照階段開始前向鹽藻培養液中通入CO2至pH 6.00,開始12 h光照,再繼續12 h黑暗,直至培養結束。以未加CO2的滅菌海水中接種的鹽藻培養液為對照。每組試驗培養3個平行樣。
1.3.2 測定指標
為探究鹽藻對CO2的利用程度及其對鹽藻生長和碳酸酐酶活性的影響,每天分別在光照階段結束時取樣測定培養液pH、吸光度、鹽藻細胞葉綠素含量和碳酸酐酶活性;在黑暗階段結束時取樣測定pH和吸光度。
pH測定:每次取培養藻液30 mL,用pHS-2C型精密酸度計測定pH值。平行3次。
生物量測定:試驗開始前,先用UV-5200型紫外可見分光光度計進行全波長掃描,確定鹽藻培養液的最大吸收波長為650 nm。試驗過程中,每次取培養藻液10 mL,于650 nm波長測定藻液的吸光值,以間接反映鹽藻細胞的生長。平行測定3次。
葉綠素含量的測定:參照文獻[10]的方法,每日取光照階段結束時的鹽藻培養液500 mL,3000 r/min離心3 min,棄上清液,收集藻泥,分成3份,1份用于測定葉綠素,另外2份用于測定細胞內、外的碳酸酐酶活性。將用于測定葉綠素的藻泥用去離子水清洗3次后按質量平均分成3份,用85%的乙醇提取葉綠素,并測定提取液在波長649 nm和665 nm處的吸光度值。按照公式(1)、(2)分別計算待測液中葉綠素a和葉綠素b的質量濃度,按照公式(3)計算鹽藻細胞內的葉綠素含量。
Ca=13.95A665-6.88A649
(1)
Cb=24.96A649-7.32A665
(2)
式中,Ca、Cb分別為待測液中葉綠素a、葉綠素b的質量濃度(mg/L),A649、A665分別為649 nm、665 nm處的吸光度值。
葉綠素含量(濕質量)/mg·g-1=CV/m
(3)
式中,C為葉綠素質量濃度(mg/L),V為藻液體積(L),m為藻泥濕質量(g)。
細胞內外碳酸酐酶活性的測定:參照文獻[11]測定碳酸酐酶活性。取上述操作中獲得的另外2份藻泥,首先將其中的1份按質量平均分成3份,立即懸浮于pH為8.30的12 mL巴比妥—巴比妥鈉緩沖溶液中,再加入6 mL在4 ℃冷藏的CO2飽和蒸餾水,用pH計測量反應體系中pH的變化,記錄pH從8.30降至7.30時所用的時間,測定細胞外碳酸酐酶活性。將另外一份藻泥凍融3次破碎細胞后,再按質量平均分成3份,重復胞外碳酸酐酶測定過程,用于測定細胞總的碳酸酐酶活性。按照下式計算碳酸酐酶比活性。
碳酸酐酶比活性(濕質量)/EU·g-1=10×(t0/t1-1)/m
(4)
式中,t0為反應體系未加藻泥時pH下降所用的時間(min),t1是反應體系中加入藻泥后pH下降所用的時間(min),m為藻泥濕質量(g)。
細胞內碳酸酐酶比活性(濕質量)/EU·g-1=細胞總碳酸酐酶比活性-細胞外碳酸酐酶比活性
(5)
1.4 數據統計與方法
試驗數據用Excel統計、處理,結果以平均值±標準差表示。在采用SPSS 18.0軟件進行單因素方差分析的基礎上進行Duncan多重比較,顯著水平為P<0.05。
2 結果與分析
2.1 外加CO2對鹽藻培養體系pH的影響
按照1.3.1,在滅菌海水中接種處于對數生長期的鹽藻藻液(A650 nm=0.106),分別測定光照階段結束和黑暗階段結束時培養液的pH,并與未通入CO2的對照組比較,結果見表1。
由表1可見,未通入CO2的對照組鹽藻培養液,在整個培養過程中,光照階段結束時和黑暗階段結束時的pH均在8.10~8.20,說明鹽藻通過光合作用吸收的CO2和通過呼吸作用釋放的CO2基本處于平衡狀態。而每天光照階段開始前通入CO2至pH 6.00的鹽藻培養液,第1 d光照階段結束時的pH為6.26,隨著培養時間的延長,pH緩慢增大。培養3 d后,pH顯著增加(P<0.05),至培養結束時pH約7.04。黑暗階段結束時培養液的pH變化與光照階段結束時的pH變化趨勢基本一致,且同一天內黑暗階段結束時的pH比光照階段結束時的pH稍有增加。
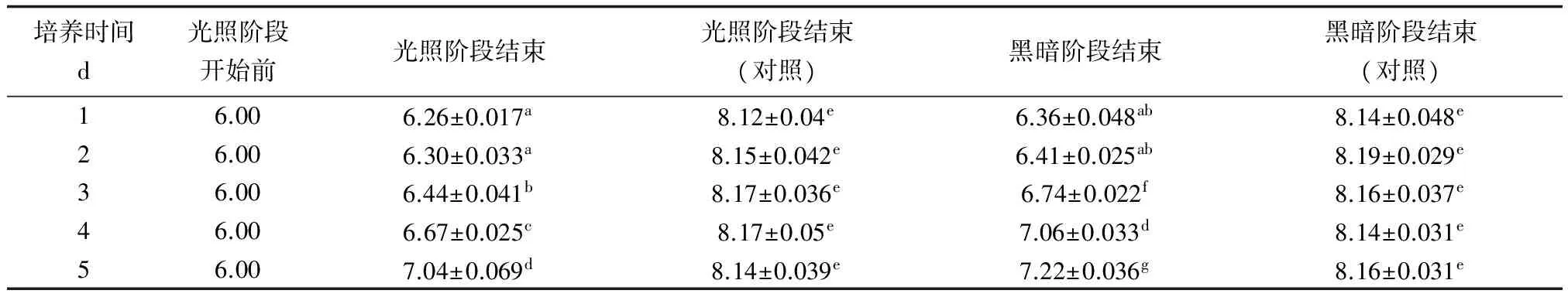
表1 外加CO2對鹽藻培養體系pH的影響(平均值±標準差)
注:各組數據之間,同一字母表示差異不顯著(P>0.05),不同字母間表示差異顯著(P<0.05).
光合作用包括光反應和暗反應兩個過程。前者是在葉綠素類囊體膜上高效吸收和傳遞光能,并將其轉化為生物能和還原勢能;后者是利用光反應轉化的生物能及還原勢能固定CO2,并產生碳水化合物[12]。光反應必須在光照條件下進行,暗反應是否有光均可進行。
在前3 d培養時間內,生物量增加少,光反應較弱,轉化的生物能和還原勢能少,導致暗反應對CO2的利用少,故培養液的pH上升得少。隨著培養時間的延長,鹽藻生物量逐漸增多,光反應增強,為暗反應提供了更多的生物能和還原勢能,使其對CO2的利用增強,進而pH增加明顯。
由于光合作用的限速步驟是暗反應過程的固碳反應,光反應過程通過快速反應獲得生物能和還原勢能,而暗反應過程通過相對的慢速反應固定CO2并釋放生物能。因此,在黑暗過程中CO2被繼續吸收和轉化,使培養液的pH繼續有所升高。
2.2 外加CO2對鹽藻生長的影響
碳是構成微藻細胞組分的重要元素,試驗中培養鹽藻所用的康維方營養液中不含有碳元素,鹽藻通過光合作用的暗反應過程利用外環境提供的CO2轉化為碳水化合物,促進生長繁殖。外加CO2至pH 6.00達到飽和時鹽藻培養液的吸光度值隨培養時間的變化趨勢見圖1。

圖1 外加CO2對鹽藻生長的影響
由圖1可見,在通入CO2培養的第1 d內,鹽藻細胞處于適應階段,吸光度基本沒有增加;2~5 d,培養液的吸光度基本上均呈直線上升,表明鹽藻細胞處于指數生長期。未通入CO2時,在培養的前2 d,鹽藻細胞處于適應階段,吸光度基本沒有增加,3~5 d,培養液的吸光度基本上均呈直線上升,鹽藻細胞處于指數生長期。培養至第6 d時,兩種體系的鹽藻培養液均進入穩定期,但通入CO2的吸光度值顯著高于未通入CO2的吸光度值。
培養1 d后,后一天光照階段結束時的吸光度值顯著高于前一天光照階段結束時的吸光度值,而同一天黑暗階段(比光照階段推遲12 h)結束時的吸光度值僅比光照階段結束時的吸光度值略有增加,表明鹽藻主要在光照階段通過光合作用的暗反應將CO2固定并轉化為細胞組分,促進細胞分裂和繁殖,增加生物量。這一變化過程與表1中光照階段結束和黑暗階段結束時的pH變化趨勢相一致。
2.3 外加CO2對鹽藻葉綠素含量的影響
葉綠素是光合作用的主要色素,在光合作用的光吸收中起核心作用,其含量高低一方面反映微藻光合作用能力的強弱,另一方面可以用來估算浮游植物的生物量[13]。鹽藻中主要含有葉綠素a和葉綠素b[10],試驗中測定其含量隨培養時間的變化,結果見圖2。
由圖2可見,隨培養時間延長,通入CO2和未通入CO2的培養體系中鹽藻細胞的葉綠素含量均逐漸增加,但通入CO2的鹽藻細胞中的葉綠素a和葉綠素b含量分別顯著高于未通入CO2的對照組的葉綠素a、b的含量。這與圖1中吸光度增加的趨勢一致。表明CO2的通入,能夠促進鹽藻細胞產生更多的葉綠素進行光合作用吸收轉化CO2,加快細胞生長。通入CO2體系和對照體系在同一培養時間時葉綠素a含量顯著大于葉綠素b含量。葉綠素a主要吸收紅光,而葉綠素b主要吸收藍紫光,說明鹽藻細胞更傾向于吸收紅光。
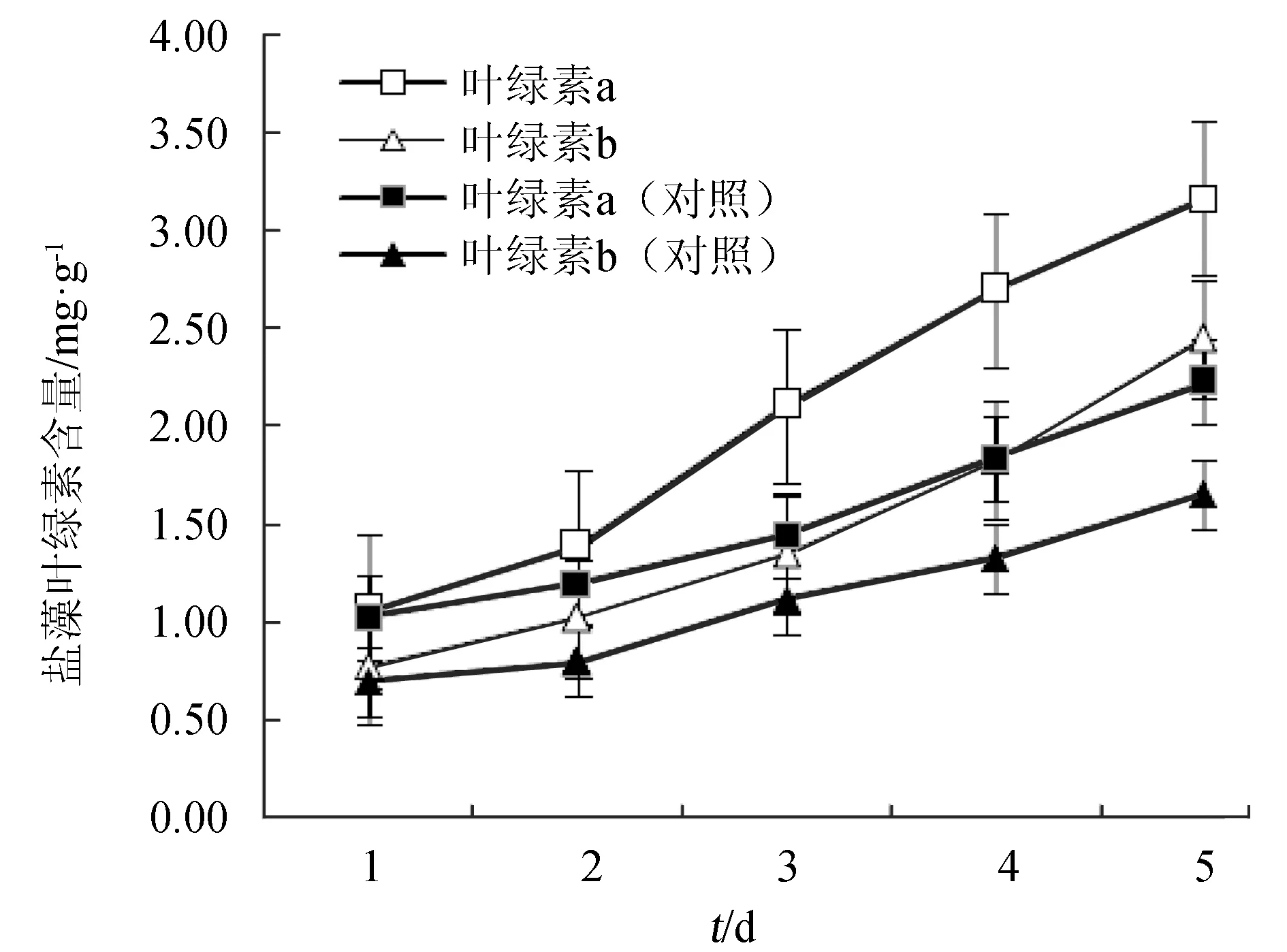
圖2 外加CO2對鹽藻葉綠素含量的影響
2.4 外加 CO2對鹽藻碳酸酐酶活性的影響
自然海域的海水中CO2濃度約為10 μmol/L[14],為了適應水中低CO2環境并保持較高的光合作用,藻類自身形成了提高CO2濃度的特有途徑,即藻類的CO2濃縮機制。碳酸酐酶是CO2濃縮機制的重要組成部分之一,在藻類光合作用中起著重要作用[15]。除對照組的胞內碳酸酐酶比活性在培養前3 d基本不變、之后顯著增加外,通入CO2體系的胞內、外碳酸酐酶比活性和對照組的胞外碳酸酐酶比活性均隨培養時間延長而逐漸增多;同一培養時間兩體系的胞外碳酸酐酶比活性分別高于各自的胞內碳酸酐酶比活性。此外,通入CO2的鹽藻培養液中,細胞內、外的碳酸酐酶比活性均顯著高于未通入CO2的對照組中相應的碳酸酐酶比活性(圖3)。
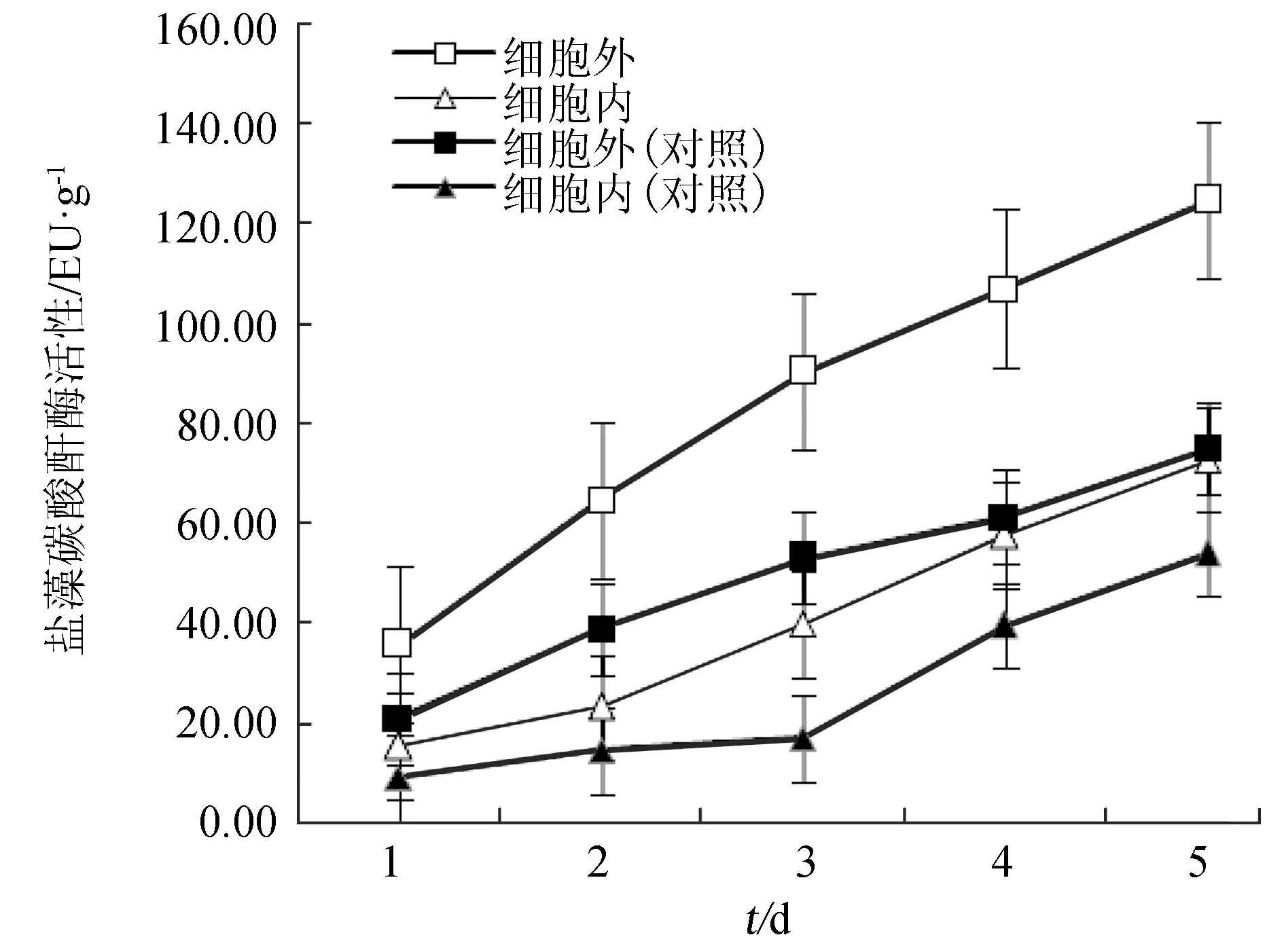
圖3 外加CO2對鹽藻碳酸酐酶的影響
由表1可知,未通入CO2的對照組鹽藻培養液的pH一直為8.10~8.20,而通入CO2的鹽藻培養液,在每天光照階段開始前通入CO2至溶液pH為6.00,光照階段結束時的pH隨著培養時間的延長,從第1 d的6.26逐漸上升至培養結束時的7.04。參考碳酸和HCO3-在水溶液中的分布系數計算公式(6)~(7)[16],計算鹽藻培養液pH在6.00、6.26、7.04、8.20時碳酸、HCO3-的分布系數,結果見表2。
(6)
(7)
式中,Ka1=4.5×10-7,Ka2=4.7×10-11。
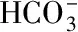
表2 不同pH時碳酸和的分布系數
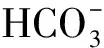
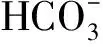
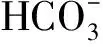
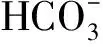
3 討 論
CO2是微藻光合自養的唯一碳源,但不同微藻所需的最適CO2含量不同,改變其含量會影響微藻生長和細胞組分的變化[17]。De Morais等[18]發現,凱氏小球藻(Chlorellakessleri)、斜生柵藻(Scenedesmusobliquus)、螺旋藻屬(Spirulina)和普通小球藻(C.vulgaris)4種微藻均在CO2含量為6%時生長最好;Tang等[19]的研究表明,斜生柵藻在10%的CO2含量下生長最好。范金鳳等[20]研究結果顯示,二形柵藻(S.dimorphus)可在10%~20%的CO2含量下生長,且CO2含量為10%時二形柵藻生長最好,此時pH為6.0~7.0。本試驗中外加CO2至飽和時,鹽藻培養液的pH由最初的6.0升至培養結束7.0,與范金鳳等[20]通入10% CO2的培養液的pH范圍一致,所得結果也一致,表明鹽藻能夠利用的CO2含量約為10%。
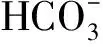
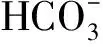
火電廠煙道氣中的CO2一般為10%~20%[28],因此在鹽藻培養液中通入CO2至飽和,不僅可轉化吸收煙道氣中的CO2,為降低大氣中CO2的含量探究有效的利用途徑,而且能提高鹽藻生長速率,進而產生更多的生物量用在水產餌料、醫療保健、食品添加劑、精細化工品和液體燃料等領域。因此,利用鹽藻轉化吸收CO2無論從環境保護還是資源利用角度均有重要應用價值。
[1] 楊改.微藻固定實際煙道氣中CO2的研究[D].武漢:武漢科技大學,2011:1-4.
[2] Joe J G O,Greet J M,Jeroen A H W P.Trends in global CO2emissions[R].The Hague/Bilthoven: PBL Netherlands Environment Assessment Agency,2012.
[3] 楊曉玲,郭金耀,王志龍.VB6對鹽藻色素形成、細胞生長和蛋白積累的影響[J].水產科學,2013,32(3):171-174.
[4] Kao C Y,Chiu S Y,Huang T T,et al.A mutant strain of microalgaChlorellasp.for the carbon dioxide capture from biogas[J].Biomass and Bioenergy,2012,36(328):132-140.
[5] Tsuzuki M,Miyachi S.The function of carbonic anhydrase in aquatic photosynthesis[J].Aquatic Botany,1989,34(1):85-104.
[6] 曾曉鵬,夏建榮.光強對兩種硅藻光合作用、碳酸酐酶和RubisCO活性的影響[J].水生生物學報,2015,39(2):368-374.
[7] Colman B,Huertas I E,Bhatti S,et al.The diversity of inorganic carbon acquisition mechanisms in eukaryotic microalgae[J].Functional Plant Biology,2002,29(2/3):261-270.
[8] 王友利.氮磷交互作用對兩種海洋微藻生長及細胞組分的影響[D].大連:大連大學,2015:13-14.
[9] 戴樹桂.環境化學[M].北京:高等教育出版社,2002:102-105.
[10] 楊代宇,穆富香,白飛妮,等.鹽藻中葉綠素的提取方法比較及條件優化[J].安徽農業科學,2016,44(25):7-9,20.
[11] Wilbur K M,Anderson N G.Electronic and colorimetric determination of carbonic anhydrase [J].Journal of Biological Chemistry,1948,176(1):147-154.
[12] 楊春虹.關于光合機器的合成生物學研究的幾點思考[J].生物產業技術,2012(4):20-22.
[13] 徐冉,侯和勝,佟少明.藻類葉綠素a/葉綠素b型捕光蛋白復合體結構與功能的研究進展[J].天津農業科學,2016,22(2):31-34.
[14] Badger M R,Price G D.The role of carbonic anhydrase in photosynthesis[J].Annual Review of Plant Biology,2003,45(1):369-392.
[15] Axelsson L,Ryberg H,Beer S.Two modes of bicarbonate utilization in the marine green macroalgaUlvalacturca[J].Plant Cell and Environment,1995,18(4): 439-445.
[16] 李發美.分析化學[M].7版.北京:人民衛生出版社,2014:39-42.
[17] Kumar A,Ergas S,Yuan X,et al.Enhanced CO2fixation and biofuel production via microalgae:recent developments and future directions[J].Trends Biotechnology,2010,28(7):371-380.
[18] De Morais M G,Costa J A.Carbon dioxide fixation byChlorellakessleri,C.vulgaris,ScenedesmusobliquusandSpirulinasp.cultivated in flasks and vertical tubular photobioreactors[J].Biotechnology Letters,2007,29(9):1349-1352.
[19] Tang D H,Han W,Li P L,et al.CO2biofixation and fatty acid composition ofScenedesmusobliquusandChlorellapyrenoidosain response to different CO2levels[J].Bioresource Technology,2011,102(3):3071-3076.
[20] 范金鳳,張姍姍,于紅,等.CO2對產油微藻Scenedesmusdimorphus生長和產油特性的影響[J].太陽能學報,2013,34(6):1103-1108.
[21] Chiu S Y,Kao C Y,Tsai M T ,et al.Lipid accumulation and CO2utilization ofNannochloropsisoculatain response to CO2aeration[J].Bioresource Technology,2009,100(2):833-838.
[22] 孫新健,羅生軍,范曉蕾,等.產油藻株Scenedesmussp.胞外碳酸酐酶活性及光合作用活性的研究[J].可再生能源,2012,30(11):99-103.
[23] 陳雄文,高沖山.CO2濃度對中肋骨條藻的光合無機碳吸收和胞外碳酸酐酶活性的影響[J].科學通報,2003,8(21):2275-2279.
[24] 劉洪霞.環境因子對球等鞭金藻胞外碳酸酐酶活性的影響[D].煙臺:煙臺大學,2007:40.
[25] 夏建榮,黃瑾.氮、磷對小新月菱形藻無機碳利用與碳酸酐酶活性的影響[J].生態學報,2010,30(15):4085-4092.
[26] Martin C L,Tortell P D.Bicarbonate transport and extracellular carbonic anhydrase in marine diatoms[J].Physiologia Plantarum,2008,133(1):106-116.
[27] Nimer N A,Warren M,Merrett M J.The regulation of photosynthetic rate and activation of extracellular carbonic anhydrase under CO2-limiting conditions in the marine diatomSkeletonemacostatum[J].Plant Cell and Environment,1998,21(8):805-812.
[28] 劉玉環,阮榕生,孔慶學,等.利用市政廢水和火電廠煙道氣大規模培養高油微藻[J].生物加工過程,2008,6(3):29-33.

