CT脂肪定量與胃癌術后相關并發癥的關系
藍巧清, 龍莉玲, 史波, 黃福靈, 鄧可妹
胃癌是最常見的消化道惡性腫瘤之一,因腫瘤位置的特殊性,患者易發生營養不良,發生率高達40%[1]。在過去的研究中[2],營養被認為是胃癌患者重要的危險因素之一,尤其是營養不良的患者,手術風險和術后并發癥的發生率更高。有關營養狀態的評價,目前已有較多的評價工具,如體重指數、主觀全面評定、微型營養評估等,但國內外尚無統一的金標準,仍缺乏能夠對患者營養狀態與疾病結局相關性問題作出提示的指標或工具[3-4]。近年隨著人體組成概念的發展,人體組成分析逐漸成為營養監測的一個重要指標[5],在一定程度上反映機體的健康水平和營養狀態。人體不同的組成是機體形態和功能的物質基礎,目前在區域性人體脂肪組織定量上CT提供了"金標準"[6],但將腫瘤患者腹部脂肪進行CT定量,并與術后并發癥相關聯的報道較少。本研究主要采用CT在選擇的層面測量腹部脂肪面積,探討胃癌患者腹部脂肪面積與術后相關并發癥的關系,研究營養狀態對患者術后相關并發癥的影響。
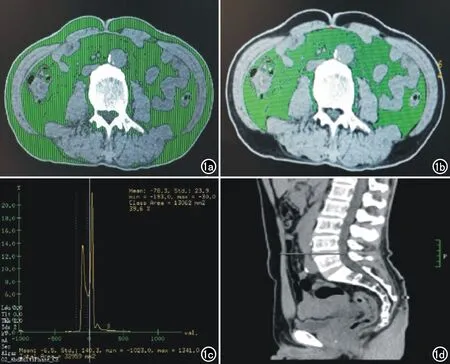
圖1 a) 綠色為TFA; b) 綠色為VAF; c) 脂肪衰減范圍調節曲線(-190~-30HU); d) L4/5 椎間隙中線或平肚臍水平定位像。
材料與方法
1.病例資料
搜集2011年9月-2015年5月在廣西醫科大學第一附屬醫院外科住院經病理證實為胃癌并行胃癌根治性手術的131例患者的病例資料,包括患者的性別、年齡、身高、體重、術前血紅蛋白、術前淋巴細胞、術前白蛋白、術前前白蛋白、手術方式、手術時間、腫瘤組織學類型、腫瘤直徑及TNM分期。其中,男106例,女25例,年齡25~88歲,中位年齡56歲。進行全胃切除32例,胃大部分切除99例。腫瘤分期:Ⅰ期9例,Ⅱ期16例,Ⅲ期94例,Ⅳ期12例。BMI<25的117例,BMI≥25的14例。根據營養風險篩查2002(nutritional risk screening 2002,NRS 2002)評分檢測胃癌患者的營養風險,非營養風險組63例,營養風險組68例。術后并發癥56例。
納入標準:①臨床資料完整,術前進行全腹CT檢查,根據身高、體重計算BMI;②術前未經抗腫瘤治療;③入院后行經腹胃癌根治術,術后經病理證實為胃癌;④無糖尿病、甲亢、甲狀腺功能減退、腎上腺皮質功能亢進、腎上腺皮質功能不全和其他代謝性疾病。排除標準:①晚期腫瘤,行姑息性手術者;②行腹腔鏡胃癌根治術者;③無法完成術前營養評價(NRS 2002評分)的患者。
2.方法與觀察指標
入院時,通過詢問病史、常規體格檢查、實驗室及輔助檢查等多種途徑,了解患者近期體重變化、營養攝入、影響營養的相關癥狀、活動及功能等情況,根據NRS 2002評分將患者進行營養風險分組。NRS 2002評分主要包括3個方面:①疾病嚴重程度評分(應激代謝):范圍0~3分,對于胃腸道腫瘤患者此項評分最低為1分;②營養狀態受損程度:范圍0~3分,主要根據體重指數、近期飲食和體重變化進行評分;③年齡因素:年齡≥70歲為1分。總分為三項評分之和,≥3分提示存在營養風險。
全部患者均于術前行全腹CT檢查,采用Siemens Somatom Definition Flash CT機。患者取仰臥位,掃描范圍從右側膈肌上緣至恥骨聯合下緣,進行連續掃描。掃描參數:管電壓120 kV,有效毫安秒190 mAs,螺距0.8,X線球管旋轉時間0.5 s/r,重建函數B20f smooth,重建層厚及層間距均為2 mm,矩陣512×512。
掃描結束將重建圖像傳至GE 64排螺旋CT的AW4.3后處理工作站,將圖像定位至L4/5椎間隙中線或平肚臍水平,啟動“X-Sect”模式,沿腹部皮膚輪廓畫出總的區域,再沿腹壁肌肉組織內緣畫出腹腔內的區域,調節脂肪衰減范圍(-190~-30 HU),著色部分即為脂肪區(圖1),再由計算機分別對相應脂肪區全部象素面積作定量計算,得出相應的數值,即腹部總體脂肪面積(total fat area,TFA)及內臟脂肪面積(vsceral fat area,VFA),TFA減去VFA即為腹部皮下脂肪面積(subcutaneous fat area,SFA)。
3.術后并發癥發生情況
患者術后出院前由研究人員記錄術后相關并發癥。常見的術后并發癥主要包括肺部感染、切口感染或裂開、腹腔感染、腸梗阻、腸吻合口漏、腸吻合口狹窄、術后出血或彌漫性血管內出血、泌尿系感染、心臟并發癥、臟器功能不全和死亡等。本文術后存在并發癥的56例患者中:肺部感染23例,切口感染或裂開7例,腸梗阻1例,術后出血12例,腸吻合口漏5例,臟器功能不全5例,腹腔感染3例。
4.統計學處理
采用SPSS 22.0統計軟件進行處理。正態分布的計量資料以均數±標準差表示,組間比較采用t檢驗,計數資料比較采用χ2檢驗,計量資料相關性采用Pearson相關性分析,多組樣本兩兩比較采用單因素方差分析或SNK檢驗;采用Logistic多因素回歸分析評估各變量對胃癌患者術后并發癥的影響。以P<0.05為差異有統計學意義。
結 果
1.一般資料和胃癌患者營養風險狀況的關系
非營養風險組和營養風險組中VFA、SFA及TFA差異具有統計學意義(P<0.05,表1),腹部脂肪含量越低者營養風險發生率越高。進一步進行相關性分析,NRS 2002評分與各指標均呈負相關,其中VFA、SFA及TFA與NRS 2002評分具有較高的相關性(表2)。
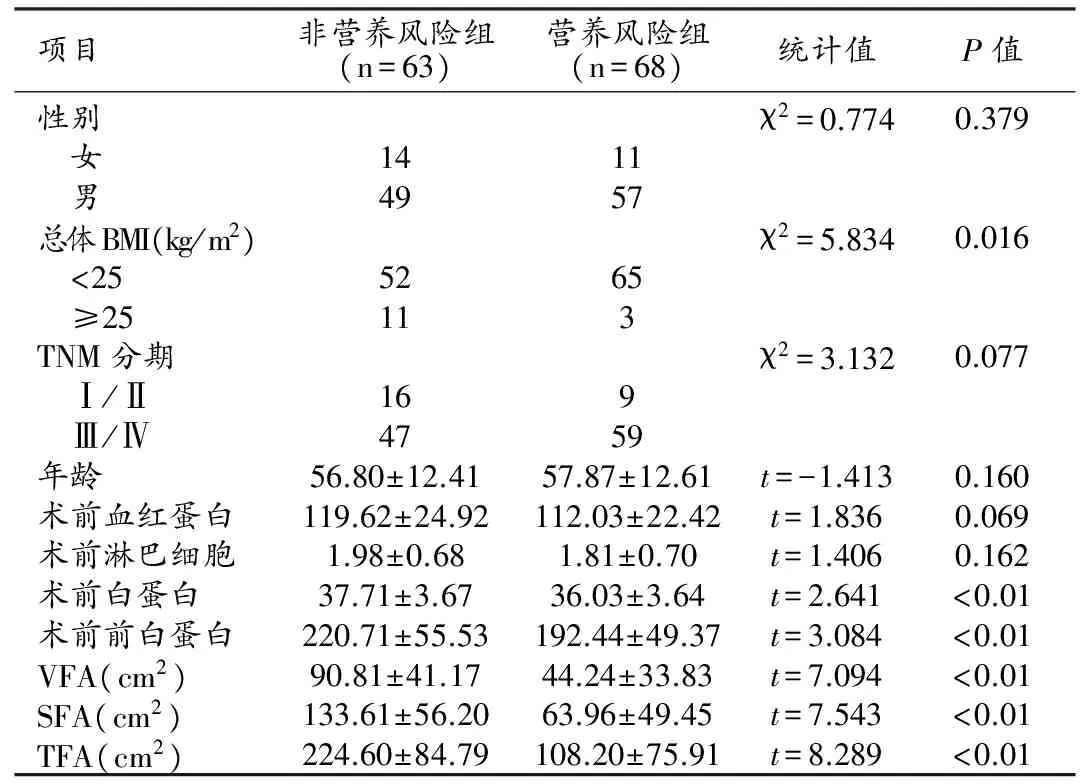
表1 一般臨床資料與患者營養風險狀態的單因素比較
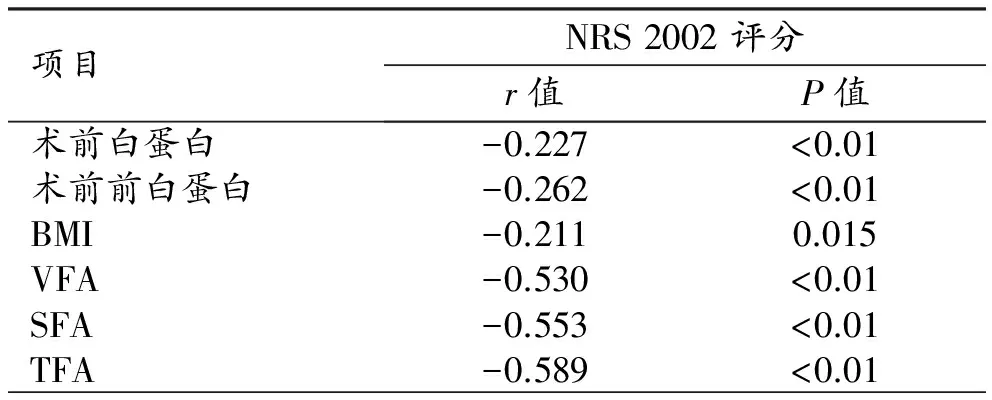
表2 NRS 2002評分與各變量的相關性分析
2.VFA、SFA及TFA之間的差異性
采用單因素方差分析兩兩比較SNK檢驗進行VFA、SFA及TFA三組數值間的兩兩比較。檢驗結果均為P<0.01,VFA、SFA及TFA數值間的兩兩比較差異具有統計學意義(表3)。

表3 胃癌患者腹部不同脂肪面積的兩兩比較
3.胃癌根治術術后并發癥的影響因素
根據并發癥的有無將患者分為有并發癥和無并發癥兩組,單因素分析結果表明,VFA、SFA及TFA在兩組間差異具有統計學意義(P<0.05,表4),腹部脂肪含量越低者術后并發癥發生率越高。進一步行Logistic多因素回歸分析,結果顯示:TFA與術后并發癥密切相關,TFA及術前前白蛋白均為胃癌術后并發癥的獨立危險因素(表5)。
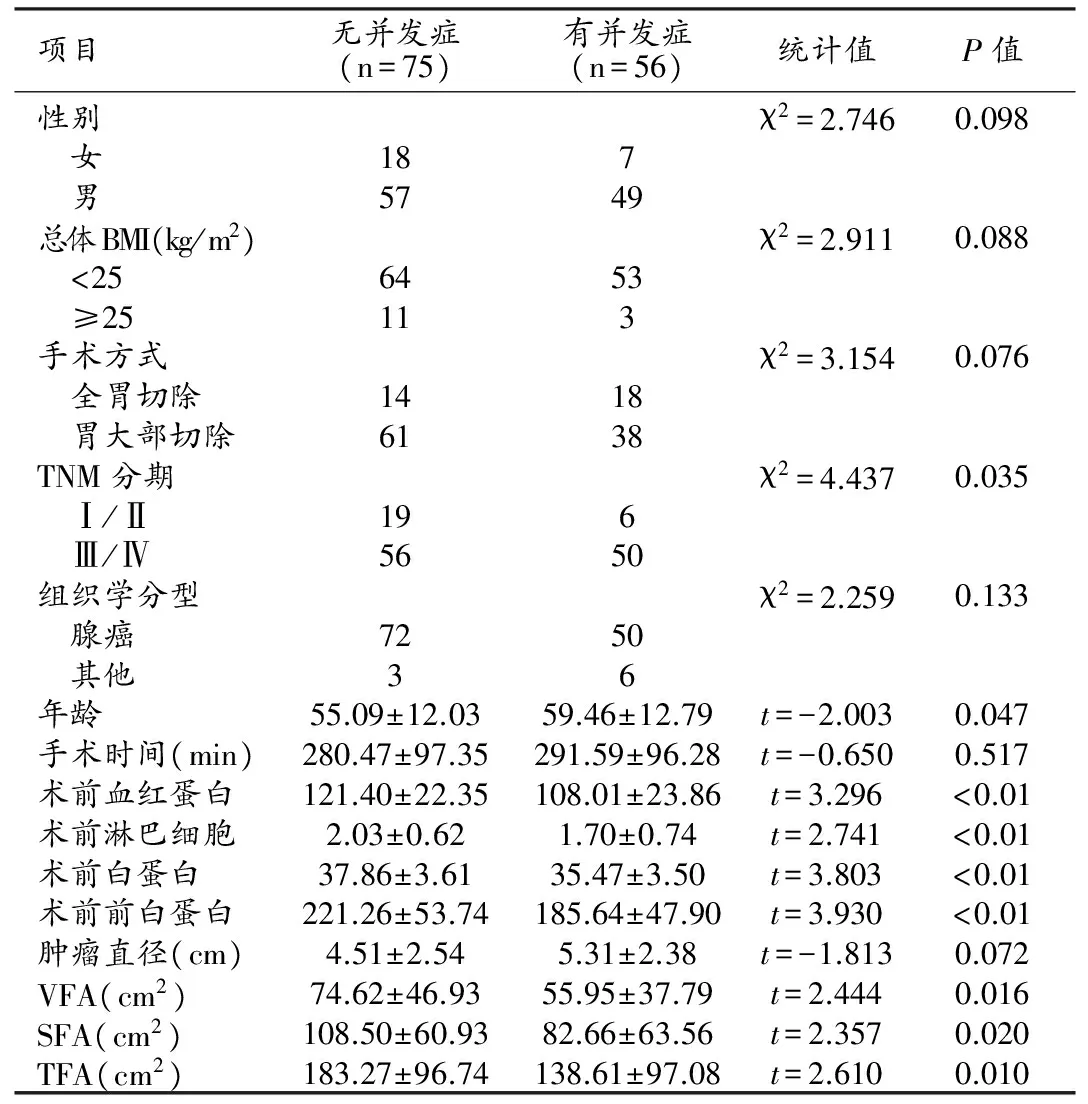
表4 一般臨床資料與患者術后并發癥的單因素比較
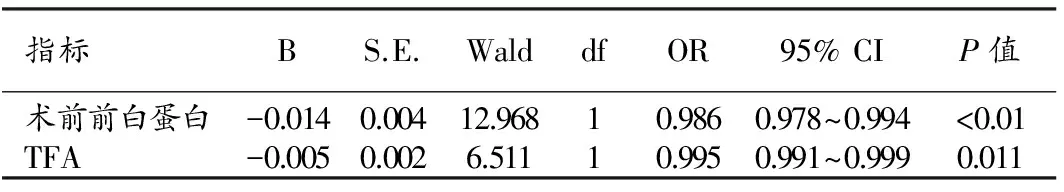
表5 胃癌根治術后并發癥影響因素的Logistic多因素回歸分析
討 論
胃癌是常見的消化道惡性腫瘤,患者因胃腸道受損,營養不良發生率高于其他腫瘤。研究發現[7],胃癌患者圍手術期存在的營養風險,可導致患者手術耐受力降低,術后并發癥的發生率增加。早期的營養風險篩查,對改善胃癌患者術后并發癥的發生有重大意義。
有關營養狀態的監測,目前有多個工具可供選擇[8-10],如營養風險篩查2002(NRS 2002)、營養不良篩查工具(malnutrition screening tool,MST)、患者主觀整體評估(patient-generated subjective global assessment,PG-SGA)等。有研究報道[10]NRS 2002、PG-SGA可作為近似金標準的評價工具,但這些工具條目較多,臨床使用時較為繁瑣,額外增加了工作量。近年隨著人體組成概念的發展,人體組成逐漸成為營養監測的重要指標。吳國豪等[11]研究發現,腫瘤患者脂肪代謝的變化在腫瘤發生的早期即已存在,手術創傷應激進一步加速體內脂肪的分解和氧化。周巖冰等[12]研究表明胃癌患者人體組成變化顯著,營養不良者脂肪、瘦體組織減少更加嚴重。翟澤民等[13]研究顯示,營養不良的患者體脂肪量、體脂百分率較其他指標下降更明顯。本研究主要以人體組成中的脂肪組織作為變量進行相關研究。
測量人體脂肪的方法有多種[14-18],如生物電阻抗法、雙能X線吸收測定法、CT與MRI等。1982年Borkan等[15]報告了第一份CT測量人體腹部脂肪組織含量及分布的材料,表明以臍水平進行單次掃描及后處理可估計全腹脂肪分布。Rossner等[17]通過相關研究進一步證實CT法測量脂肪組織是相當準確的。該方法被公認為區域性人體脂肪組織定量測定的金標準[6]。隨著CT圖像后處理技術的發展,CT在胃癌診斷上的應用也日益增多,值得在臨床上被廣泛推廣應用[19]。本研究結果顯示,營養風險組VFA、SFA、TFA數值均低于非營養風險組,與翟澤民等[13]研究結果相似,說明營養不良更易導致人體脂肪組織的丟失。相關性分析顯示NRS 2002評分與各指標呈負相關,說明人體脂肪含量越低,NRS 2002評分越高,患者營養狀況越差。其中VFA、SFA、TFA與NRS 2002評分均具有較高的相關性,表明NRS 2002評分越高,腹部脂肪含量下降越明顯。
國內外多項研究表明[20-22],胃癌術后并發癥與多個因素有關,如年齡、腫瘤大小、營養不良、白蛋白等,但研究人體脂肪含量與術后并發癥關系的文獻較少。王天寶等[20]研究表明營養不良患者手術風險及術后并發癥明顯增加。Kim等[21]研究表明體重過輕為術后肺部并發癥的獨立危險因素。本研究結果顯示胃癌脂肪含量越低者術后并發癥發生率越高,提示體重下降明顯、脂肪組織含量過少的胃癌患者,營養狀況越差,圍手術期越容易存在營養風險,導致患者手術耐受能力降低,術后并發癥發生率增高,與前人研究結果相似。而Takeuchi等[22]研究卻顯示VFA含量越高胃癌術后吻合口漏及切口感染并發癥的發生率越高,其原因在于此研究主要著眼于一些肥胖患者,過度的內臟脂肪堆積導致手術復雜度增大、術區吻合存在困難,同時合并代謝性疾病(如糖尿病等)的患者,體內代謝作用也可導致內臟脂肪堆積及術后感染的發生率增加。本研究結果顯示TFA為胃癌術后并發癥的獨立危險因素,TFA越低術后并發癥發生率越高,與Takeuchi等研究結果不相符,原因在于本研究排除了合并代謝性疾病的胃癌患者,主要關注患者的營養狀況,由于腫瘤本身引起的高代謝及組織分解,患者體重普遍降低,總體脂肪組織消耗,手術創傷引起的應激反應,進一步降低總體脂肪組織含量,營養風險及營養不良發生率高,導致術后并發癥發生率增加。通過VFA、SFA及TFA兩兩間的差異性分析顯示,差異具有統計學意義(P<0.01)。說明VFA、SFA與TFA對患者的影響不同,在疾病的發展過程中,三者的比例也存在差異,這可能與VFA和SFA的分布不同及具有不同的細胞成分、代謝特征等有關[23],但具體機制尚未完全闡明,尚需進一步研究。總的來說,從營養方面考慮,TFA對預測術后并發癥的發生具有參考價值。
綜上所述,采用CT人體脂肪測量法,具有密度分辨力高、定位、定量準確的優點,測量方法簡便。本研究所測得的TFA是一項簡單有效的指標,可作為營養監測指標的一種補充與應用。對于TFA值較低的患者,在術前給予必要的營養補充,不僅可以降低患者營養不良的發生率,而且可以減少術后并發癥的發生。因此,臨床上可以把TFA作為一個常規項目來記錄,用于患者的營養風險篩查,從而指導治療并將其作為影響術后并發癥發生率的因素之一。但本研究樣本量較少,存在一定的抽樣誤差,結合以往的研究結果,提示脂肪含量過多或過少均對術后并發癥產生影響,但本研究未能界定TFA的正常參考值范圍,值得進一步研究。
[1] 曾深,卞曉潔,葛衛紅.腸內營養支持在胃癌胃切除手術圍手術期的應用[J].藥學與臨床研究,2016,24(1):33-38.
[2] Choi WJ,Kim J.Nutritional care of gastric cancer patients with clinical outcomes and complications:a review[J].Clin Nutr Res,2016,5(2):65-78.
[3] Hamada Y.Objective data assessment (ODA) methods as nutritional assessment tools[J].J Med Invest,2015,62(3-4):119-122.
[4] 馬純雪,徐曉瓊,黃仁微,等.胃腸道腫瘤患者營養風險篩查特點及其對術后并發癥的影響[J].中華全科醫學,2014,12(12):1902-1904.
[5] 高淑清,謝琪,劉方芳,等.惡性腫瘤患者的人體成分變化[J].現代中西醫結合雜志,2011,20(35):4584-4586.
[6] Deurenberg P,Deurenberg-Yap M,Guricci S.Asians are different from caucasians and from each other in their body mass index/body fat per cent relationship[J].Obes Rev,2002,3(3):141-146.
[7] 苗長豐.胃癌根治術患者圍手術期營養狀況監測指標與手術并發癥的相關性研究[D].蘭州大學,2014.
[8] Jones JM.The methodology of nutritional screening and assessment tools[J].J Hum Nutr Diet,2002,15(1):59-71.
[9] 郭加友,方立儉,郭嘉漪.預后營養指數與胃癌術后臨床特征及預后關系[J].中國腫瘤臨床,2015,42(2):100-104.
[10] Bauer J,Capra S,Ferguson M.Use of the scored Patient-Generated Subjective Global Assessment (PG-SGA) as a nutrition assessment tool in patients with cancer[J].Eur J Clin Nutr,2002,56(8):779-85.
[11] 吳國豪.重視惡性腫瘤患者的營養不良及防治[J].中國腫瘤臨床,2014,41(18):1145-1149.
[12] 周巖冰,張彩坤,陳棟,等.胃癌病人人體組成的初步觀察[J].腸外與腸內營養,2007,14(5):286-289.
[13] 翟澤民,郭劍,張蓓蕾,等.消化道腫瘤患者術前PG-SGA評分與人體成分的相關性研究[J].腫瘤代謝與營養電子雜志,2016,3(2):114-117.
[14] Mazonakis M,Damilakis J.Computed tomography:what and how does it measure?[J].Eur J Radiol,2016,85(8):1499-1504.
[15] Borkan GA,Gerzof SG,Robbins AH,et al.Assessment of abdominal fat content by computed tomography[J].Am J Clin Nutr,1982,36(1):172-177.
[16] Braulio VB,Furtado VC,Silveira MD,et al.Comparison of body composition methods in overweight and obese Brazilian women[J].Arq Bras Endocrinol Metabol,2010,54(4):398-405.
[17] Deurenberg P,Deurenbergyap M,Guricci S.Asians are different from Caucasians and from each other in their body mass index/body fat per cent relationship.[J].Obes Rev,2002,3(3):141-146.
[18] 陸玉敏,黃仲奎,龍莉玲.人體脂肪含量及分布DEXA測量的可行性研究[J].實用放射學雜志,2007,23(1):70-74.
[19] 韋章誠,吳家星,夏玉梅,等.MSCT在胃癌病理分期及診斷中的應用價值[J].放射學實踐,2016,31(5):402-406.
[20] 王天寶,石漢平,麥碧珍,等.結直腸癌患者營養不良評估及其與術后并發癥的相關研究[J].中華腫瘤防治雜志,2012,19(14):1106-1108.
[21] Kim JM,Park JH,Jeong SH,et al.Relationship between low body mass index and morbidity after gastrectomy for gastric cancer[J].Ann Surg Treat Res,2016,90(4):207-212.
[22] Takeuchi M,Ishii K,Seki H,et al.Excessive visceral fat area as a risk factor for early postoperative complications of total gastrectomy for gastric cancer:a retrospective cohort study[J].BMC Surg,2016,16(1):54-60.
[23] 劉瓊,肖新華.皮下脂肪組織與內臟脂肪組織[J].國際病理科學與臨床雜志,2013,33(6):544-547.

