腦橋梗死不同病因機制的臨床研究
王紅霞,劉欣,王麗娟,劉熒,李小剛
腦橋梗死中約60%分布于旁正中區[1]。腦橋旁正中梗死是指由基底主干動脈分出的穿支動脈(即前內側腦橋動脈)發生閉塞而導致腦橋旁正中部位發生梗死,且梗死灶可達腦橋腹側表面[2]。急性期常有進展性加重,其病因、發病機制及預后與腦橋其他部位梗死不同。本研究比較不同類型腦橋梗死的臨床特征及影像學檢查,進一步探索其病因、發病機制及預后。
1 資料與方法
1.1 研究對象 收集2016年3月-2017年3月住院的急性腦橋梗死患者75例,其中男52例,女23例,平均年齡(64.32±9.31)歲。所有病例診斷符合《中國急性缺血性腦卒中診治指南2010》的標準[3]。納入標準:①突發神經功能缺損癥狀和體征,發病1周內入院;②行磁共振成像(magnetic resonance imaging,MRI)+磁共振血管造影(magnetic resonance angiography,MRA)/電子計算機斷層掃描血管成像(computed tomography angiography,CTA)檢查,MRI提示新發孤立性腦橋梗死;③完整臨床和輔助檢查資料。排除標準:①資料不完整;②椎動脈狹窄和其他原因導致的基底動脈主干狹窄,如動脈夾層、血管炎;③心源性栓塞、原因不明或其他原因腦梗死。
1.2 方法 入院后記錄患者一般資料,相關危險因素如高血壓、糖尿病、冠狀動脈粥樣硬化性心臟病、卒中史以及吸煙、飲酒,記錄入院血壓、空腹血糖、餐后2 h血糖、糖化血紅蛋白、總膽固醇、甘油三酯、低密度脂蛋白、纖維蛋白原、D-二聚體、同型半胱氨酸等檢查。記錄入院及出院時美國國立衛生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)評估神經功能缺損,出院時改良Rankin量表(modified Rankin Scale,mRS)評分。急性期神經功能缺損進展判定標準:患者神經功能缺損的嚴重度呈進行性加重,NIHSS評分增加≥2分[4]。出院時mRS評分≥3分判定短期預后不良。
1.3 影像學檢查 急性腦橋梗死根據不同的病理機制分為3種亞型[5]:①大動脈閉塞性:經顱多普勒超聲(transcranial Doppler,TCD)、數字減影血管造影(digital subtraction angiography,DSA)或MRA等檢查確定病灶相應部位的椎動脈或基底動脈狹窄>50%導致的腦橋梗死。②小動脈病變:腦橋梗死灶的直徑<1.5 cm,病灶未及腦橋腹側表面,不伴有大動脈狹窄或潛在心源性栓子。③基底動脈分支病變:腦橋的梗死灶到達腦橋腹側表面,不伴有大動脈狹窄或潛在心源性栓子。本研究根據基底動脈是否狹窄將患者分為基底動脈狹窄組(圖1)、基底動脈無狹窄組。根據梗死病灶部位基底動脈無狹窄組又分為基底動脈穿支病變組(圖2)及小動脈病變組(圖3)。患者發病1周內進行頭部MRI及MRA/CTA檢查,測量彌散加權成像(diffusion weighted imaging,DWI)上梗死灶的最大徑評估梗死灶大小[6]。應用MRA、CTA或DSA檢查評價顱內動脈粥樣硬化,判斷基底動脈主干及顱內其他血管狹窄程度。血管狹窄分為無狹窄、輕度狹窄(≤50%)、中重度狹窄(>50%)。應用頸動脈彩超評價顱外動脈粥樣硬化。所有影像學圖像均由2名神經科醫師進行盲法評估。
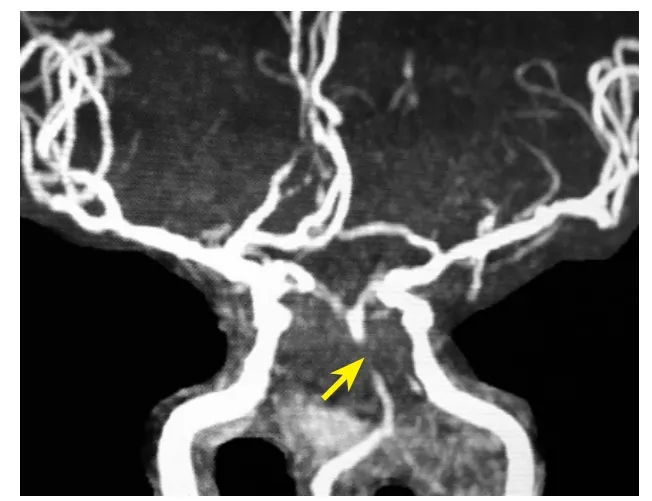
圖1 頭顱磁共振血管造影示基底動脈狹窄(箭頭所示)
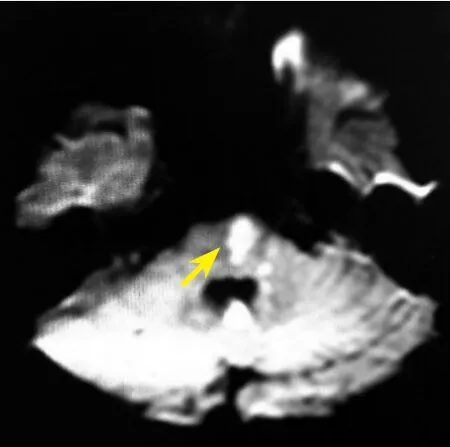
圖2 頭顱彌散加權成像示基底動脈穿支病變
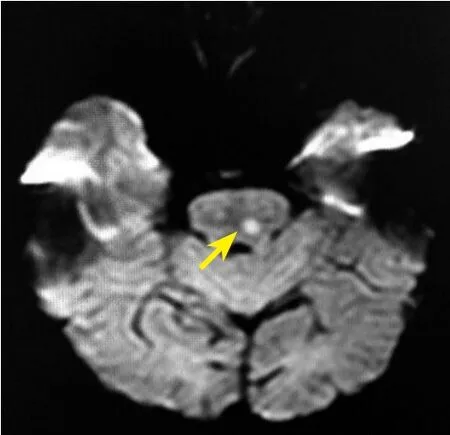
圖3 頭顱彌散加權成像示小動脈病變
1.4 統計學處理 使用SPSS 20.0軟件進行數據統計分析,計量資料若為正態分布統計描述采用()表示,比較采用t檢驗;計量資料若非正態分布統計描述采用中位數、四分位數,兩組比較采用秩和檢驗。計數資料以率(%)表示,比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 基底動脈無狹窄組及基底動脈狹窄組臨床特征及影像學改變比較 基底動脈狹窄組9例,狹窄發生率12%,基底動脈無狹窄組66例。基底動脈狹窄組在糖尿病、冠狀動脈粥樣硬化性心臟病、神經功能缺損進展發生率、入院NIHSS評分、出院NIHSS評分、出院mRS評分≥3比例均高于基底動脈無狹窄組,比較差異有統計學意義(P<0.05)。兩組在合并顱內其他血管狹窄及顱外段動脈粥樣硬化方面比較,差異無統計學意義;但血管狹窄程度比較,基底動脈狹窄組合并顱內其他血管狹窄均為中重度狹窄,而基底動脈無狹窄組合并顱內其他血管狹窄中僅31.6%為中重度狹窄,比較差異有統計學意義(P=0.043)(表1)。
2.2 基底動脈穿支病變組與小動脈病變組臨床特征及影像學比較 在66例基底動脈無狹窄組的腦橋梗死患者中,穿支病變組33例,小動脈病變組33例。穿支病變組入院NIHSS、出院NIHSS評分、神經功能缺損進展、出院mRS評分、空腹血糖、餐后2 h血糖、糖化血紅蛋白、入院收縮壓、梗死灶大小均高于小動脈病變組,兩組比較差異有統計學意義(P<0.05)。小動脈病變組吸煙、飲酒比例高于穿支病變組,比較差異有統計學意義(P<0.05)。兩組在合并顱內其他血管狹窄、顱外動脈粥樣硬化方面比較,差異無統計學意義(表2~3)。
3 討論
孤立單側腦橋梗死病因判斷標準如下[7]:①大動脈閉塞性病變:相關大動脈(椎動脈或基底動脈)存在≥50%狹窄或完全閉塞;②小血管病變:梗死病灶不累及腦橋表面,病灶最大徑<1.5 cm,同時具備腦血管病危險因素和排除大血管狹窄以及心臟源性栓子來源;③基底動脈分支病變:梗死累及腦橋表面,同時椎基底動脈不存在≥50%狹窄和無潛在的心源性栓子來源;④其他病因,如基底動脈夾層等;⑤病因不能確定,如同時存在大血管狹窄和潛在的心臟源性栓子來源,或單側腦橋內部梗死病灶最大徑≥1.5 cm而無大血管狹窄和心臟源性栓子來源等。本研究旨在于通過比較不同類型腦橋梗死患者的臨床特征及影像學改變,分析其病因、發病機制及評估預后。
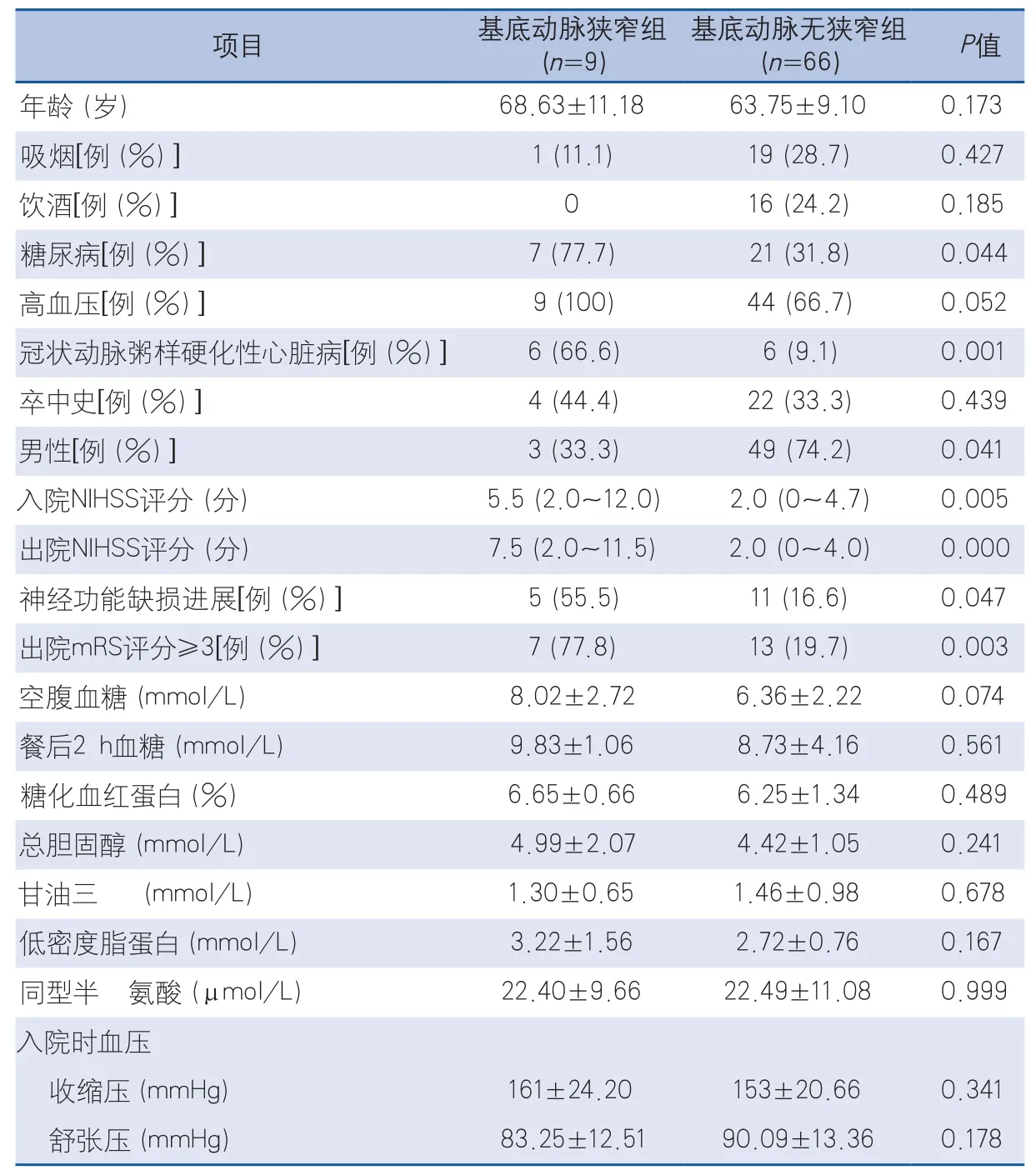
表1 基底動脈無狹窄組及基底動脈狹窄組臨床特征及影像學比較
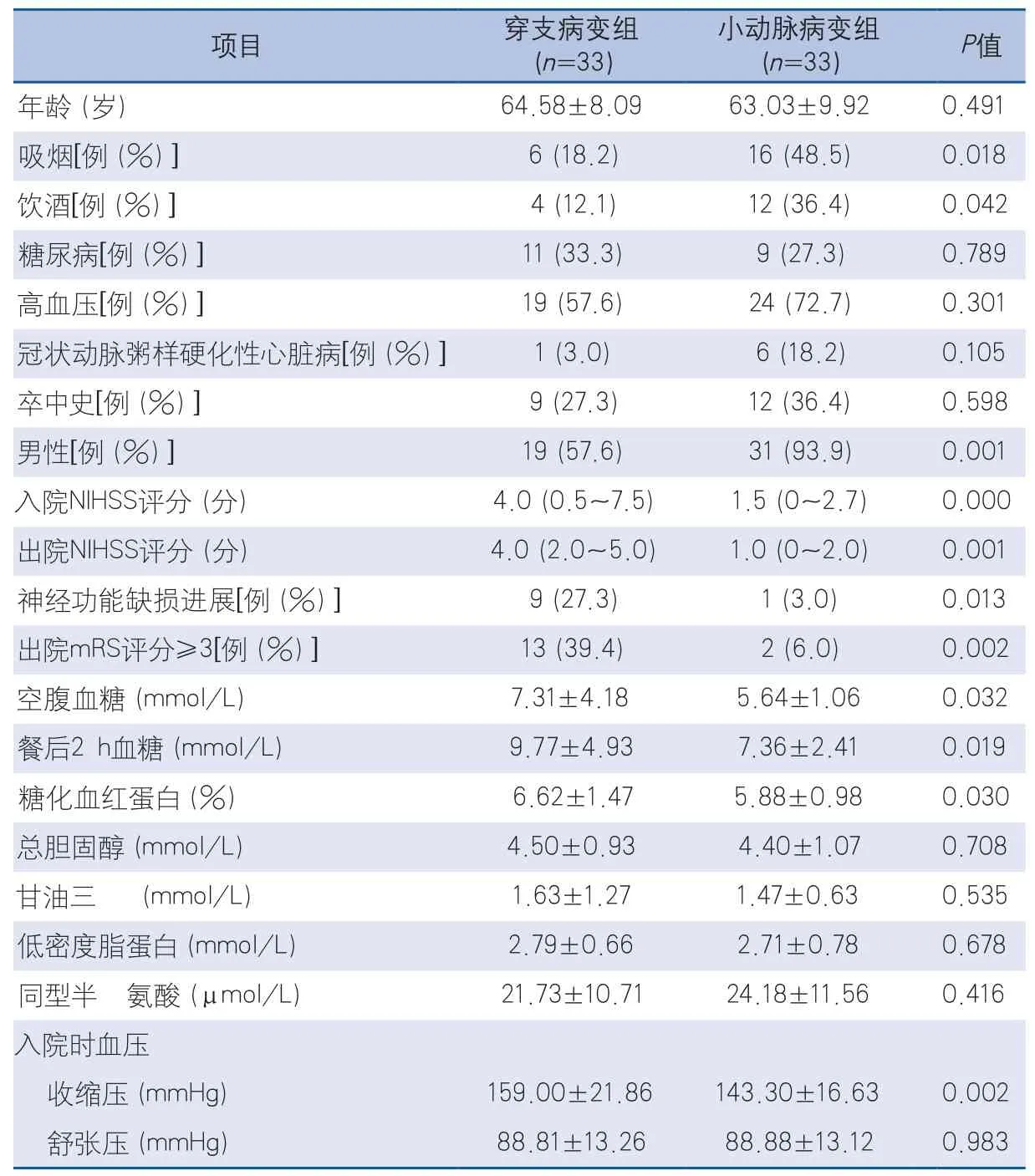
表2 基底動脈穿支病變組與小動脈病變組臨床特征比較
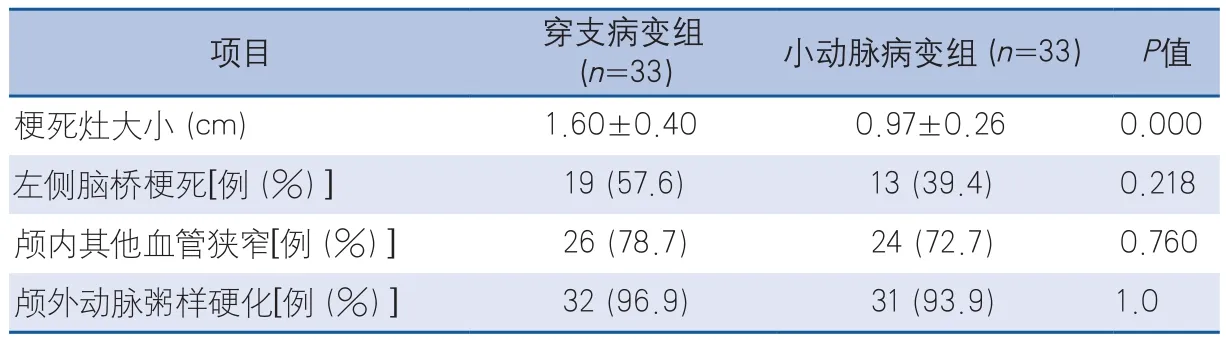
表3 穿支病變組與小動脈病變組影像學特征比較
Konstantinos Vemmos等[7]認為基底動脈穿支病是造成孤立性腦橋梗死最常見的機制,發生率約為43%;基底動脈小動脈病次之,約34%;而大動脈閉塞性疾病發生率約為21%。有研究應用TCD及MRA檢測到約20%的腦橋旁正中梗死患者存在不同程度的基底動脈狹窄[2]。本研究顯示孤立腦橋梗死患者中,僅12%患者檢出基底動脈狹窄,44%為基底動脈穿支病變,44%為小動脈病變,提示基底動脈穿支病變及小動脈病變是其主要病因,其次為大動脈閉塞性病變,與Isabelle Klein等[8]研究結果一致。本研究中基底動脈狹窄發生率為12%,低于Konstantinos Vemmos等[7]研究結果(21%),考慮與本研究中應用MRA或CTA評估基底動脈,各研究采用檢查方法不一致有關。
本研究結果顯示,基底動脈狹窄組入院NIHSS評分、出院NIHSS評分、出院mRS評分≥3分比例均高于基底動脈無狹窄組,55.5%基底動脈狹窄患者出現神經功能缺損進展。提示腦橋梗死合并基底動脈狹窄患者其神經功能缺損更嚴重,神經功能惡化進展發生率更高,短期預后不良。本研究結果顯示,基底動脈狹窄組糖尿病及冠狀動脈粥樣硬化性心臟病比例高于基底動脈正常組,合并顱內其他血管中重度狹窄比例高于基底動脈無狹窄組,提示其大動脈粥樣硬化程度更嚴重。
腦橋穿支動脈的血管病變在病理上以動脈粥樣硬化為主。Charles Miller Fisher等[9]曾在尸檢病理中證實存在穿支動脈起始部粥樣硬化病變。本研究結果顯示,基底動脈穿支病變組空腹血糖、餐后2 h血糖及糖化血紅蛋白水平均高于小動脈病變組,比較差異有統計學意義(P<0.05)。與前循環梗死比較,糖尿病患者更具有后循環梗死的風險[10]。Hiroo Ichikawa等[11]報道,高糖化血紅蛋白是基底動脈粥樣硬化的獨立危險因素。有學者對73例腦橋梗死患者行高分辨磁共振血管成像及頭MRA檢查,顯示在基底動脈主干未見明顯狹窄時,就可由基底動脈粥樣硬化斑塊堵塞基底動脈分支開口,引起腦橋旁正中梗死。小血管病變梗死灶多位于腦橋深部,主要由穿支動脈透明脂質樣變所致。
穿支動脈粥樣硬化患者更易發生早期神經功能惡化[12]。本研究結果顯示,基底動脈穿支病變組梗死灶大小、入院NIHSS評分、出院NIHSS評分、出院mRS評分≥3分比例均高于小動脈病變組,27.3%基底動脈穿支病變患者出現神經功能缺損進展,與小動脈病變組(3.0%)比較,差異具有統計學意義(P<0.05)。提示穿支動脈粥樣硬化病變與小動脈病變相比,病灶大,癥狀重,急性期多呈加重趨勢。錐體束由腦橋基底部穿過,內側丘系和脊髓丘腦束位于前內和前外側腦橋動脈供血區后部,由于穿支動脈病變組患者梗死灶均累及腦橋基底部,所以多數患者存在偏側癱瘓合并偏身感覺障礙,神經功能缺損更嚴重。進展性梗死可能是由于梗死灶水腫形成、穿支動脈口的粥樣斑塊進行性延伸或進行性血栓形成阻塞了鄰近數個小穿支動脈等所致[13]。也有部分研究提示與急性期收縮壓下降、穿支動脈遠端血流減少,所致的血流動力學障礙有關。
綜上所述,腦橋梗死存在不同的病因和發病機制,基底動脈穿支病變及小血管病變是其主要病因,其次為大動脈閉塞性病變。合并基底動脈狹窄的腦橋梗死及腦橋旁正中動脈梗死病變以動脈粥樣硬化為主,病灶大,癥狀重,易發生進展,預后不良。早期進行影像學檢查評估病灶及基底動脈,對積極采取抗動脈粥樣硬化治療起到臨床指導意義。本研究資料來源于單中心,為回顧性研究,病因分型主要依據MRI和MRA/CTA,難以對病變性質做出更準確的分析,尚需進一步大規模、多中心、前瞻性研究證實。
[1] FIELD T S,BENAVENTE O R. Penetrating artery territory pontine infarction[J]. Rev Neurol Dis,2011,8(1-2):30-38.
[2] ERRO M E,GáLLEGO J,HERRERA M,et al. Isolated pontine infarcts:etiopathogenic mechanisms[J]. Eur J Neurol,2005,12(12):984-988.
[3] 中華醫學會神經病學分會腦血管病學組急性缺血性腦卒中診治指南撰寫組. 中國急性缺血性腦卒中診治指南2010[J]. 中華神經科雜志,2010,(2):146-153.
[4] YAMAMOTO Y,OHARA T,HAMANAKA M,et al. Characteristics of intracranial branch atheromatous disease and its association with progressive motor de ficits[J]. J Neurol Sci,2011,304(1-2):78-82.
[5] 劉揚,高旭光. 腦橋梗死與基底動脈分支病[J]. 中華老年心腦血管病雜志,2009,11(1):77-78.
[6] NAKASE T,YOSHIOKA S,SASAKI M,et al.Clinical evaluation of lacunar infarction and branch atheromatous disease[J]. J Stroke Cerebrovasc Dis,2013,22(4):406-412.
[7] VEMMOS K N,SPENGOS K,TSIVGOULIS G,et al. Aetiopathogenesis and long-term outcome of isolated pontine infarcts[J]. J Neurol,2005,252(2):212-217.
[8] KLEIN I F,LAVALLéE P C,MAZIGHI M,et al.Basilar artery atherosclerotic plaques in paramedian and lacunar pontine infarctions:a high-resolution MRI study[J]. Stroke,2010,41(7):1405-1409.
[9] FISHER C M,CAPLAN L R. Basilar artery branch occlusion:a cause of pontine infarction[J].Neurology,1971,21(9):900-905.
[10] SUBRAMANIAN G,SILVA J,SILVER F L,et al. Risk factors for posterior compared to anterior ischemic stroke:an observational study of the Registry of the Canadian Stroke Network[J].Neuroepidemiology,2009,33(1):12-16.
[11] ICHIKAWA H,MUKAI M,TAKAHASHI N,et al. Dilative arterial remodeling of the brain with different effects on the anterior and posterior circulation:an MRI study[J]. J Neurol Sci,2009,287(1-2):236-240.
[12] JEONG H G,KIM B J,YANG M H,et al.Neuroimaging markers for early neurologic deterioration in single small subcortical infarction[J].Stroke,2015,46(3):687-691.
[13] KAPS M,KLOSTERMANN W,WESSEL K,et al.Basilar branch disease presenting with progressive pure motor stroke[J]. Acta Neurol Scand,1997,96(5):324-327.

