TACE聯合125I放射性粒子植入或三維適形放療對肝細胞癌伴門靜脈癌栓的療效比較
吳凡 鄭家平 邵國良 羅君
原發性肝細胞癌(HCC)為臨床常見腫瘤疾病。在我國,HCC病死率在消化系統惡性腫瘤中列第3位,每年約有10~12萬例患者死于HCC[1]。HCC發展迅速、起病隱匿,在患者明確診斷時,腫瘤往往發展到了中晚期,且HCC常伴門靜脈癌栓(PVTT)[2]。研究發現,PVTT與HCC肝內外轉移、復發及門靜脈高壓、肝功能衰竭均密切相關,如不予有效干預,HCC伴PVTT患者平均生存期僅2.7~4.0個月,預后很不理想[3]。近年來,臨床針對HCC伴PVTT提出多種非手術治療方法,包括放療、經皮肝動脈化療栓塞(TACE)、分子靶向治療等,其中TACE聯合放療是目前最常用的方法之一[4],而放療包括體內局部125I放射性粒子植入與體外三維適形放療(3DCRT)、伽瑪刀放療等。本研究旨在觀察并比較TACE治療前提下,125I放射性粒子植入與3DCRT對HCC伴PVTT的臨床療效,現報道如下。
1 對象和方法
1.1對象選取2013年7月至2015年7月浙江省腫瘤醫院收治的HCC伴PVTT患者65例,納入標準:(1)初次診斷者;(2)年齡18~75歲;(3)功能狀態評分0~1分;(4)肝功能Child-Pugh分級為A或B級;(5)獲得患者知情同意。排除標準:(1)合并其他器質性病變者;(2)門靜脈主干因PVTT引致的完全阻塞者,且不存在門靜脈側支循環建立或PVTT累及腸系膜上靜脈、脾靜脈;(3)肝功能Child-Pugh分級為C級;(4)PLT<60×109/L,PT>18s,血清白蛋白<28g/L;(5)病毒性肝炎活動期。其中32例(觀察組)采用TACE聯合125I放射性粒子植入治療,33例(對照組)采用TACE聯合3DCRT治療。所有患者均參照HCC診療規范(2015年版)[5]確診;根據PVTT的范圍分為3型[6],分別為A型(門靜脈主干PVTT)、B型(門靜脈一級分支PVTT)和C型(門靜脈二級及以下分支PVTT)。兩組患者性別、年齡、腫瘤大體分型、甲胎蛋白(AFP)水平、肝功能Child-Pugh分級、有無肝外轉移、PVTT分型等比較差異均無統計學意義(均P>0.05),具有可比性,見表1。

表1 兩組患者一般資料比較[例(%)]
1.2方法
1.2.1儀器(1)125I放射性粒子植入治療應用密封籽源125I放射性粒子,長4.5mm,直徑0.8mm,活度0.6 mCi,平均能量27~35KeV,穿透半徑1.7cm,半衰期為60.2 d。治療計劃系統(TPS)為天津賽德生物制藥公司生產的近距離放射治療三維TPS設備。引導系統為德國Siemens 16排螺旋CT。掃描條件為120kV,180mAs,層厚及層間隔均為5mm。(2)3DCRT定位系統:CT-sim掃描設備為Philips Brilliance 16排螺旋CT或GE Light Speed 4排螺旋CT,掃描條件為120kV,180mAs,層厚及層間隔均為3mm。放療設備:RayStation4.0V(RaySearch Laboratories AB)制定放療計劃;直線加速器為瑞典醫科達PRECISE全數字化直線加速器。
1.2.2治療兩組患者均先行常規TACE,術后3d復查肝、腎功能。TACE術后2周內針對PVTT及其周圍腫瘤組織分別行125I放射性粒子植入治療(觀察組)和3DCRT(對照組)。觀察組患者術后1周復查肝功能、凝血功能、血常規。對照組患者放療期間每周復查以上指標。兩組患者均于治療后4~6周行CT或MRI動態增強掃描及AFP檢測作療效評價,并評估是否需要再次接受TACE及125I粒子植入或3DCRT,以后間隔1~3個月復查和隨訪。
1.2.2.1TACE應用Seldinger法使用4F-RH導管經股動脈穿刺插管至腹腔干(或肝總動脈)、腸系膜上動脈、腎動脈或膈動脈等,確定腫瘤規格、數量,明確位置和供血動脈。利用3F微導管超選直至腫瘤供血動脈。經導管灌注奧沙利鉑(艾恒,江蘇恒瑞醫藥股份有限公司)100~150mg,再以表阿霉素(法瑪新,美國輝瑞制藥有限公司)30mg+超液化碘油(法國Laboratorie Guerbet公司)(10~20ml)緩慢注入腫瘤供血動脈內。再依據腫瘤血供情況選擇不同大小的Embo Sphere微球(美國波科Biosphere Medical,300~700μm)適量栓塞腫瘤供血動脈。對合并肝動脈-門靜脈瘺患者,先用碘油明膠海綿復合型栓塞劑或300~700μm微球封堵瘺口[7],然后再行腫瘤供血動脈化療栓塞術。
1.2.2.2CT引導125I放射性粒子植入觀察組患者手術開始前,行肝臟CT動態增強檢查,全面定義PVTT和四周肝內腫瘤為靶區。在TPS系統內導入影像學資料,制定計劃過程中,要求布源點分布于癌栓內部和其周圍肝腫瘤實質內,靶體積比(TVR)>95.0%,靶區90%致死率劑量(D90)為120~160Gy,并最大限度保護周邊重要組織器官處于安全照射范圍。術中穿刺路徑避開大血管及重要組織器官如膽囊、胰腺等。在開始粒子植入之前,首先進行CT定位,后依照TPS計劃,選定穿刺面、點以及布源位置。完成局部麻部之后,使用規格為18G的粒子植入針穿刺,到位之后結合治療計劃布源,粒子的植入間距為0.5~1.0cm,完成后拔針,針道用明膠海綿顆粒(710μm)加以封堵處理。完成手術后行上腹部CT平掃,全面驗證粒子放置數量和位置,并評估有無肝臟、腹腔出血、粒子移位等不良反應,發現冷區及時補種粒子。
1.2.2.33DCRT對照組患者仰臥,兩手交叉上舉直至前額,使用水解塑料膜固定體位,在體表、體模以及治療床標記出正確位置,減少擺位誤差。患者在平靜呼吸狀態下行CT定位薄層(3mm)增強掃描,范圍上界為氣管隆突平面下,下緣至右腎下緣,CT定位圖像傳輸至RayStation4.0V(RaySearch Laboratories AB)制定放療計劃。大體腫瘤體積(GTV)為PVTT、靠近的肝內原發灶或肝內原發灶直接侵犯至門靜脈而形成的癌栓。臨床靶區體積(CTV):于GTV位置均勻擴大5.0~10.0mm;內靶體積(ITV):根據腫瘤隨呼吸運動的程度,于CTV基礎上外放5mm。計劃靶區體積(PTV):以ITV為基準,從三維方向外擴5~6mm。加強控制計量,保證危及器官在耐受劑量之下。肝臟劑量在25 Gy之下,使接受>30.0 Gy劑量照射的正常百分體積(V30)達到最小化。85%~90%等劑量面完全覆蓋PTV,其內部劑量差異在±5%以內[8]。設置4~6個共面或非共面放射野,單次照射劑量1.8~2.0 Gy,3~5次/周,腫瘤總劑量43.2~50.4Gy。放療期間給予積極的保肝、護胃、對癥支持治療。
1.3PVTT療效評價由2位高級職稱影像科醫師審讀患者治療前后MRI及CT資料,評價治療后PVTT變化情況,同時查看肝臟中腫瘤詳情、是否發生遠處轉移。PVTT療效評價標準:(1)臨床緩解(CR):既往PVTT消失;(2)部分緩解(PR):既往PVTT減少幅度≥30%;(3)穩定(SD):既往PVTT無顯著增加(>20%)或縮小(<30%);(4)病灶進展(PD):PVTT范圍增大超過20%或出現新發病灶。有效=CR+PR,疾病控制=CR+PR+SD。1.4觀察指標(1)觀察兩組患者治療情況。(2)比較兩組患者PVTT近期(治療后3個月)療效。(3)比較兩組患者生存情況:隨訪截至2017年1月,觀察并比較兩組患者中位生存期(從治療開始,50%的患者能存活過這個時間)、中位進展期(從治療開始至50%患者腫瘤無法控制,疾病開始進展的時間)及1、2、3年生存率。(4)比較兩組患者的住院時間與治療費用。(5)比較兩組患者并發癥發生情況。
1.5統計學處理應用SPSS 18.0統計軟件;計量資料以表示,組間比較采用兩獨立樣本t檢驗;計數資料以頻數和構成比表示,兩組比較采用χ2檢驗或四格表χ2檢驗;采用Kaplan-Meier法繪制生存曲線,兩組患者生存率的比較采用log-rank檢驗;P<0.05為差異有統計學意義。
2 結果
2.1兩組患者治療情況兩組患者均順利完成TACE。觀察組患者均順利植入125I放射性粒子,技術成功率100%;共行粒子植入40次,平均1.3次/例,15~70粒/次;總植入粒子1 421粒,平均44.4粒/例;粒子植入區實際D90≥120Gy者22例,<120Gy者10例。對照組患者均順利完成3DCRT;患者單次照射劑量1.8~2.0 Gy,腫瘤總劑量43.2~50.4Gy,其中<45 Gy者4例,≥45 Gy者29例。
2.2兩組患者PVTT近期療效比較見表2。

表2 兩組患者PVTT近期療效比較[例(%)]
由表2可見,觀察組患者PVTT治療有效率明顯高于對照組(P<0.05),疾病控制率與對照組比較差異無統計學意義(P>0.05)。
2.3兩組患者生存情況比較見表3、圖1。
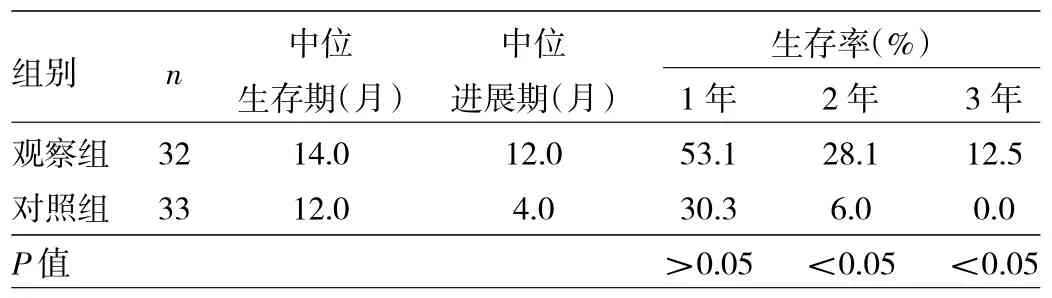
表3 兩組患者生存情況比較

圖1 兩組患者生存曲線比較
由表3、圖1可見,觀察組患者中位生存期、中位進展期均長于對照組。觀察組患者1、2、3年生存率分別為53.1%、28.1%、12.5%,對照組患者1、2、3年生存率分別為30.3%、6.0%、0.0%。兩組患者1年生存率比較差異無統計學意義(P>0.05),觀察組患者2、3年生存率均高于對照組(均P<0.05)。
2.4兩組患者住院時間與治療費用比較觀察組患者住院時間2~9(5.53±1.95)d;對照組患者住院時間31~69(40.24±8.67)d;觀察組患者住院時間明顯短于對照組(P<0.05)。觀察組患者治療費用1.0~4.52(2.58±1.07)萬元,對照組患者治療費用4.0~10.0(5.27±1.52)萬元,觀察組患者治療費用明顯少于對照組(P<0.05)。
2.5兩組患者并發癥發生情況比較兩組共49例患者(75.38%)TACE后出現輕/中度肝功能指標(ALT、AST、TBil、白蛋白、PT等)異常,經護肝治療3~10d基本恢復正常。觀察組5例患者(15.63%)在粒子植入過程中有明顯針道出血,立即予以針道內明膠海綿顆粒封堵處理,無術后大出血發生;1例患者(3.13%)治療期間發生腹腔內感染伴發熱,抗炎治療3d后好轉;1例患者(3.13%)治療期間腹痛明顯,止痛藥物緩解效果不佳,經外照射補救后好轉。對照組8例患者(24.24%)在外照射后出現骨髓抑制(3度),予以重組人粒細胞集落刺激因子(惠爾血,日本協和發酵麒麟株式會社)、參麥注射液(正大青春寶藥業有限公司)等處理后基本恢復;1例患者(3.03%)出現胃腸道反應,予以甲氧氯普胺(胃復安,無錫市第七制藥有限公司)對癥處理后好轉;2例患者(6.06%)出現發熱,暫停放療1周后好轉。所有患者均未出現肝膿腫、肝破裂、消化道潰瘍或出血等嚴重并發癥。
3 討論
HCC是最常見的消化系統惡性腫瘤之一,病情進展迅速。PVTT是導致HCC復發和轉移的主要因素之一,直接影響患者的生存質量和生存時間。因此,如何對PVTT進行有效的治療,控制其進展和肝內轉移,是提高晚期HCC患者生存質量的關鍵。
既往觀點認為,對于肝功能Child-Pugh分級A/B級的HCC伴PVTT患者,首選外科手術,但因術后短期內腫瘤復發,故手術治療受到很大限制。且患者預后與PVTT的部位密切相關。為能提高HCC伴PVTT患者的生存率,臨床嘗試不同的治療方法。近年來,各種非手術介入方法先后用于治療HCC伴PVTT。研究發現,PVTT為肝動脈-門靜脈雙重供血,因此TACE不僅能阻斷肝腫瘤的血供,同時也對PVTT起到化療栓塞的作用。Meta分析顯示,TACE應用于HCC伴PVTT的治療是安全、有效的[9-10]。但也發現TACE主要作用在控制肝內原發腫瘤病變部位,其在治療癌栓方面效果不佳,通常僅有極少的碘化油栓可進入到癌栓中[11]。Niu等[12]發現癌栓越接近門靜脈主干,治療效果越差。這也是目前TACE對PVTT治療效果欠理想的重要原因。近年來,更多學者選擇在基于TACE前提下,聯合放射性治療。有學者對19例HCC伴PVTT患者開展TACE治療[13],發現1、2年生存率分別為40.6%、10.2%。劉清欣等[14]開展多普勒超聲引導下125I粒子條聯合金屬支架在門靜脈中植入+TACE治療HCC伴PVTT也取得了滿意成效。因此,基于TACE前提下,進行放射性治療是目前公認的相對有效的治療方案。但對于HCC伴PVTT的患者,在TACE治療后針對PVTT選擇粒子植入內照射或外照射,哪種方法更有優勢,目前尚無定論。
本研究對HCC伴PVTT患者分別進行TACE聯合125I放射性粒子植入或TACE聯合3DCRT治療,結果顯示觀察組患者PVTT治療有效率明顯高于對照組,疾病控制率與對照組比較差異無統計學意義。分析其原因,可能有以下兩點:(1)PVTT的腫瘤類型早期以增殖型為主,對放射線比較敏感,癌栓短期內易失去活性或處于停滯狀態,癌栓大小不進展,因此也可認為癌栓得到控制,故兩組患者疾病控制率無統計學差異。(2)腫瘤的增殖周期對放射線的敏感度有時相性,即處于G2和M期的腫瘤細胞對放射線較敏感,因而短期的外照射只對處于特定時相的這一部分腫瘤細胞有效,而植入癌栓內的125I放射性粒子半衰期為59.6d,可持續、有效地作用于各個增殖周期的腫瘤細胞,且植入性粒子較體外放療局部照射劑量更高,因而觀察組較對照組在短期內可得到更有效的治療。
進一步觀察兩組患者的遠期療效發現,觀察組患者中位生存期、中位進展期均長于對照組。觀察組患者1、2、3年生存率分別為53.1%、28.1%、12.5%,對照組患者1、2、3年生存率分別為30.3%、6.0%、0.0%。兩組患者1年生存率比較差異無統計學意義,觀察組患者2、3年生存率均高于對照組。分析其原因,筆者認為一般2個半衰期內125I放射性粒子較外照射持續時間長,局部照射劑量高,瘤體接受有效照射劑量更多,因而觀察組患者腫瘤進展相對緩慢;另一方面由于正常全肝照射耐受劑量僅為30~50Gy,限制了對照組外放療的設定劑量,而這個劑量在控制PVTT生長是不滿意的;此外,由于外照射時呼吸運動的影響,腫瘤治療體積丟失率高,且外放療的治療間隔周期較長,放療期間出現癌栓有效控制率低或癌栓轉移,以上因素均可導致對照組疾病進展時間較觀察組縮短,并影響其生存率。兩組患者1年生存率無統計學差異,筆者認為其可能原因是觀察組約1/3患者植入粒子的有效致死劑量D90<120Gy,其生存率往往<1年,考慮為放射劑量不足以殺死腫瘤,導致局部腫瘤未控,繼而腫瘤快速進展播散和肝功能惡化,生存期縮短;因而兩組患者1年病死率均偏高,這也解釋了兩組的中位生存時間相仿。但對于癌栓有效控制率較高的患者,觀察組患者2、3年生存率均高于對照組。這也可以說明,癌栓內粒子植入較外照射在提高患者的遠期生存率方面更勝一籌。
兩組患者分別出現不同類型、不同程度的并發癥。其中觀察組患者以針道出血發生率最高,予以針道內明膠海綿顆粒封堵止血處理是極其簡便有效的方法。而對照組患者以放療后骨髓抑制最為常見,通常予以重組人粒細胞集落刺激因子處理可有效改善。兩種治療方案均適應證廣、并發癥相對較少,但粒子植入相對較便捷,因而在住院時間、治療費用上粒子植入治療更占優勢。
綜上所述,HCC伴PVTT患者經TACE治療后,肝內病灶得到控制的前提下,125I放射性粒子植入與3DCRT短期內均可控制PVTT進展,但125I放射性粒子植入治部在癌栓的減瘤方面更有優勢;從遠期療效來看,125I放射性粒子植入治部可有效延長PVTT進展時間,提高生存率。
[1]馬良,葉甲舟,向邦德,等.不同治療方案對直徑小于10cm肝細胞癌合并門靜脈癌栓患者生存率的影響[J].中華肝膽外科雜志,2013,19(3):165-170.
[2]Su CH,Lin Y,Cai L.Genetic factors,viral infection,other factors and liver cancer:an update on current progress[J].Apjcp,2013,14(9):4953-4960.
[3]Jiang JF,Lao YC,Yuan BH,et al.Treatment of hepatocellular carcinoma with portal vein tumor thrombus:advances and challenges[J].Oncotarget,2017,8(20):33911-33921.
[4]翁志成,楊維竹,江娜,等.CT引導下125I放射性粒子植入治療肝癌門靜脈癌栓的療效評價[J].介入放射學雜志,2010,19(7):535-539.
[5]中華人民共和國衛生部.原發性肝癌規范化病理診斷指南(2015年版)[J].中華肝臟病雜志,2015,23(5):321-328.
[6]Zhu K,Chen J,Lai L,et al.Hepatocellular carcinoma with portal vein tumor thrombus:treatment with transarterial chemoembolization combined with sorafenib:a retrospective controlled study[J].Radiology,2014,272(1):284-293.
[7]鄭家平,邵國良,陳玉堂,等.復合型栓塞劑治療肝癌合并動靜脈瘺的臨床研究[J].中國腫瘤,2011,20(5):383-388.
[8]Capussotti L,Muratore A,Massucco P,et al.Major liver resections for hepatocelluar carcinoma on cirrhosis:early and longtermoutcoms.Liner[J].Transpl,2004,10(2):64-68.
[9]Leng JJ,Xu YZ,Dong JH.Efficacy of transarterial chemoembolization for hepatocellular carcinoma with portal vein thrombosis:a meta-analysis[J].ANZ J Surg,2016,86(10):816-820.
[10]Xue TC,Xie XY,Zhang L,et al.Transarterial chemoembolization for hepatocellular carcinoma with portal vein tumor thrombus:a meta-analysis[J].BMC Gastroenterol,2013,13(1):1-9.
[11]Luo J,Guo RP,Lai EC,et al.Transarterial chemoembolization forunresectable hepatocellular carcinoma with portal vein tumor thrombus:a prospective comparative study[J].Ann Surg Oncol,2011,18(2):413-420.
[12]Niu ZJ,Ma YL,Kang P,et al.Transarterial chemoembolization compared with conservative treatment for advanced hepatocellular carcinoma with portal vein tumor thrombus:using a new classification[J].Med Oncol,2012,29(4):2992-2997.
[13]Yamada K,Lzaki K,Sugimoto K,et al.Prospective trial of combined transeatheter arterial ehemoemlmlization and three dimensional eonfornud radiotherapy for portal vein tumor thrombus in patientswith unresectable hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2003,57(1):113-119.
[14]劉清欣,顏志平,李銳,等.125I粒子條聯合門靜脈支架及化療栓塞治療原發性肝癌合并門靜脈癌栓[J].介入放射學雜志,2009,18(8):593-595.

