H2-calponin在食管鱗癌中的表達及意義
周玲,凌銳,周月鵬,毛朝明,陳德玉
(江蘇大學附屬醫院1.腫瘤研究中心,2.核醫學科,江蘇鎮江212001)
鈣調理蛋白(calponin)是一類細胞骨架蛋白,其中,中性亞型H2-calponin在多種細胞中通過結合肌動蛋白或者與鈣結合蛋白、輔肌動蛋白等相互作用抑制平滑肌收縮、參與信號轉導以及維持骨架穩定等[1-4]。近來研究證實,H2-calponin參與不同類型腫瘤細胞的增殖、侵襲和遷移等,充當著不同甚至相反的角色[5-6]。NF-κB通路是細胞內外信號匯合的關鍵節點,調控腫瘤如食管鱗癌發生、發展的各個環節[7-8]。目前關于 H2-calponin的作用機制尚未明確,因此本文旨在通過比較和分析H2-calponin在食管鱗癌細胞及組織中的表達情況,探討H2-calponin表達與腫瘤進展之間的聯系及相關調控機制。
1 材料與方法
1.1 材料
1.1.1組織標本、細胞株 選取2015年6月至2017年6月于江蘇大學附屬醫院胸外科收治的30例食管鱗癌患者(均簽署知情同意書),行食管癌根治術取其癌組織及癌旁組織,經上海芯超生物科技有限公司制成組織芯片。所有患者術前均未接受任何抗癌治療,所有手術標本經甲醛固定后用石蠟包埋,且均通過病理學檢測證實。
人食管鱗狀細胞癌TE-1、ECA109細胞株及正常食管上皮Het-1a細胞購自廣州吉妮歐生物科技有限公司。
1.1.2主要試劑和儀器 RPMI 1640培養液和胎牛血清(美國Gibco公司);兔抗人H2-calponin抗體(Sigma公司);NF-κB通路抑制劑 PDTC(抑制 IκB磷酸化及阻止NF-κB易位入核)為Selleck公司產品;H2-calponin抗體、鼠抗人增殖細胞核抗原(PCNA)、波性蛋白抗體和鼠抗人β-肌動蛋白(Cell Signaling Technology公司);兔抗人基質金屬蛋白酶-2(MMP-2)、基質金屬蛋白酶-9(MMP-9)、內皮生長因子-A(VEGF-A)、血管內皮生長因子-C(VEGF-C)均為武漢博士德公司產品;NF-κB通路鼠抗人IκBα抗體、p-IκBα抗體、HRP標記的山羊抗兔或鼠抗體(Cell Signaling Technology公司);Trizol試劑、反轉錄及熒光定量PCR試劑盒(大連TaKaRa公司);SDS-PAGE凝膠配制試劑盒(北京Solarbio生物科技有限公司);Biomate 3s核酸測定儀及Pierce ECL plus Substrate(Thermo Fisher Scientific公司);Alpha化學發光凝膠成像系統 Fluor Chem FC3(Protein Simple公司);ELISA試劑盒(杭州聯科生物技術股份有限公司)。
1.2 方法
1.2.1細胞培養 食管鱗癌 TE-1、ECA109細胞,正常食管上皮Het-1a細胞培養于含10%胎牛血清,1%青霉素和1%鏈霉素混合的RPMI 1640培養基,37℃,5%CO2條件下培養,常規傳代。
1.2.2細胞分組及轉染實驗 轉染前24 h,接種TE-1、ECA109細胞至60 mm培養皿中,5×105個/孔,細胞密度達50%~70%后分3組,空白對照組(常規培養)、陰性對照組(轉染空載體siRNA)以及siRNA-H2-calponin組(轉染 siRNA-H2-calponin)。siRNA-H2-calponin上游序列為 5′-CCAUAUCCCAAUACGUGUUATT-3′,下游 5′-UACACGUAUUGGGAUAUGGTT-3′;空載體上游序列為 5′-UUCUUCGAACGUGUCACGUTT-3′,下游 5′-ACGUGACACGUUCGGAGAATT-3′。將0.8 mL Lipo2000混合不同siRNA或者等體積緩沖液加入預留的2.2 mL純RPMI 1640培養皿中,置于37℃5%CO2培養箱中孵育6 h。之后更換含有血清的普通培養基,分別轉染24 h、48 h后提取RNA或者蛋白質以進行后續實驗。
1.2.3免疫組織化學檢測H2-calponin的表達 將包埋于石蠟的組織芯片常規脫蠟水化,抗原修復,去除內源性過氧化物酶活性,血清封閉處理。加入兔抗人H2-calponin抗體(1∶500),4℃孵育過夜。HRP羊抗兔二抗室溫孵育后DAB顯色,蘇木素復染;乙醇脫水,甘油封片,顯微鏡下(400×)隨機選取5個視野觀察,拍照并統計陽性率或平均分,其中H2-calponin表達強度評分標準如下:陽性(棕色或者深棕色)≥75%記為4分;≥50%且<75%記為3分;≥20%且<50%記為2分,≥10%且<20%記為1分,<10%記為0分。
1.2.4總 RNA提取和反轉錄 收集“1.2.2”各組細胞,按照Trizol試劑說明書提取總RNA,核酸測定儀檢測各樣本RNA濃度及確定純度[D(260 nm/280 nm)]在1.8~2.0之間。然后根據反轉錄試劑說明書將總RNA反轉錄合成cDNA,構成10μL反應體系,設定反應條件:37℃15 min;85℃5 s。
1.2.5實時熒光定量PCR檢測食管鱗癌細胞中相關mRNA的表達量 H2-calponin上游引物序列為5′-ACCTGTTTGAGAGTGGGAACATGA-3′,下游引物為 5′-CGTCGAAATTCCGCTCCTG-3′;VEGF-C上游引物序列為 5′-TGTGTGTCCGTCTACAGATGTG-3′,下游 引 物 為 5′-TCGGCAGGAAGTGTGTATTGG-3′;GAPDH上游引物序列為5′-TCAACGGATTTGGTCGTATTG-3′,下游引物為 5′-TGGGTGGAATCATATTGGAAC-3′,均由上海Invitrogen公司合成。PCR反應體系10μL,反應條件:95℃預變性2 min;95℃變性15 s,60℃退火20 s,共40個循環。采用2-△△Ct法計算mRNA的相對表達量。
1.2.6蛋白質印跡法檢測H2-calponin及浸潤侵襲相關蛋白的表達 取“1.2.2”分組細胞,提取總蛋白,常規測定濃度,煮沸變性;60 V電泳30 min,120 V電泳90 min左右,然后將蛋白轉移至PVDF膜;5%BSA封閉1 h;分別加H2-calponin抗體、鼠抗人PCNA、Vimentin抗體和鼠抗人β-肌動蛋白(稀釋度均1∶1 000),以及兔抗人 VEGF-C、VEGF-A、MMP-2、MMP-9抗體(稀釋度1∶400)于4℃孵育過夜;TBST洗膜4次,每次10 min;加入HRP標記的山羊抗兔或鼠抗體(1∶5 000),室溫孵育1 h;TBST洗膜4次,每次10 min;ECL顯影凝膠成像系統記錄結果,每組實驗至少重復3次。
研究組70例患者,15例患者尿蛋白呈陽性,陽性率為21.4%;12例尿膽紅素呈陽性,陽性率為17.1%;9例患者尿糖呈陽性,陽性率為12.9%;14例患者尿酮體呈陽性,陽性率為20%。對照組70例健康者,1例患者尿蛋白呈陽性,陽性率為1.4%;0例患者尿膽紅素呈陽性,陽性率為0;0例患者尿糖呈陽性,陽性率為0;0例患者尿酮體呈陽性,陽性率為0。兩組尿常規檢測的陽性率比較,研究組顯著高于對照組,差異有統計學意義(P<0.05)。
1.2.7ELISA法檢測MMP-2,MMP-9和VEGF-C表達 收集“1.2.2”中3組細胞培養48 h后的上清液,按照ELISA試劑盒說明書操作步驟檢測各組TE-1細胞上清中MMP-2,MMP-9和VEGF-C的表達水平。
1.2.8PDTC處理 將 PDTC原液(10 mmol/L)以1∶1 000稀釋于RPMI1640培養基中制成終濃度為10μmol/L的工作液。接種TE-1細胞至60 mm培養皿中,5×105/孔,細胞密度達50% ~70%后,分別于0,0.5,1,2,4,8,12 h作換液處理。按“1.2.4”和“1.2.5”方法分別提取RNA進行實時熒光定量PCR實驗。以同樣方法接種TE-1細胞24 h,分為空白對照組、陽性對照組、H2-calponin siRNA組、PDTC處理組;前 3組處理同“1.2.2”,PDTC處理組予以10μmol/L PDTC換液處理,48 h后按“1.2.6”提取蛋白并檢測其表達。
1.3 統計分析
應用SPSS 19.0統計學軟件進行數據分析;計量數據以均數±標準差(±s)表示;組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗;P<0.05為差異有統計學意義。
2 結果
2.1 H2-calponin在人食管鱗癌組織及細胞中的表達情況
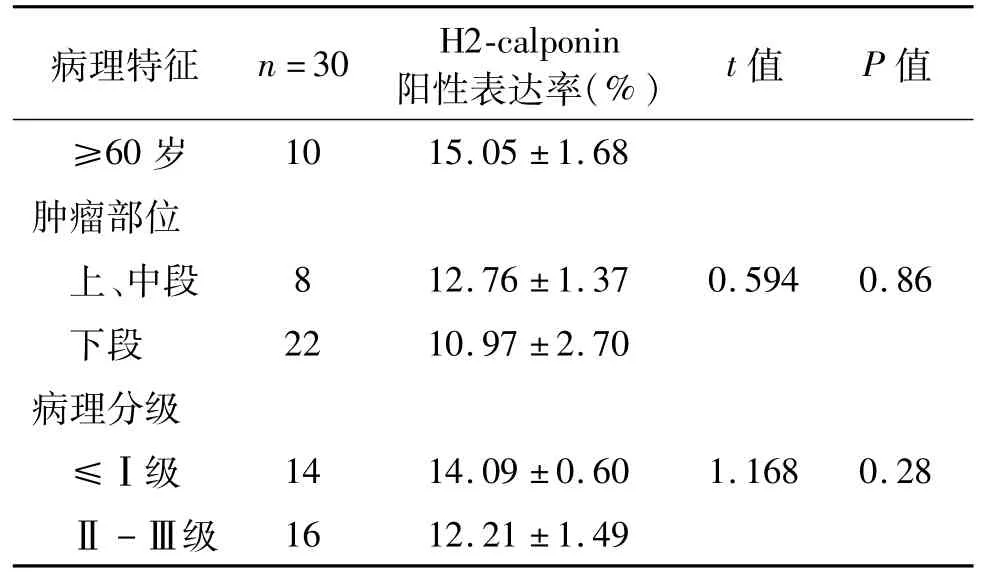
免疫組織化學染色檢測結果顯示,食管鱗癌組織中H2-calponin多呈較低表達,僅在瘤體中心或者腫瘤細胞密集部位可見弱陽性表達;而與之相對應的癌旁組織在上皮層向基底膜之間H2-calponin表達明顯增加,在固有層及其他層均低表達甚至不表達,但總體表達強度高于腫瘤組織(圖1)。H2-calponin陽性表達率與食管鱗癌患者性別、年齡、腫瘤部位及病理分級無明顯相關性(P均>0.05,表1)。
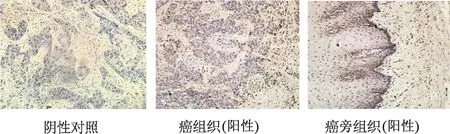
圖1 食管鱗癌及癌旁組織中H2-calponin的表達(免疫組化×200倍)

表1 食管鱗狀細胞癌組織中H2-calponin的表達與臨床病理特征關系
續表
熒光定量PCR結果顯示,與正常食管上皮Het-1a細胞相比,食管鱗癌ECA109細胞、TE-1細胞中H2-calponin表達明顯降低(P<0.01);蛋白質印跡結果與其相一致(圖2)。
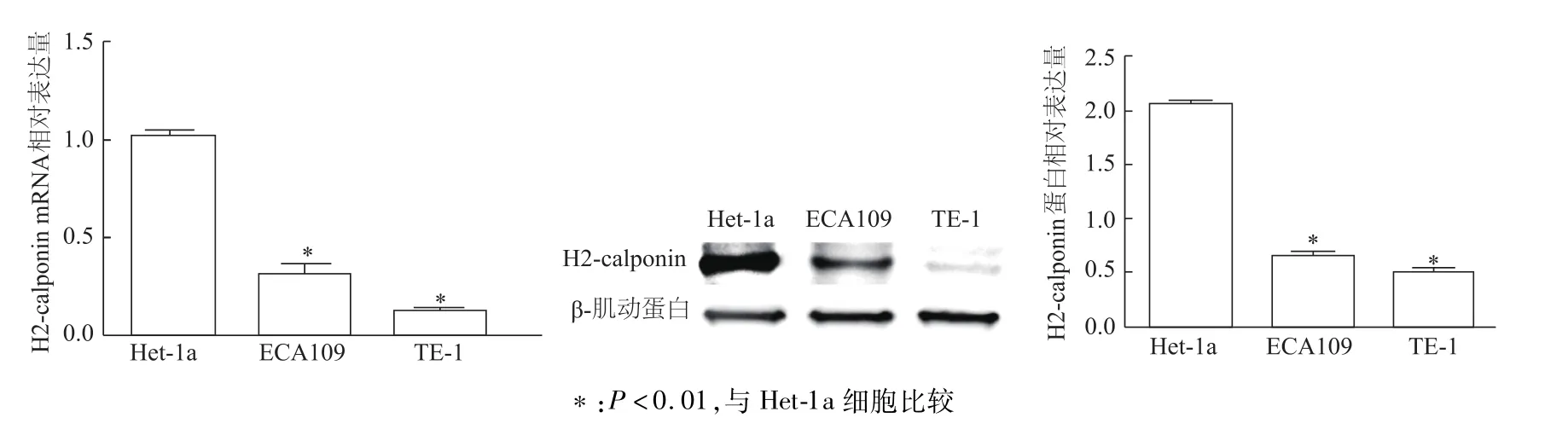
圖2 熒光定量PCR和蛋白質印跡檢測3種食管上皮細胞中H2-calponin表達量
2.2 下調H2-calponin表達對增殖、侵襲和轉移相關蛋白的影響
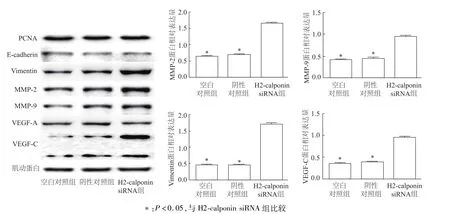
圖3 各組TE-1細胞中增殖、侵襲和轉移相關蛋白的表達
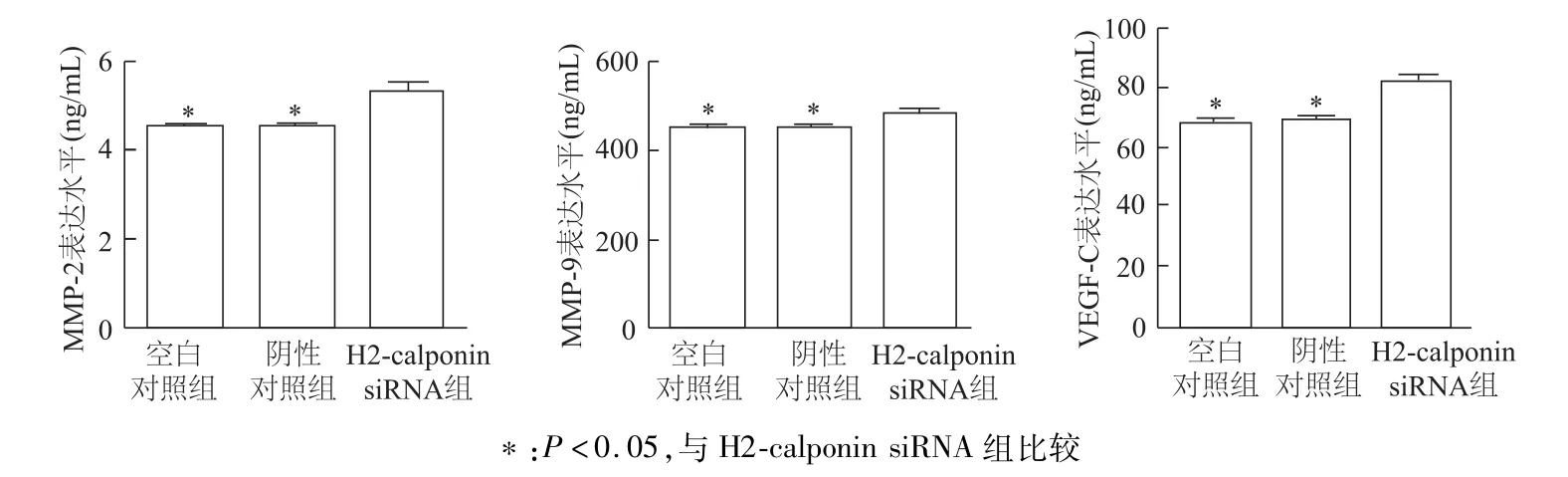
圖4 各組TE-1細胞MMP-2,MMP-9和VEGF-C分泌量
2.3 NF-κB信號通路通過H2-calponin調控食管鱗癌發展進程
熒光定量PCR結果顯示,TE-1細胞在經NF-κB信號通路抑制劑PDTC處理后,H2-calponin mRNA表達量在0.5 h內出現短暫降低,隨后逐漸增加,在2 h即出現明顯增加,而后趨于緩慢,8~12 h時仍高于0 h組(P<0.01,圖5);蛋白質印跡結果也證實PDTC處理后TE-1細胞IκBα表達增加促進H2-calponin蛋白表達并上調(P<0.05,圖6)。
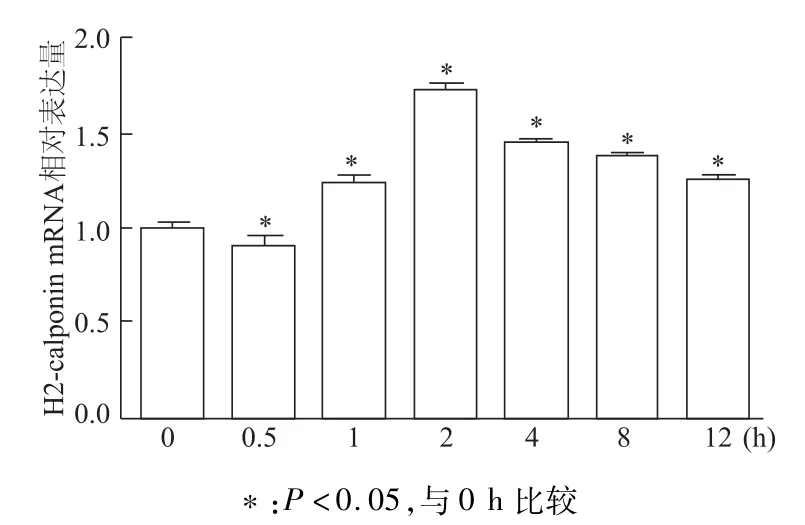
圖5 TE-1細胞經PDTC處理不同時間后H2-calponin mRNA表達量
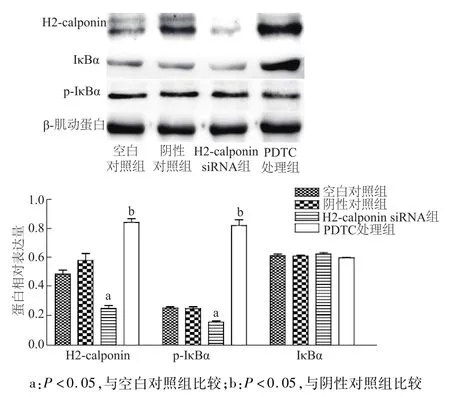
圖6 各組細胞H2-calponin和NF-κB通路相關蛋白的表達
3 討論
H2-calponin在正常組織和細胞中廣泛存在,對維持機體生理功能及穩定起重要作用[1]。近幾年關于H2-calponin在腫瘤發生發展中的研究廣受關注,例如前列腺癌中低表達的H2-calponin促進細胞增殖[5];胃癌中敲除H2-calponin則會激活細胞凋亡進程[6]。有文獻指出,食管鱗癌中H2-calponin高表達與患者不良預后存在著潛在的負相關[9]。本研究發現,食管鱗癌組織中H2-calponin總體表達強度低于癌旁組織,腫瘤細胞株低于正常食管上皮細胞。本研究通過siRNA技術發現,下調H2-calponin表達促進浸潤、侵襲相關蛋白的表達以及波形蛋白、MMP-2和MMP-9等細胞因子的合成與分泌,而對增殖相關蛋白PCNA和E-鈣黏蛋白未有明顯影響。腫瘤轉移主要與遺傳異質性、上皮間充質轉化以及血管與淋巴管生成等有關。目前認為,VEGF家族蛋白作為分泌性糖蛋白可通過促進新生淋巴、血管在腫瘤轉移發生中發揮關鍵作用[10]。本研究證實H2-calponin的下調對VEGF-A沒有明顯作用,但VEGF-C蛋白的合成以及外泌水平都出現明顯增加;食管鱗癌最主要的轉移途徑是淋巴管,因此我們認為H2-calponin持續低表達或者抑制是食管鱗癌原位浸潤、侵襲以及轉移重要基礎。
大量的基質細胞、細胞因子及調節因子等構成了腫瘤細胞增殖、侵襲和轉移所需的環境,而這一微環境的構成離不開腫瘤細胞及關鍵信號通路的調控。其中,NF-κB信號通路的過度活化參與多種腫瘤細胞的惡性增殖、上皮間充質轉化、黏附、MMPs和 VEGF因子分泌等[7,11-12]。研究表明[8,12],生理情況下NF-κB主要與其抑制蛋白IκBα結合成復合體而處于失活狀態,而腫瘤細胞中的NF-κB則異常活化,主要是由于IκBα持續磷酸化致其解離、釋放并進入核內充當轉錄因子,上調或者抑制相應靶蛋白的表達。本研究顯示,食管鱗癌細胞中也存在著激活的NF-κB信號通路;通過PDTC抑制其活化進入胞核即可在2 h左右恢復H2-calponin的轉錄;PDTC處理后IκB的累積與H2-calponin蛋白表達的上調同步,即食管鱗癌細胞中NF-κB的過度激活是H2-calponin表達抑制的基礎。綜上所述,NF-κB通路通過抑制H2-calponin表達,促進食管鱗癌的侵襲和轉移。通過調控關鍵信號通路無疑為腫瘤的靶向治療提供了方向,但實際應用于臨床還存在諸多問題,例如缺乏可預測敏感程度的生物標志,是否存在著未知的反饋或調節機制以及多靶點聯合作用的必要性等,也有待進一步揭示和探討。
[參考文獻]
[1]Liu R,Jin JP.Calponin isoforms CNN1,CNN2 and CNN3:Regulators for actin cytoskeleton functions in smooth muscle and non-muscle cells[J].Gene,2016,585(1):143-153.
[2]Jiang WR,Cady G,Hossain MM,et al.Mechanoregulation of H2-calponin gene expression and the role of Notch signaling[J].JBiol Chem,2014,289(3):1617-1628.
[3]Hines PC,Gao X,White JC,et al.A novel role of H2-calponin in regulating whole blood thrombosis and platelet adhesion during physiologic flow[J].Physiol Rep,2014,2(12):e12228.
[4]Ulmer B,Hagenlocher C,Schmalholz S,etal.Calponin 2 acts as an effector of noncanonical Wnt-mediated cell polarization during neural crest cellmigration[J].Cell Rep,2013,3(3):615-621.
[5]Moazzem HM,Wang X,Bergan RC,et al.Diminished expression of H2-calponin in prostate cancer cells promotes cell proliferation,migration and the dependence of cell adhesion on substrate stiffness[J].FEBSOpen Bio,2014,4:627-636.
[6]Hu J,XieW,Shang L,etal.Knockdown of calponin 2 suppressed cell growth in gastric cancer cells[J].Tumour Biol,2017,39(7):1010428317706455.
[7]Zhu G,Huang Q,Huang Y,et al.Lipopolysaccharide increases the release of VEGF-C that enhances cellmotility and promotes lymphangiogenesis and lymphaticmetastasis through the TLR4-NF-κB/JNK pathways in colorectal cancer[J].Oncotarget,2016,7(45):73711-73724.
[8]Chen Z D,Xu L,Tang KK,et al.NF-κB-dependent transcriptional upregulation of cyclin D1 exerts cytoprotection againsthypoxic injury upon EGFR activation[J].Exp Cell Res,2016,347(1):52-59.
[9]王華,康慧杰,蔣銘佐,等.H2-Calponin在食管鱗癌中的表達及其與食管磷癌預后的關系[J].現代生物醫學進展,2016,16(1):84-87,39.
[10]Goel HL,Mercurio AM.VEGF targets the tumour cell[J].Nat Rev Cancer,2013,13(12):871-882.
[11]Zhang JF,Wang P,Yan YJ,et al.IL33 enhances glioma cellmigration and invasion by upregulation of MMP2 and MMP9 via the ST2-NF-κB pathway[J].Oncol Rep,2017,38(4):2033-2042.
[12]Liu H,Xiong J,He T,et al.High uric acid-induced epithelial-mesenchymal transition of renal tubular epithelial cells via the TLR4/NF-κB signaling pathway[J].Am JNephrol,2017,46(4):333-342.

