不同熱劑量等級的微波消融治療對結腸癌小鼠T細胞的影響
尚夢園,于峰,趙雙雙,吳新財,杜睿,陳寶定
(江蘇大學附屬醫院超聲醫學科,江蘇鎮江212001)
結腸癌是常見的消化道惡性腫瘤,占胃腸道腫瘤的第3位[1]。近年來,結腸癌的發病率與病死率在我國呈上升趨勢,達到甚至超過了西方發達國家的平均水平,其發病年齡在40歲以上,高發年齡普遍在50~60歲,比西方國家平均提早 10歲[2-3]。結腸癌患者發生肝轉移的概率高達50%。研究認為,結腸癌發生肝轉移的概率與結腸靜脈血通過門靜脈進入肝臟有密切關系。流行病學調查顯示,隨著年齡的增大,結腸癌肝轉移的發生率越高,可能與年齡增大者機體免疫力下降有關[4]。
超聲引導下的熱消融治療具有操作簡單、安全、療效好的優點,近年來已經成功應用于各類腫瘤的微創介入治療[5-7]。微波消融屬于熱消融的一種。已有研究證實,微波消融治療不僅能直接使腫瘤細胞凝固壞死,滅活腫瘤組織,而且還能提高患者免疫細胞數量及其抗腫瘤能力。但何種劑量等級既能有效殺傷腫瘤細胞又能最大限度地激發機體抗腫瘤免疫尚無研究,本實驗比較不同熱劑量等級的微波消融治療對結腸癌小鼠T細胞的影響。
1 材料與方法
1.1 材料與試劑
1.1.1動物與瘤株 C57BL/6小鼠,6~8周齡,體重(20±2)g,購自江蘇大學動物中心;MC38結腸癌細胞株由江蘇大學生命科學研究所提供。
1.1.2試劑及設備 FITC標記的抗小鼠CD3抗體、PECy5標記的抗小鼠CD4抗體、PE標記的抗小鼠CD8抗體,相應同型對照均為Biolend公司產品;KY-2000微波消融治療儀購于南京億高微波電子研究所,微波頻率為2 450 MHz,輸出功率范圍為5~20W且連續可調,微波電極針直徑為1.2 mm;流式細胞儀為美國BD公司產品。
1.2 方法
1.2.1結腸癌荷瘤小鼠模型的建立 將在體外培養的對數生長期MC38細胞消化后制備成單細胞懸液,調整細胞密度為2×107/mL,用1 mL胰島素注射器在C57BL/6小鼠的右前肢皮下接種0.1 mL,建立小鼠結腸癌皮下移植瘤模型。當小鼠荷瘤9 d,腫瘤體積長至約1 000 mm3時,認為模型制作成功。
1.2.2分組 腫瘤細胞接種9 d后,選取40只腫瘤體積約1 000 mm3的小鼠隨機分為4組,每組10只。對照組不作任何處理,微波消融治療分為低劑量組(5W、60 s),中劑量組(10W、60 s)和高劑量組(15 W、60 s)。
1.2.3微波消融荷瘤小鼠腫瘤 小鼠腹腔注射水合氯醛0.1 mL麻醉后,固定于自制小鼠手術臺。常規消毒、鋪巾,切開皮膚,沿腫瘤長徑方向插入微波天線,接通微波消融治療儀,對小鼠進行不同熱劑量等級的微波消融治療,根據不同分組調整能量輸出,持續60 s(圖1)。消融后皮下腫瘤原位留置,待小鼠從麻醉中蘇醒后,送回動物實驗室。
圖1 高劑量組小鼠微波消融超聲圖
1.2.4觀察小鼠腫瘤生長情況 于微波消融后的7 d、14 d時,經超聲測量各組小鼠瘤體的體積。
1.2.5檢測小鼠脾臟T細胞變化 微波消融后14 d,流式細胞術檢測小鼠脾臟中的 CD3+T、CD4+T、CD8+T細胞。①標本采集:脫頸處死小鼠,切開腹部摘取脾臟,將脾臟放置于4℃預冷的PBS緩沖液中。②脾淋巴細胞分離:將脾臟置于篩網上,用5 mL注射器內芯研磨脾臟組織,而后用PBS緩沖液沖洗篩網,收集細胞懸液,室溫下500×g離心10 min。棄上清液后加入紅細胞裂解液2 mL,混合均勻,溫室下放置10 min,500×g離心10 min。棄上清液,加PBS緩沖液2 mL,細胞混合均勻,調整細胞密度為106/mL。③ 流式細胞儀檢測脾臟中T淋巴細胞。
1.3 統計學分析
2 結果
2.1 微波消融術后荷瘤小鼠腫瘤體積的變化
4組小鼠微波消融后第7天和第14天時,分別用超聲測量腫瘤大小,結果顯示,微波消融處理后小鼠腫瘤體積較對照組明顯縮小(P<0.05)。見表1。
表1 微波消融術后荷瘤小鼠腫瘤體積n=10,mm3,±s

表1 微波消融術后荷瘤小鼠腫瘤體積n=10,mm3,±s
組別 第7天 第14天對照組1 390±80.5 1 688±89.3低劑量組 988±40.8 837±72.8中劑量組 970±55.7 803±90.4高劑量組 623±79.2 525±65.7 F值16.342 18.227 P值 <0.05 <0.05
2.2 微波消融術后荷瘤小鼠T細胞檢測結果
高、中、低劑量組的 CD3+T、CD4+T細胞均高于對照組(P<0.05或 <0.01),且高劑量組明顯高于中、低劑量組(P<0.05)。高劑量組的CD4+/CD8+T細胞比值明顯高于中、低劑量組(P<0.05),且與對照組相比,增高顯著(P<0.01)。4組間的CD8+T細胞不存在統計學差異(P>0.05),見圖2、表2。

圖2 小鼠脾臟淋巴細胞流式細胞術檢測結果
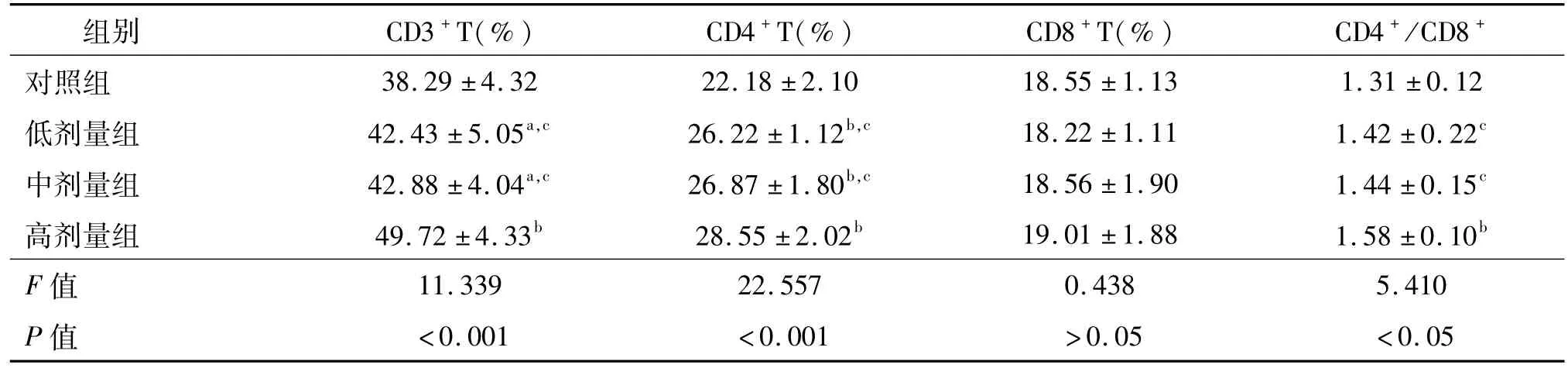
表2 小鼠脾臟中T淋巴細胞比例
3 討論
本研究結果顯示,微波消融術后,腫瘤體積減小;與對照組相比,各劑量組脾臟細胞中的CD3+T、CD4+T細胞和CD4+/CD8+T比值均增加,其中高劑量組顯著增加。上述結果提示,微波消融后的小鼠免疫力有所提高。另外,本研究同時也顯示,中、低劑量組的 CD3+T、CD4+T細胞和 CD4+/CD8+T比值并無明顯差別,說明高劑量的微波消融治療更加有利于提高小鼠的免疫力。
結腸癌好發于中老年人,可發生肝、肺轉移,是威脅中老年人的重大疾病之一[8]。近年來,隨著控溫技術的不斷改善,局部熱消融治療已成為繼手術、放療、化療之后的又一重要治療手段。局部熱消融包括射頻消融和微波消融[9],相對于射頻消融,微波消融有多個微波能量源,組織加熱不受電阻和傳導性的影響,而電磁波可以在更短的時間內使組織溫度達到更高。近年來,微波消融技術提高了熱效率,增加了消融體積,使得大腫瘤和富血供臟器腫瘤的治療成為可能,拓展了該技術在臨床腫瘤治療應用的領域[10-11]。
“腫瘤微環境”理論認為腫瘤微環境的免疫狀態能準確地反映宿主對腫瘤的免疫反應。許多研究都證實,熱消融不僅能夠對腫瘤細胞起到直接殺傷作用,還可從多個環節激發機體的免疫反應。Zerbini等[12]報道,消融產生的高溫能使肝腫瘤組織發生凝固性壞死,大量壞死組織作為抗原能夠產生持續性的局部炎癥反應,活化抗原遞呈細胞,誘導腫瘤特異性T淋巴細胞反應,改善機體抗腫瘤免疫耐受狀態。抗腫瘤免疫應答主要以由細胞免疫為主[13-14],其中T淋巴細胞在腫瘤免疫中發揮重要作用,CD4+T細胞主要介導腫瘤細胞對免疫系統的耐受,既可識別腫瘤細胞分泌的可溶性抗原,又可釋放多種細胞因子參與抗瘤效應,共同發揮抗瘤作用。而CD8+T細胞可以在促炎因子的作用下分化為細胞毒性T細胞,加強機體對腫瘤細胞的殺傷作用。CD4+T和CD8+T細胞相互誘導和制約形成T細胞網,保持一定的比值,對調節細胞免疫反應和維持免疫平衡有重要意義。CD4+/CD8+T比值的下降,表明機體細胞免疫狀態受到腫瘤的抑制;比值上升,提示免疫功能的恢復或增強。本研究中,與對照組相比,微波消融各劑量組 CD3+T、CD4+T細胞和CD4+/CD8+T比值均不同程度地增加,測量所得小鼠腫瘤體積減小,說明小鼠免疫力提高。但四組間的CD8+T細胞無顯著性差異,提示小鼠免疫系統的殺傷功能沒有明顯增加。分析原因,可能與各種免疫細胞活化程度的不同或(和)腫瘤局部浸潤的免疫細胞存在差異有關,其機制有待進一步研究。本研究結果顯示,中、低劑量組 CD3+T、CD4+T細胞,CD4+/CD8+T比值無明顯差別,分析原因:①低、中熱劑量雖對腫瘤細胞造成了一定程度的損傷,但這種損傷可逆。② 體內熱療時,腫瘤組織內熱劑量分布不均,可能導致一部分瘤組織仍存活。因此,低、中熱劑量不足以對抗腫瘤負荷。
綜上所述,本研究結果表明,微波消融治療不僅是一種單純的物理干預措施,更可以提高機體的免疫功能,改善免疫狀態,控制腫瘤復發。且高劑量的微波消融治療能更好地發揮抗腫瘤作用。
[參考文獻]
[1]孫敬國,蔣曉忠.Twist蛋白表達與結腸癌發生發展的關系研究[J].中國全科醫學,2011,4(14):1311-1314.
[2]鄭靈巧,馬彥明.大腸癌發病率不斷攀升[J].老年健康,2011(5):4.
[3]Simoglou C,Gymnopoulou I,Babalis D,et al.Surgery of colon cancer in a district hospital[J].Hell J of Surg,2012,84(1):71-75.
[4]Whiteford MH,Whiteford HM,Yee LF,et al.Usefulness of FDGPET scan in the assessment of suspected metastatic or recurrent adenocarcinoma of the colon and rectum[J].Dis Colon Rectum,2000,43(6):759-767.
[5]YueWW,Wang SR,Lu F,et al.Radiofrequency ablation vs.microwave ablation for patientswith benign thyroid nodules:a propensity scorematching study[J].Endocrine,2017,55(2):485-495.
[6]Korkusuz H,Happel C,Koch DA,et al.Combination of ultrasound-guided percutaneous microwave ablation and radioiodine therapy in benign thyroid disease:a 3-month follow-up study[J].Rofo,2016,188(1):60-68.
[7]Cornman-Homonoff J,Miller ZA,Smirniotopoulos J,et al.Preoperative percutaneousmicrowave ablation of long bonemetastases using a parallelmedullary approach for reduction of operative blood loss[J].JVasc Interv Radiol,2017,28(7):1069-1071.
[8]Huang H,Hao S,Li F,et al.CD4+Th1 cell promote CD8+T cell survival,memory response,tumor localization and therapy by targeted delivery of interleukin 2 via acquired pMHCI complexes[J].Immunology,2007,120(2):148-159.
[9]Oizumi S,Strbo N,Pahwa S,et al.Molecular and cellular requirement for enhanced antigen cross-presentation to CD8 cytotoxic T lymphocytes[J].J Immunol,2007,179(4):2310-2317.
[10]Lardiere-Deguelte S,De Mestier L,Amroun KL,et al.Laparoscopic thermal ablation of splenic metastases initial experience and present aspects[J].J Visc Surg,2013,50(5):355-358.
[11]Liu QD,Song Y,Zhou NX,et al.Radiofrequency ablation of splenic tumors:a case series[J].JGastrointestin Liver Dis,2013,22(1):105-108.
[12]Zerbini A,Pilli M,Penna A,et al.Radiofrequency thermal ablation of hepatocellular carcinoma liver nodules can activate and enhance tumor-specific T-cell responses[J].Cancer Res,2006,66(2):1139-1146.
[13]Pashenkov M,Go?ss G,Wagner C,etal.PhaseⅡ trial of a toll-like receptor 9-activating oligonucleotide in patientswithmetastaticmelanoma[J].JClin Oncol,2006,24(36):5716-5724.
[14]Lonsdorf AS,Kuekrek H,Stern BV,et al.Intratumor CpG-oligodeoxynucleotide injection induces protective antitumor T cell immunity[J].J Immunol,2003,171(8):3941-3946.

