Notch1蛋白胞內段重組慢病毒載體的構建及其在原發性滲出性淋巴瘤細胞中的功能驗證
趙潤然,沈忱悠,嚴沁,盧春
(南京醫科大學病原生物學系,江蘇南京211166)
作為進化高度保守的信號通路,Notch通路借助于相鄰細胞間受體與配體的通訊,參與細胞分化和組織發育等重要的生物學過程。Notch受體(Notch1~4)與配體(DLL1/3/4、JAG1/2)結合后觸發Notch信號,γ-分泌酶識別并切割受體細胞Notch蛋白,釋放具有活性的胞內Notch片段(intracellular Notch,ICN)到胞質中。ICN繼而轉移入核,與轉錄因子RBP-Jκ結合形成蛋白復合體,激活下游Hes、Hey等轉錄因子家族基因表達[1-2]。
大量研究表明,Notch信號通路失調在腫瘤發生與發展過程中發揮了重要作用[3-6],其中包括卡波氏肉瘤病毒(Kaposi′s sarcoma-associated herpesvirus,KSHV)感染導致的卡波氏肉瘤(Kaposi′s sarcoma,KS)。KSHV又稱為人皰疹病毒8型,屬于皰疹病毒γ2亞科,由美國學者于1994年在AIDS相關的KS(AIDS-related KS,AIDS-KS)的病損組織中首次鑒定[7]。KSHV感染除了引起KS外,同時還與原發性滲出性淋巴瘤(primary effusion lymphoma,PEL)以及多中心Castleman病(multicentric Castleman′s disease,MCD)的發生密切相關。Notch信號通路不僅參與KSHV潛伏/裂解的轉換,而且在KSHV誘導相關腫瘤的形成過程,包括內皮細胞間質轉化、血管生成等發揮重要作用[8-9]。
本研究構建了含Notch1受體胞內段基因的ICN重組質粒,包裝了表達ICN的重組慢病毒,以期通過過表達ICN激活Notch信號通路,從而探索其對KSHV潛伏感染的PEL細胞增殖能力的影響。
1 材料與方法
1.1 質粒與細胞
真核表達質粒pIP-Flag-ICN和慢病毒載體pHAGE-CMV-MCS-IzsGreen分別由武漢大學藍柯研究員和黃贊教授惠贈。慢病毒包裝系統的包膜質粒pMD2.G以及包裝質粒psPAX2為本實驗室保存。人胚腎上皮293T細胞培養于含有10%滅活胎牛血清(美國 Gibco公司)的 DMEM培養基(美國 Hyclone公司)中;BCP-1細胞(從PEL中分離的KSHV陽性、EB病毒陰性的B淋巴細胞)培養于含有10%滅活胎牛血清的1640培養基(美國Hyclone公司)中。上述培養基中均加入鏈霉素(100μg/mL)和氨芐西林(100 U/mL),細胞培養于 37℃、5%CO2培養箱中。
1.2 試劑
PCR所用的高保真酶(Fanta酶)為南京諾唯贊科技有限公司產品;PCR引物由南京擎科有限公司合成;T4連接酶(美國Thermo Scientfic公司);限制性內切酶NheⅠ與Bam HⅠ(日本TaKaRa公司);質粒小提試劑盒及凝膠純化試劑盒(美國Omega公司);質粒轉染試劑 LipofectamineTM2000(美國 Invitrogen公司);α-微管蛋白抗體(美國Santa Cruz公司);辣根過氧化物酶標記的羊抗兔IgG、羊抗鼠IgG以及抗ICN單克隆抗體(南京巴傲得生物科技有限公司);抗Flag單克隆抗體和抗Hes-1單克隆抗體(美國Cell Signaling Technology公司);臺盼藍染液為本實驗室自行制備。
1.3 方法
1.3.1ICN基因的PCR擴增 根據真核表達質粒p IP-Flag-ICN序列分別設計ICN的上下游引物,上游引物引入NheⅠ限制性酶切位點,下游引物引入Bam HⅠ限制性酶切位點。上游引物序列為5′-CTA(下劃線部分為 NheⅠ識別序列),下游引物序列為5′-(下劃線部分為Bam HⅠ識別序列)。
1.3.2重組質粒pHAGE-ICN的構建與鑒定 用限制性內切酶NheⅠ和Bam HⅠ雙酶切PCR回收產物和慢病毒載體 pHAGE-CMV-MCS-IzsGreen,并運用瓊脂糖凝膠純化試劑盒進行純化。純化后產物用T4連接酶進行連接,連接產物轉化感受態細胞大腸埃希菌DH5α。隨機選取具有氨芐西林抗性菌落進行擴增,使用質粒小提試劑盒提取重組質粒。雙酶切鑒定重組質粒,同時進行核酸序列測定并經DNAssist比對,比對正確后將該質粒命名為pHAGE-ICN。
在6孔板中鋪入狀態良好的293T細胞過夜。次日,用LipofectamineTM2000將pHAGE-ICN質粒及其對照pHAGE質粒分別轉染入匯合度達到70%~80%的293T細胞中,于轉染6 h后更換為完全培養基,48 h后提取細胞總蛋白,取10μL蛋白樣品進行SDS-PAGE電泳,轉膜后經5%脫脂牛奶封閉,再根據蛋白大小將PVDF膜以含目的蛋白(如α-微管蛋白、Flag標簽蛋白、內源性ICN蛋白以及Notch通路下游Hes-1蛋白)的一抗孵育過夜。第2天以相應的二抗孵育,隨后通過化學發光法進行檢測。
1.3.3重組慢病毒ICN的包裝與滴度測定 在直徑為10 cm的細胞培養皿中鋪入狀態良好的293T細胞過夜。次日,用LipofectmineTM2000將包裝質粒psPAX2、包膜質粒pMD2.G與重組質粒pHAGEICN或其對照pHAGE質粒共同轉染入匯合度達到70%~80%的293T細胞中,10 h后更換為完全培養基。于48 h和72 h收取細胞培養上清液并經0.45 μm濾器過濾,將所獲得的重組慢病毒分別命名為Lv-ICN和Lv-Mock。
采用病毒梯度稀釋法稀釋Lv-ICN和Lv-Mock病毒液,并感染293T細胞。48 h后在熒光顯微鏡下觀察綠色熒光蛋白(green fluorescent protein,GFP)的表達,計數綠色熒光細胞個數,每個綠色熒光細胞計為1個轉導單位(transducing units,TU)。病毒滴度計算公式如下:病毒滴度(TU/mL)=綠色熒光細胞數×病毒液稀釋倍數/病毒液體積。
1.3.4重組慢病毒介導ICN在BCP-1細胞中的表達 取約1×106個狀態良好的BCP-1細胞鋪入6孔板中,以相同感染復數(multiplicity of infection,MOI)的Lv-ICN及其對照Lv-Mock病毒進行感染。感染4 h后更換為完全培養基繼續培養。熒光顯微鏡觀察到 GFP表達后提取細胞總蛋白,按方法“1.3.2”中所述步驟進行蛋白質印跡實驗。
1.3.5細胞計數法檢測ICN過表達對BCP-1細胞增殖能力的影響 將Lv-ICN及其對照Lv-Mock感染的BCP-1細胞鋪入12孔板中(每孔約1×105個細胞),每組設立3個復孔。分別在鋪板0、1、2、3天后收集細胞懸液,將0.1%臺盼藍染液與細胞懸液以1∶1進行混合,染色3 min后計數未著色的活細胞數量。
1.4 統計學方法
應用統計學軟件SPSS 19.0對數據進行分析,兩兩比較采用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 ICN基因的PCR擴增
以真核表達質粒pIP-Flag-ICN為模板進行PCR擴增,1%瓊脂糖凝膠電泳對PCR產物進行鑒定,在約2 445 bp位置可見與預期大小一致的目的片段(圖1)。
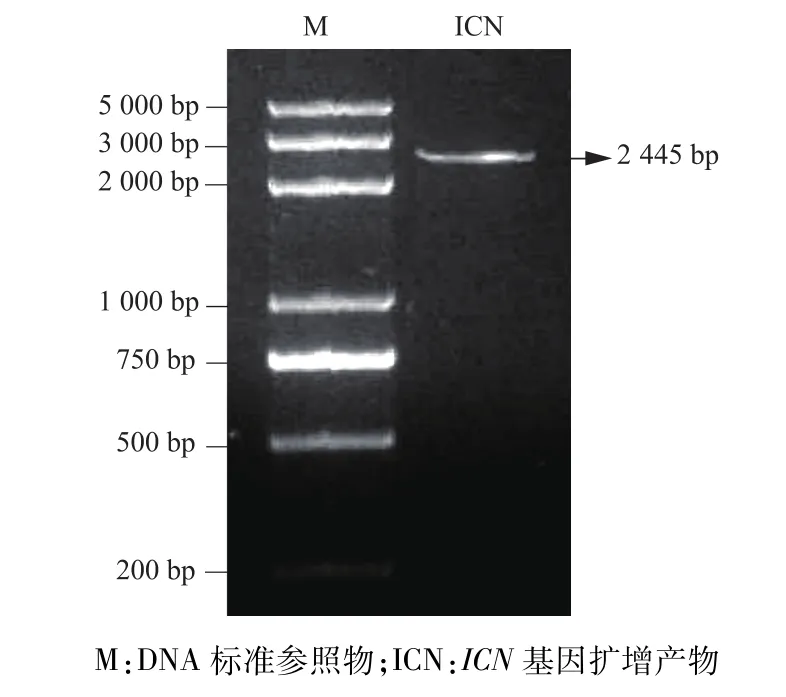
圖1 PCR擴增ICN基因
2.2 重組質粒pHAGE-ICN的鑒定
NheⅠ、Bam HⅠ雙酶切重組質粒pHAGE-ICN,酶切產物經1%瓊脂糖凝膠電泳后,在7 740 bp和2 445 bp處出現明顯條帶(圖2),分別代表慢病毒載體pHAGE-CMV-MCS-IzsGreen和ICN基因。重組質粒序列測定后經DNAssist軟件比對證實,插入的ICN基因片段與基因庫中已登記的序列一致。

圖2 重組質粒pHAGE-ICN的雙酶切鑒定
將重組質粒pHAGE-ICN及對照pHAGE質粒分別轉染293T細胞,蛋白質印跡檢測顯示轉染重組質粒pHAGE-ICN后不僅可以檢測到標簽蛋白的表達,而且還可以提高內源性ICN蛋白以及Notch通路下游重要轉錄因子Hes-1蛋白的表達水平(圖3)。提示重組質粒pHAGE-ICN構建成功。
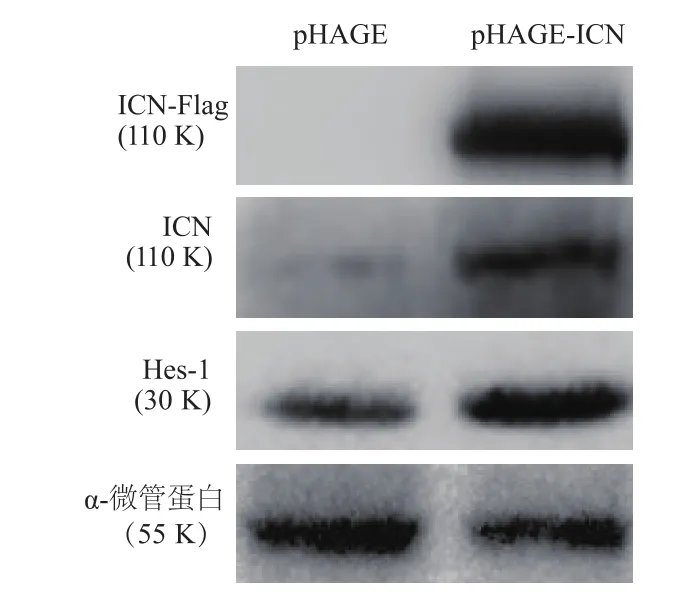
圖3 重組質粒轉染293T細胞后Notch信號通路相關蛋白的表達
2.3 ICN重組慢病毒的包裝及滴度測定
包裝質粒、包膜質粒與pHAGE-ICN質粒或其對照質粒共同轉染入293T細胞,48 h后可以觀察到超過90%的細胞中有GFP表達(圖4)。
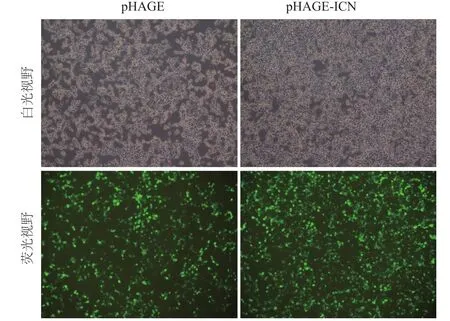
圖4 重組質粒轉染293T細胞后GFP的表達(×100)
按照不同倍數稀釋病毒液后感染293T細胞進行病毒滴度測定,48 h后可以觀察到不同程度的GFP表達(圖5)。經熒光計數法測得含有ICN基因的重組慢病毒的滴度約為2×107TU/mL,對照慢病毒的滴度約為3×107TU/mL。

圖5 不同稀釋度的ICN重組慢病毒感染293T細胞后GFP的表達(×100)
2.4 ICN過表達對BCP-1細胞增殖的影響
以相同MOI的Lv-ICN及其對照Lv-Mock感染BCP-1細胞,觀察到GFP后提取細胞總蛋白進行蛋白質印跡。結果顯示,Lv-ICN感染后可在預期大小處出現特異性的標簽蛋白條帶,同時內源性ICN蛋白以及Notch通路下游Hes-1蛋白的表達水平明顯提高(圖6A),表明重組慢病毒成功介導ICN蛋白在BCP-1細胞中的過表達,且感染Lv-ICN后有效活化了BCP-1細胞中的Notch通路。
臺盼藍染色細胞計數法結果顯示,從鋪板第3天起,經Lv-ICN感染的BCP-1細胞增殖能力比對照組顯著增強(P<0.05,圖6B)。提示重組慢病毒介導ICN蛋白的過表達能夠增強BCP-1細胞的增殖能力。
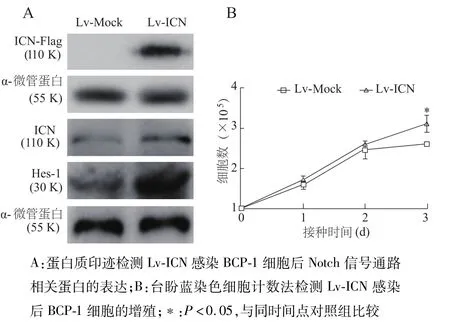
圖6 重組慢病毒介導的ICN蛋白在BCP-1細胞中的功能驗證
3 討論
病毒感染后能夠依賴細胞信號通路在宿主細胞內進行感染和復制,而細胞信號通路的改變則是宿主對病毒感染的反應以及病毒修飾感染環境的綜合結果。類似地,KSHV可以通過調控Notch信號通路服務于自身生命周期以及誘導相關腫瘤的發生。研究發現,在KS病灶組織及KSHV感染細胞中,Notch信號通路的多種組分呈現高水平表達[10],其中包括 Notch1、Notch2、Notch3、JAG1等[11]。在 PEL細胞中,KSHV編碼的潛伏相關核抗原(latency-associated nuclear antigen,LANA)通過阻止ICN的泛素化降解,提高ICN在細胞中的穩定性和表達水平,并增強細胞的增殖能力[12]。同時,KSHV感染B細胞后還可以通過促進ICN的表達,上調Cyclin D1從而加速細胞的增殖[13]。因此,KSHV感染后活化的Notch信號通路具有促進宿主細胞生長的作用。在PEL細胞中,使用 γ-分泌酶抑制劑(γ-secretase inhibitor,GSI)抑制Notch信號通路可以使細胞維持在G1期并抑制細胞生長。更重要的是,GSI處理后可以減緩小鼠體內 KS腫瘤細胞的生長[14]。提示Notch信號通路可以作為治療KSHV感染引起的惡性腫瘤的潛在靶點。
目前尚無針對Notch信號通路的特異性激動劑。為此,構建表達特定Notch信號通路組分的表達載體成為最常用的活化Notch信號的方式。Notch受體蛋白由胞外結構域和胞內結構域組成,其蛋白編碼序列全長近7.6 kb,一般很難進行完整克隆。由于Notch信號通路發揮生物學功能主要通過ICN[15],因此對ICN進行選擇性克隆是目前研究Notch信號通路的主要方法之一。作為一種常用的分子生物學工具,病毒載體能夠通過病毒基因組將遺傳物質帶入細胞中。目前應用較多的是慢病毒載體,該載體具有容納的外源性目的基因片段大、包裝周期短等特點,且外源性基因插入細胞基因組后能夠穩定地持續地表達[16]。鑒于ICN片段較長,且對病毒感染效率要求較高,本文在構建重組質粒pHAGE-ICN的基礎上,選擇通過慢病毒三質粒包裝系統包裝了攜帶ICN基因的重組慢病毒,從而達到激活Notch信號通路的目的。
以表達ICN的重組慢病毒感染含有KSHV的PEL細胞,通過蛋白質印跡證實ICN蛋白得到有效過表達,并且能夠促進Notch信號通路下游轉錄因子的表達。進一步研究發現,過表達ICN能顯著增強KSHV潛伏的PEL細胞的增殖能力。提示本研究構建的ICN重組慢病毒可以顯著活化Notch通路信號,為后續研究Notch信號通路在KSHV生命周期和相關腫瘤發生中的作用奠定了基礎。
[參考文獻]
[1]Bray SJ,Gomez-Lamarca M.Notch after cleavage[J].Curr Opin Cell Biol,2017,51:103-109.
[2]Hahm ER,Chandra-Kuntal K,Desai D,et al.Notch activation is dispensable for D,L-sulforaphane-mediated inhibition of human prostate cancer cell migration[J].PLoSOne,2012,7(9):e44957.
[3]Dabral S,Tian X,Kojonazarov B,et al.Notch1 signalling regulates endothelial proliferation and apoptosis in pulmonary arterial hypertension[J].Eur Respir J,2016,48(4):1137-1149.
[4]Harbuzariu A,Rampoldi A,Daley-Brown DS,et al.Leptin-Notch signaling axis is involved in pancreatic cancer progression[J].Oncotarget,2017,8(5):7740-7752.
[5]Shin HM,Minter LM,Cho OH,et al.Notch-1 augments NF-κB activity by facilitating its nuclear retention[J].EMBO J,2005,25(1):129-138.
[6]Tao J,Jiang MM,Jiang L,et al.Notch activation as a driver of osteogenic sarcoma[J].Cancer Cell,2014,26(3):390-401.
[7]尚元翠,盧春,秦娣.卡波氏肉瘤病毒K9基因重組慢病毒表達載體的構建及其編碼蛋白功能初探[J].江蘇大學學報(醫學版),2016,26(6):461-465.
[8]Carroll KD,Bu W,PalmeriD,etal.Kaposi′s sarcomaassociated herpesvirus lytic switch protein stimulates DNA binding of RBP-Jk/CSL to activate the notch pathway[J].JVirol,2006,80(19):9697-9709.
[9]Lan K,MurakamiM,Choudhuri T,et al.Intracellularactivated Notch1 can reactivate Kaposi′s sarcoma-associated herpesvirus from latency[J].Virology,2006,351(2):393-403.
[10]DeCotiis JL,Lukac DM.KSHV and the role of Notch receptor dysregulation in disease progression[J].Pathogens,2017,6(3):34.
[11]Liu R,Li X,Tulpule A,et al.KSHV-induced Notch components render endothelial and mural cell characteristics and cell survival[J].Blood,2010,115(4):887-895.
[12]Lan K,Verma SC,Murakami M,et al.Kaposi′s sarcoma herpesvirus-encoded latency-associated nuclear antigen stabilizes intracellular activated Notch by targeting the Sel10 protein[J].Proc Natl Acad SciU SA,2007,104(41):16287-16292.
[13]Lan K,Choudhuri T,Murakami M,et al.Intracellular activated Notch1 is critical for proliferation of Kaposi′s sarcoma-associated herpesvirus-associated B-lymphoma cell lines in vitro[J].JVirol,2006,80(13):6411-6419.
[14]Lan K,Murakami M,Bajaj B,et al.Inhibition of KSHV-infected primary effusion lymphomas in NOD/SCID mice byγ-secretase inhibitor[J].Cancer Biol T-her,2009,8(22):2136-2143.
[15]Kang HG,Kim DH,Kim SJ,et al.Galectin-3 supports stemness in ovarian cancer stem cells by activation of the Notch1 intracellular domain[J].Oncotarget,2016,7(42):68229-68241.
[16]王露,翟瑋瑋,楊向榮,等.慢病毒介導RNA干擾沉默Fas基因在臍帶間充質干細胞中的表達[J].南方醫科大學學報,2014,34(10):1475-1480.

