二氧化碳分壓和滲透壓升高對CHO細胞維持期生長、代謝和產物表達的影響
王晨 汪嘉琪 趙亮, 范里, 劉旭平, 陳敏 張理想 譚文松,
(1. 華東理工大學 生物反應器工程國家重點實驗室,上海 200237;2. 上海倍諳基生物科技有限公司,上海 200237)
抗體類藥物因其高特異性、親和性及安全性等優點被廣泛應用于針對人類自身免疫性疾病、癌癥類疾病及各種炎癥類疾病的治療過程中。應用動物細胞大規模培養技術生產抗體類藥物已成為生物醫藥產業主流生產技術[1]。伴隨細胞高密度及大規模培養,反應器內的二氧化碳分壓(pCO2)的累積情況顯著增加,甚至到達200 mmHg,顯著高于生理水平(31-54 mmHg)[2]。過高的 pCO2除了可以抑制細胞生長、代謝和降低產率之外,對產物糖基化修飾也存在不利影響[3-6]。
除此之外,伴隨著培養過程中CO2的大量累積,培養體系逐漸酸化。為有效控制培養體系pH,只能增加補堿量,進而導致體系中滲透壓持續升高[7]。而作為另一個重要的培養過程變量,滲透壓的升高也會對細胞生長、代謝和產率產生不利影響[4-5,8]。由于細胞高密度維持主要集中在流加培養后期(產物表達期)及灌注培養過程中,這一階段的二氧化碳累積和滲透壓升高問題更應該被關注。因此全面且深入的研究pCO2和滲透壓升高對產物表達期細胞生長維持、產物表達及產品質量的影響,對于表達重組蛋白藥物的哺乳動物細胞培養工藝優化放大和工業化生產過程的有效控制具有重要的參考價值。
為此,本研究以表達單克隆抗體的CHO細胞為研究對象,考察了不同pCO2和滲透壓水平下,細胞生長、代謝和產物表達及產品質量的情況,深入了解了pCO2和滲透壓升高對產物表達過程的影響,以期為動物細胞培養工藝放大過程中風險評估奠定部分基礎。
1 材料與方法
1.1 材料
本研究所用細胞株為表達單克隆抗體(CD20)的重組CHO細胞株,該細胞株是在原始細胞株CHO-K1基礎上共轉染抗CD20重鏈、輕鏈和二氫葉酸還原酶(DHFR)基因,通過氨甲喋呤(MTX)加壓篩選獲得[9]。所使用的培養基為實驗室自主開發的培養基[10]。培養基配制所需試劑均購于Sigma-Aldrich公司。培養基配制完后經0.22 μm微孔濾膜(Millipore)過濾除菌后使用。
1.2 方法
1.2.1 細胞培養方法
1.2.1.1 種子細胞培養 從細胞庫中復蘇重組CHO細胞,以5.0×105cells/mL的活細胞密度接種于50 mL細胞培養管(TPP),接種體積為20 mL,置于37℃、5%的CO2條件下進行懸浮擴增培養,搖床轉速為220 r/min。每隔2 d進行種子細胞傳代擴增,傳代后活細胞密度控制在5.0×105cells/mL左右。
1.2.1.2 批式培養 取指數生長期的CHO種子細胞,1 000 r/min離心5 min后,棄培養上清,用新鮮培養基重懸細胞,以1×106cells/mL的活細胞密度接種于1 L(Corning)搖瓶,接種體積為300 mL。根據實驗設計,流加培養至5 d,將細胞懸液1 000 r/min離心5 min后,棄培養上清,重懸于預平衡后的新鮮實驗用培養基內。選取pCO2為40 mmHg(正常分壓組)和150 mmHg(高分壓組),滲透壓為300、350、400、450 mOsm/kg這幾組培養條件進行研究,采用正交法考察兩者對CHO細胞產物表達的影響。通過調整培養基中NaHCO3的濃度及培養箱內CO2含量實現不同的pCO2條件,當NaHCO3添加量為2.2和5.5 g/L時,平衡后與之對應的pCO2分別為40 mmHg和150 mmHg。實驗中滲透壓用NaCl進行調整。將裝有重懸后的細胞懸液的搖瓶分別置于32℃、5%或20% CO2的飽和濕度培養箱重新進行懸浮培養,搖床轉速為120 r/min,每組實驗重復3次。培養過程中第0、1、3、5、7、9天分別取細胞懸液1 mL進行細胞計數后,經10 000 r/min離心5 min后,取上清保存于-80℃,用于后期抗體產量和胞外代謝物濃度的檢測。
1.2.2 分析方法
1.2.2.1 基礎分析方法 細胞密度及活性首先用臺盼藍染色后,采用血球計數板進行計數。葡萄糖、乳酸、氨、谷氨酰胺和谷氨酸濃度采用NOVA Bioprofile 400生化分析儀檢測。產物濃度采用Protein A-HPLC(Applied Biosystems) 方 法[11]檢測。上清收獲后采用rProtein A 親和層析柱(GE Healthcare)純化并收集抗體。
1.2.2.2 胞內代謝物提取及檢測方法 取1×107個細胞進行胞內物質淬滅及提取,采用含1 μmol/L十四酸為內標的50%(V/V)乙腈水溶液的提取方法[12]。提取的胞內代謝物溶液采用SpeedVac(Thermo)進行真空離心濃縮至干粉后,保存于-80℃待測。干燥后的胞內代謝物首先使用甲氧胺鹽酸鹽進行酮基保護后,經MSTFA進行硅烷化衍生,使用安捷倫6890氣象色譜(GC)加5975四級桿質量檢測器(EI)(MS)進行分離及定量,氣象分離采用HP-5毛細管為分離柱(30 m×0.25 mm,膜厚0.25 μm),具體分離方法如文獻所述[13]。
1.2.2.3 HPLC法檢測抗體電荷異質性 抗體電荷異質性采用弱陽離子交換色譜進行分離及檢測[14]。
1.2.2.4 HPLC法檢測抗體糖基化 抗體糖基化檢測采用2-對氨基苯甲酰胺(2-AB)標記試劑盒(Prozyme)法進行檢測[15]。簡單來說首先用N-糖酰胺酶(PNGase F)將N-糖從60 μg抗體上解離下來,然后采用2-AB熒光染料標記后,使用TSK-GEL Amide-80(4.6×250 mm)色譜柱進行分離。流動相分別為A(125 mmol/L 甲酸銨,pH4.4)和B(100%乙腈),分離條件為:(1)30%-40% 線性梯度洗脫A 90 min;(2)40%-46% 線性梯度洗脫 A 54 min;(3)46%-95% 線性梯度洗脫 A 1 min;(4)95%-100%線性梯度洗脫A 3 min;(5)100%-30% 線性梯度洗脫A 4 min,流速為0.4 mL/min,檢測器為熒光檢測器。
1.2.2.5 數據分析 抗體比生成速率及營養物和代謝物的比消耗速率采用濃度與IVCC(活細胞密度對時間的積分)擬合的方法[16]進行計算。
2 結果
2.1 pCO2和滲透壓對CHO細胞生長和抗體表達的影響
首先以1×106cells/mL的活細胞密度接種于1 L(Corning)搖瓶中,接種體積為300 mL。細胞在前2 d內快速生長,最大比生長速率為0.89±0.22 day-1,并于第4天達到最高細胞密度為(45.1±8)×105cells/mL后細胞進入穩定維持期。圖1-A所示為CHO細胞在不同條件下的細胞維持曲線。如圖所示,由于采用換液培養的手段,細胞在降溫32℃條件下,細胞密度在pCO2和滲透壓較低的情況下培養第6 d出現了明顯上升,但隨著滲透壓的升高,細胞后期的維持密度下降,其中有3組實驗組(Osm450-150,Osm400-40和Osm450-40)在第6天細胞密度僅出現維持狀態。在相同滲透壓情況下,隨著pCO2的升高,細胞的后期維持有所改善。
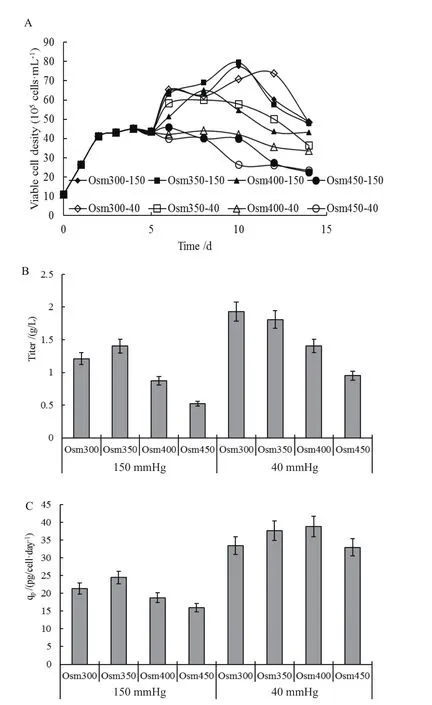
圖1 不同pCO2和滲透壓條件下細胞維持(A)、抗體濃度(B)及抗體比生產速率(C)
圖1-B、C分別是CHO細胞在不同條件下的產量和產物比生成速率(qp)的數據。結果表明,在350 mOsm/kg和40 mmHg下,產物的最終表達量最高(2.03 g/L),在此pCO2下,隨著滲透壓的升高,細胞的產量成比例下降至最低49.2%。而將pCO2提高至150 mmHg時,產量整體下降,其中在300 mOsm/kg和450 mOsm/kg時,相較于350 mOsm/kg和40 mmHg這一培養條件下產量,分別下降至62.6%和27%。
此外,通過對比不同條件下產物比生成速率可以看出,正常分壓組內滲透壓改變對產物的比生成速率變化沒有顯著影響(P<0.05),產物平均比生成速率為35.7 pg/cell·day-1。同時,高pCO2抑制了產物比生成速率,在450 mOsm/kg時,相較于350 mOsm/kg和40 mmHg條件下qp,最大下降至52%。此外,在高分壓組內,提高滲透壓至450 mOsm/kg時,相對于350 mOsm/kg條件下,細胞的產物比生成速率由24.4 pg/cell·day-1明顯下降至16 pg/cell·day-1。
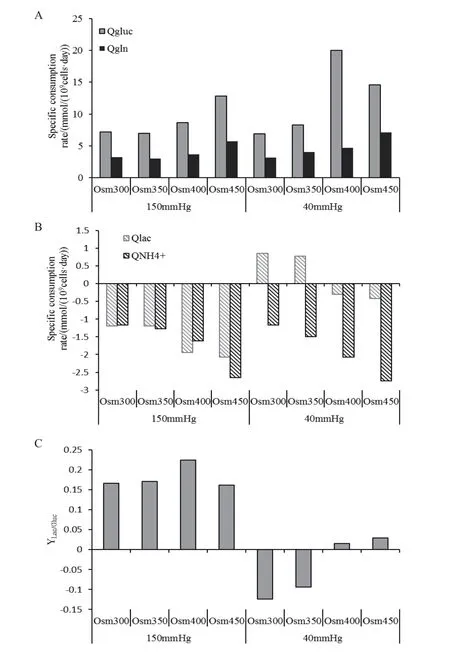
圖2 不同pCO2和滲透壓下CHO細胞葡萄糖和谷氨酰胺比消耗速率(A)、乳酸和氨比消耗速率(B)以及乳酸得率(C)情況
2.2 pCO2和滲透壓對CHO細胞代謝的影響
圖2-A、B是不同pCO2和滲透壓水平下,CHO細胞胞外葡萄糖(Gluc)、谷氨酰胺(Gln)、乳酸(Lac)和氨離子(NH4+)消耗速率的數據。隨著滲透壓的升高,細胞的谷氨酰胺和葡萄糖的消耗速率逐漸增加。但是在正常分壓組下,細胞滲透壓從400 mOsm/kg升高至450 mOsm/kg時,葡萄糖消耗速率減少。同時,在高pCO2組和正常pCO2組內,隨著滲透壓的升高,胞外的氨和乳酸比生成速率持續增加,尤其在正常分壓組內,隨著滲透壓的升高,乳酸則是完成了從消耗向生成的逆轉。在滲透壓一致的條件下,培養環境中的pCO2升高對谷氨酰胺和氨的代謝無顯著影響,但是對乳酸和葡萄糖代謝影響顯著。在300 和350 mOsm/kg下,不同pCO2下細胞的胞外葡萄糖的代謝情況較一致,而乳酸代謝則為相反代謝狀態。在400和450 mOsm/kg 高pCO2下,其葡萄糖的消耗速率明顯下降,乳酸的生成速率明顯提高。通過進一步比較乳酸對于葡萄糖的得率(YLac/Gluc)(圖2-C)可知,在高分壓下,不論滲透壓水平如何變化,乳酸的得率相較正常分壓組明顯升高;在正常分壓組內,隨著滲透壓的升高,乳酸得率越來越高,但最高僅為450 mOsm/kg和150 mmHg組乳酸得率的18%。
除此之外,進一步考察不同條件下細胞的胞內代謝物情況。圖3是不同pCO2和滲透壓水平下,CHO細胞胞內各種代謝物在培養第10 d的相對含量圖。如圖所示,在正常pCO2組內,隨著滲透壓的升高,胞內物質含量總體升高;在高pCO2組內,滲透壓升高至450 mOsm/kg后,胞內物質含量為組內相對濃度最高組。而在相同滲透壓下,分壓越高,胞內物質的含量越低,尤其以各類氨基酸和糖類為主要降低對象。其中乳酸含量在正常pCO2組內,隨著滲透壓的升高出現了明顯累積,在高pCO2組內,當滲透壓達到450 mOsm/kg時,也出現了濃度的升高;而當滲透壓≥350 mOsm/kg時,在高pCO2組內乳酸的含量均低于正常pCO2組。觀察3個TCA循環中間代謝物琥珀酸、檸檬酸和蘋果酸的含量,可以得出提高環境中的pCO2可以提高琥珀酸胞內含量并減少檸檬酸含量(除400 mOsm/kg和150 mmHg條件),同時在正常pCO2情況下提高滲透壓則會促進蘋果酸的累積。結合胞內和胞外的代謝情況可知,滲透壓及二氧化碳分壓升高均會對細胞代謝產生復雜且顯著的影響,伴隨胞外葡萄糖和谷氨酰胺的消耗量增高,胞內物質濃度也大致出現相應的增加的現象。

圖3 不同pCO2和滲透壓下CHO細胞胞內物質相對含量
2.3 pCO2和滲透壓對CHO細胞產物產品質量的影響
2.3.1 pCO2和滲透壓對CHO細胞產物糖基化的影響 表1為不同pCO2和滲透壓下,最終收獲的抗體上各種糖型結構的分布比例。如表所示,在相同的pCO2下,隨著滲透壓的升高,產物的甘露糖糖型含量升高,且半乳糖糖型含量下降,其中G1F的含量明顯下降。而在相同滲透壓下,二氧化碳含量的升高未導致各類糖型含量的明顯變化。
2.3.2 pCO2和滲透壓對CHO細胞產物電荷水平的影響 圖4為不同 pCO2和滲透壓水平下,產物的最終電荷分布情況。如圖所示,在正常pCO2組內,滲透壓從300 mOsm/kg升至450 mOsm/kg可以促進主峰含量升高43%;在高pCO2組內,同樣梯度的滲透壓升高也可促進主峰含量升高17%。與此同時,在同一pCO2組內,滲透壓的升高導致酸性峰比例逐漸減少;在正常pCO2條件下,滲透壓升高還會導致堿性峰含量的逐漸下降。
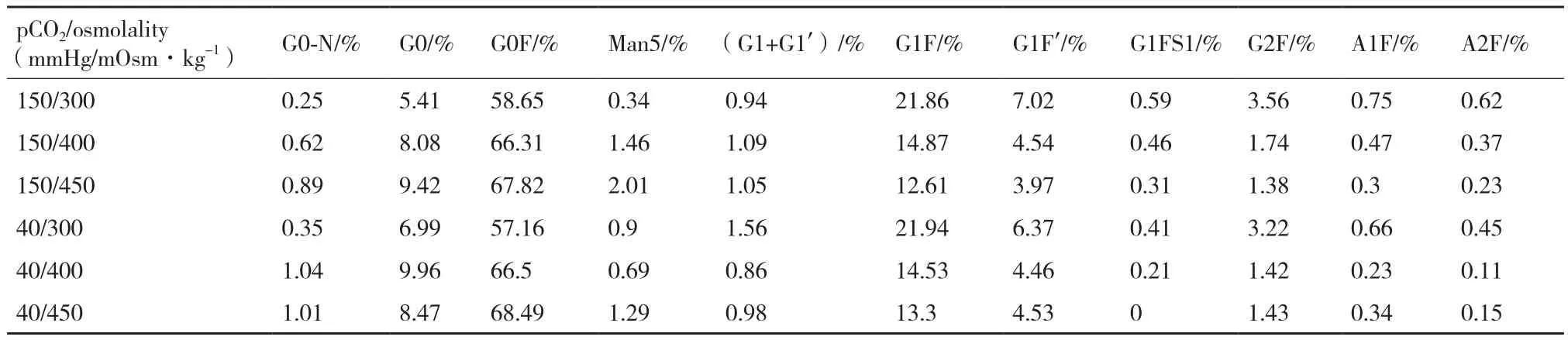
表1 不同pCO2和滲透壓下產物糖型分布
在滲透壓相同的情況下,高pCO2下,其主峰含量變少;且滲透壓越高時,主峰含量差異越大,最大至降低20%(450 mOsm/kg)。其中在滲透壓較低的范圍(300,350 mOsm/kg)下,二氧化碳含量升高增加產物酸性峰含量,并減少了產物堿性峰含量;在滲透壓較高的范圍內(400和450 mOsm/kg)二氧化碳分壓升高則主要增加其堿性峰的含量。
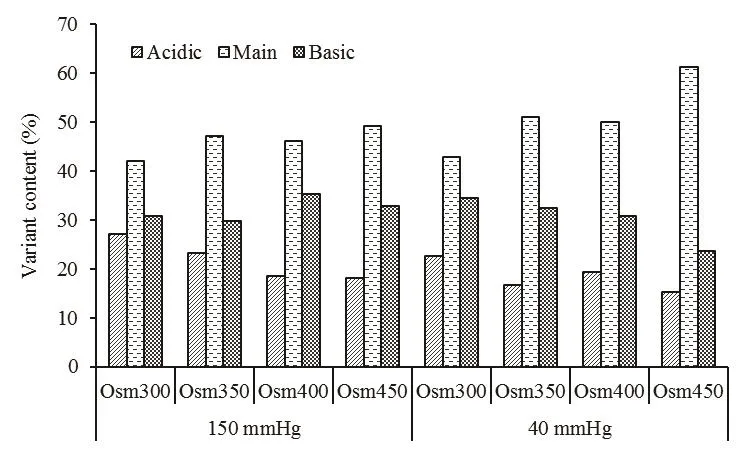
圖4 不同pCO2和滲透壓下產物電荷分布
3 討論
以攪拌式反應器為培養容器,以重組哺乳動物細胞為表達載體生產蛋白類藥物已經成為生物制藥領域的主流方向之一。在培養規模放大過程中,隨著細胞密度的升高,培養體系內CO2和滲透壓也逐漸累積,因此pCO2和滲透壓的控制也成為了反應器放大過程中的兩個關鍵控制參數。為此,本研究以一株具有工業化應用潛力的表達抗CD20的dhfr-CHO細胞為研究對象,綜合研究了pCO2和滲透壓升高對細胞產物生成時期的生長維持、代謝、抗體表達和抗體關鍵質量屬性的影響。
細胞培養過程中的最終產量由兩方面影響,分別為產物比生成速率及累積活細胞密度(IVCC),其中累積活細胞密度與后期細胞活性維持息息相關。因此本文分別從這兩方面了解pCO2和滲透壓的升高對最終產量變化的影響。在細胞維持方面,同等滲透壓下,高pCO2有利于細胞培養后期的生長維持。本實驗體系中培養基的pH緩沖采用碳酸氫鈉單獨緩沖的體系,因此在培養pH一致時,高pCO2對應培養基中高碳酸氫鈉濃度[6],高濃度的緩沖體系則意味著更強的pH緩沖能力,從而緩解了培養后期因為乳酸生成所引起的pH下降而導致的細胞活性的下降。而在抗體表達方面,高pCO2顯著降低了細胞的產物比消耗速率,從而導致最終的產量下降,這一現象和前人報道一致[5]。
細胞物質及能量代謝過程中作為抗體生成量的代表性指標有培養過程中的乳酸代謝和細胞有氧代謝效率等,在產物高表達過程中通常伴隨胞外乳酸的消耗[17]和胞內有氧糖酵解通路的增強[18]。通過調研不同pCO2下細胞胞外代謝物消耗速率和胞內代謝物的相對濃度可以發現,pCO2升高不利于葡萄糖的消耗,尤其是在滲透壓較高的條件下(400和450 mOsm/kg);同時pCO2升高會顯著加快代謝副產物乳酸的生成,并使胞內代謝物的平均含量減少。通過進一步計算乳酸得率(YLac/Gluc),可以觀察到高pCO2組,其乳酸得率明顯升高,這表示消耗單位葡萄糖其生成的乳酸越多,進入TCA循環的比例越低,細胞的物質代謝越低效。而進一步觀察胞內代謝物含量可以發現,雖然在高pCO2條件下,多數胞內代謝物含量下降,但胞內琥珀酸的含量明顯提高。據前人報道,純CO2可以直接抑制胞內多種酶,例如,琥珀酸脫氫酶(SDH)[19]和NADPH生成酶[20],因而胞內琥珀酸累積可能和SDH抑制相關。綜合胞內外代謝情況,可以看出高pCO2不利于細胞進行有效的有氧代謝。根據前人報道,細胞的線粒體脫氫酶在調節細胞有氧代謝和無氧代謝中具有重要地位,而其活性同產物比生成速率成正相關,因此高二氧化碳分壓所導致的細胞有氧代謝低效也可能是造成產物比生成速率下降的重要原因之一[18]。同時觀察高pCO2下,產物的關鍵質量屬性(糖型修飾和電荷異質性)的變化,不同于文獻關于糖型修飾的報道[3],pCO2的升高對單抗的糖型結構無顯著影響,但是顯著降低了抗體中性主峰含量[4]。
在相同pCO2內,隨著滲透壓的升高,細胞后期活性和最終產量逐漸下降,產物比生成速率出現先升高后降低的趨勢。但在正常pCO2組內,提高滲透壓對產物比生成速率的影響無統計學意義;而在高pCO2組內,當滲透壓升高至400 mOsm/kg時,產物的比生成速率相對于150 mOsm/kg組顯著下降。此現象說明在高pCO2條件下,增加培養過程中的滲透壓水平會對細胞產物表達產生協同抑制作用。同時,通過考察同一pCO2不同滲透壓條件下,細胞的胞外代謝速率和胞內物質含量可以分析出,滲透壓的升高可以有效促進胞外葡萄糖和谷氨酰胺的消耗,并增強乳酸和氨的生成,同時胞內物質含量也隨滲透壓的升高而變多。通過進一步計算乳酸得率(YLac/Gluc),可以觀察到提高滲透壓顯著升高了乳酸得率,即降低了細胞的單位葡萄糖有效利用率。除此之外,CHO細胞胞內ATP供給主要依賴糖酵解途徑[21]。因此,隨著滲透壓的升高其葡萄糖利用速率的增加可有效增加細胞胞內ATP含量,此現象也吻合前人的報道[8]。上述結果表明,滲透壓升高在一定程度上刺激了細胞中心碳代謝通量,因此其產物比生成速率呈現了先升后降的趨勢,但滲透壓對細胞生長的抑制作用可能存在除中心碳代謝之外的作用因素[22]。通過對比不同滲透壓下產物的關鍵質量屬性,可以看出隨著滲透壓的升高,產物半乳糖基化水平顯著遞減。與此同時,隨著滲透壓的升高,產物的酸性峰比例下調,中性峰比例升高,而其堿性峰比例在不同的pCO2條件下呈現了相反的趨勢。
產物表達是CHO細胞表達重組蛋白的重要組成部分,而pCO2和滲透壓是兩個極易在此過程中累積的關鍵操作控制參數,因此通過系統了解pCO2和滲透壓升高對細胞各項參數的影響,有助于我們在運用QbD(質量源于設計)方法[23]生產單抗藥物時,對pCO2和滲透壓進行相應的評估標準的設定并進一步指導放大過程的進行。
4 結論
當滲透壓為300 mOsm/kg,pCO2為40 mmHg時,產物的最終產量最高,細胞的營養物代謝最高效,產物的糖型修飾也較完整,但是產物的中性電荷主峰含量為最低。在此基礎上提高滲透壓可以有效的增加產物的中性電荷主峰,但是其余參數水平下調。pCO2的升高不利于產物表達和產物產品質量。綜合而言,在反應器放大的過程應當盡量避免pCO2和滲透壓的過度累積以保證最終產量最大化。
[1] Bandaranayake AD, Almo SC. Recent advances in mammalian protein production[J]. FEBS Lett, 2014, 588(2):253-260.
[2] Altman PL, Dittmer D. Respiration and Circulation[M].Federation of American Societies of Experimental Biology, 1971.
[3] Brunner M, Fricke J, Kroll P, et al. Investigation of the interactions of critical scale-up parameters(pH, pO2and pCO2)on CHO batch performance and critical quality attributes[J]. Bioproc Biosyst Eng, 2017, 40(2):251-263.
[4] Schmelzer AE, Miller WM. Hyperosmotic stress and elevated pCO2alter monoclonal antibody charge distribution and monosaccharide content[J]. Biotechnol Progr, 2002, 18(2):346-353.
[5] Kimura R, Miller WM. Effects of elevated pCO2and/or osmolality on the growth and recombinant tPA production of CHO cells[J].Biotechnol Bioeng, 1996, 52:152-160.
[6] Goudar CT, Matanguihan R, Long E, et al. Decreased pCO2accumulation by eliminating bicarbonate addition to high celldensity cultures[J]. Biotechnol Bioeng, 2007, 96(6):1107-1117.
[7] Xing Z, Lewis AM, Borys MC, et al. A carbon dioxide stripping model for mammalian cell culture in manufacturing scale bioreactors[J].Biotechnol Bioeng, 2017, 114(6):1184-1194.
[8] Pfizenmaier J, Matuszczyk JC, Takors R. Changes in intracellular ATP-content of CHO cells as response to hyperosmolality[J].Biotechnol Progr, 2015, 31(5):1212-1216.
[9] Chen F, Fan L, Wang J, et al. Insight into the roles of hypoxanthine and thydimine on cultivating antibody-producing CHO cells:cell growth, antibody production and long-term stability[J]. Appl Microbiol Biotechnol, 2012, 93(1):169-178.
[10] 譚文松, 孫亞婷, 趙亮. 適于動物細胞表達產品大規模生產的化學成分明確培養基:中國, CN 104328158 A[P]. 2015-02-04.
[11] Yang JD, Lu C, Stasny B, et al. Fed-batch bioreactor process scaleup from 3-L to 2, 500-L scale for monoclonal antibody production from cell culture[J]. Biotechnol Bioeng, 2007, 98(1):141-154.
[12] Dietmair S, Timmins NE, Gray PP, et al. Towards quantitative metabolomics of mammalian cells:development of a metabolite extraction protocol[J]. Anal Biochem, 2010, 404(2):155-164.
[13] Zhao C, Nambou K, Wei L, et al. Evaluation of metabolome sample preparation methods regarding leakage reduction for the oleaginous yeastYarrowia lipolytica[J]. Biochem Eng J, 2014, 82:63-70.
[14] Zhang XT, Tang HP, Sun YT, et al. Elucidating the effects of arginine and lysine on a monoclonal antibody C-terminal lysine variation in CHO cell cultures[J]. Appl Microbiol Biotechnol,2015, 99(16):6643-6652.
[15] Guile GR, Rudd PM, Wing DR, et al. A rapid high-resolution high-performance liquid chromatographic method for separating glycan mixtures and analyzing oligosaccharide profiles[J]. Anal Biochem, 1996, 240(2):210-226.
[16] 陳以衡, 陶姝宇, 劉旭平. 微載體濃度與細胞接種密度對ST細胞生長的影響[J]. 生物技術通報, 2016, 32(4):242-250.
[17] Le H, Kabbur S, Pollastrini L, et al. Multivariate analysis of cell culture bioprocess data-lactate consumption as process indicator[J]. J Biotechnol, 2012, 162(2-3):210-223.
[18] Chen F, Ye Z, Zhao L, et al. Correlation of antibody production rate with glucose and lactate metabolism in Chinese hamster ovary cells[J]. Biotechnol Lett, 2012, 34(3):425-432.
[19] Edwards LJ. Carbon dioxide anaesthesia and succinic dehydrogenase in the corn earworm, Heliothis zea[J]. J Insect Physiol, 1968, 14(8):1045-1048.
[20] Friedlander A, Navarro S, Silhacek DL. The effect of carbon dioxide on NADPH production inEphestia cautella(Wlk. )pupae[J].Comp Biochem Phys B, 1984, 77(4):839-842.
[21] Martínez VS, Dietmair S, Quek LE, et al. Flux balance analysis of CHO cells before and after a metabolic switch from lactate production to consumption[J]. Biotechnol Bioeng, 2013, 110(2):660-666.
[22] Shen D, Kiehl TR, Khattak SF, et al. Transcriptomic responses to sodium chloride-induced osmotic stress:A study of industrial fedbatch CHO cell cultures[J]. Biotechnol Progr, 2010, 26(4):1104-1115.
[23] Rathore AS. Roadmap for implementation of quality by design(QbD)for biotechnology products[J]. Trends Biotechnol, 2009,27(9):546-553.

