葡萄籽中白藜蘆醇的提取及其對LO2細胞氧化損傷保護及延緩衰老作用
高原 王福玲 徐蓓蕾 雒江菡 閻力君 趙瑩瑩 王越
(哈爾濱商業大學藥學院 細胞與分子生物學研究所,哈爾濱 150076)
葡萄酒在生產過程中會產生各種各樣的副產物,如葡萄籽、葡萄皮等,葡萄籽在葡萄皮渣這些副產物中高達到65%左右。葡萄籽中含有豐富的蛋白質、纖維素、脂肪、礦物質和維生素等營養成分,還富含白藜蘆醇[1]。白藜蘆醇是一類多酚類化合物,具有廣泛的抗癌、抗氧化、抗炎等作用。在清除自由基、保持機體自由基動態平衡,延緩衰老方面也發揮著重要作用[2-3]。酒精是葡萄酒中的主要成分之一,急性酒精攝入對肝臟具有顯著的脂質過氧化作用。目前,酒精對肝臟的影響及酒精性肝病發病機制的研究多集中于短期、急性酒精攝入方面,而有關白藜蘆醇與酒精對LO2肝細胞氧化損傷模型的構建及氧化損傷保護作用的研究較少。本實驗通過酒精誘導構建LO2細胞的氧化損傷模型,并通過D-半乳糖構建衰老小鼠模型,采用白藜蘆醇提取物干預后,對細胞及小鼠肝勻漿超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(Glutathione peroxidase,GSH-px)、丙二醛(MDA)含量進行測定,探討白藜蘆醇提取物對肝細胞損傷及延緩衰老的作用,旨為其抗氧化損傷機理研究奠定基礎。
1 材料與方法
1.1 材料
1.1.1 細胞株 LO2細胞,哈爾濱商業大學細胞與分子生物學研究所保存。
1.1.2 動物 昆明種健康小鼠,購自長春億斯。
1.1.3 實驗材料 葡萄籽(購自哈爾濱家樂福超市);白藜蘆醇(≥98%,西安玉泉生物科技有限公司);四甲基氮唑鹽(Sigma公司);RPMI1640 培養基(四季青);雙抗(碧云天);胎牛血清(Hyclone);MDA、SOD 和GSH-Px試劑盒(南京建成生物工程研究所)。
1.1.4 實驗儀器 SX-700型高壓滅菌鍋(TOMY);高 效 液 相 色 譜 儀 Agilent1200(Agilent); 質譜 儀 API3000(Applied Biosystems); 酶 標 儀ELx800(BioTek),CO2培 養 箱(memmert); 生物安全柜(Airstream)紫外分光光度計(HALO DynamicaDB-20),電熱恒溫水浴鍋(上海華運分析儀器有限公司)。
1.2 方法
1.2.1 葡萄籽中白藜蘆醇的提取及檢測 將葡萄籽經過粉碎機粉碎,過80目篩之后,準確稱取粉碎后的葡萄籽樣品。分別通過乙醇浸提法、熱回流提取、超聲波輔助提取、超聲波輔助雙水相提取等方法對葡萄籽中的白藜蘆醇進行提取。超聲波輔助雙水相提取是在葡萄籽樣品中加入一定量的乙醇-硫酸銨雙水相體系溶劑放入恒溫水浴鍋內浸提,取出后用超聲提取。提取完畢后料液經抽濾后,得到上下相,上相用旋轉蒸發儀濃縮,得葡萄籽粗提物。將粗提物用乙醇溶解,備用[4-7]。每種方法均取10.00 g葡萄籽粉末于三角瓶中,液料比為1∶10、浸提時間40 min、超聲功率300 W、超聲溫度50℃、超聲時間10 min,雙水相體系為(乙醇:硫酸銨=1∶1),處理后抽濾獲取上清液濃縮后乙醇溶解。
HPLC檢測條件及定量方法如下:安捷倫1200高效液相色譜儀;HIQ Sil C18W(250 mm × 4.6 mm,5 μm)色譜柱;檢測波長為291 nm;檢測溫度為35℃;流動相為乙腈-水(26∶74);流速為1 mL/min。采用外標法進行定量[8]。通過檢測白藜蘆醇的含量計算白藜蘆醇提取率計算公式如下:
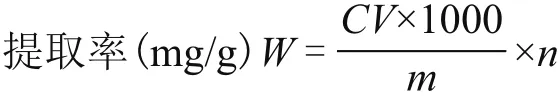
式中:m為葡萄籽粗粉質量(g);C為葡萄籽樣品溶液濃度(μg/mL);V為提取后濾液體積(mL);n為濾液中白藜蘆醇的含量。
1.2.2 LO2細胞的培養與藥效學檢測 細胞株培養于含10% 胎牛血清與1%雙抗的RPMI 1640培養基中,將細胞培養瓶于37℃、5%CO2培養箱內連續培養。細胞貼壁長滿后,用0. 25%胰蛋白酶消化,傳代培養。按如下方法進行MTT法細胞抑制率檢測,取處于對數生長期的LO2細胞,使用含有10%胎牛血清與1%雙抗的RPMI1640培養液稀釋成1×104個細胞/mL;將200 μL細胞懸液分別加入96孔板每個孔中,置于 37℃、5% CO2培養箱中培養24 h。每孔中加入不同濃度的白藜蘆醇提取物,稀釋至需要的工作濃度(0、5、10、20、40、80 μg/mL)。置于37℃、5% CO2的培養箱中培養72 h。首先加入80 μLDMSO,MTT用無血清RPMI1640培養液配成濃度為5 mg/mL的溶液,每孔中加入20 μL,置于37℃、5% CO2孵化培養箱中孵育4 h。吸出上清,加入150 μL DMSO 溶解沉淀物,低速搖床震蕩10 min,OD480nm酶標儀檢測。藥物對LO2細胞的存活率公式:
細胞生長存活率=(實驗組OD/對照組OD)× 100%
1.2.3 白藜蘆醇提取物對酒精誘導LO2細胞抗氧化酶活力等指標的影響 取處于對數生長期的LO2細胞接種于6孔培養板,每孔1×104細胞,培養約12 h后,分為陰性對照組、陽性對照組和不同濃度的白藜蘆醇組。陰性對照組不加受試物;陽性對照組只加入100 mmol/L酒精干預6 h,白藜蘆醇組(0、5、10、20、40 μg/mL)預處理12 h,各濃度再加入100 mmol/L酒精作用6 h,置于37℃,5% CO2培養箱中培養。干預結束后用0.01 mol/L PBS清洗2次,然后每孔加入細胞裂解液100 μL裂解細胞后于4℃12 000 r/min 離心15 min取得上清,參照試劑盒要求,測定細胞中MDA水平、SOD活性、GSH-PX活性等相關氧化損傷的指標[9]。陽性對照藥選取維生素C(0-40 μg/mL)。
1.2.4 衰老小鼠模型的構建 參照《藥理學實驗方法學》中的方法造模[10]。昆明種小鼠60只,雌雄各半,適應性喂養1周后,平均分為6組,每組各10只小鼠。各組分別作如下處理:(1)正常對照組,每天注射生理鹽水;(2)D-半乳糖組,每天注射D-半乳糖;(3)維生素E組,每天注射D-半乳糖及灌胃給藥100 mg/kg的維生素E;(4)白藜蘆醇提取物高劑量組,每天注射D-半乳糖及灌胃給藥150 mg/kg白藜蘆醇提取物;(5)白藜蘆醇提取物中劑量組,每天注射D-半乳糖及灌胃給藥100 mg/kg白藜蘆醇提取物;(6)白藜蘆醇提取物低劑量組,每天注射D-半乳糖及灌胃給藥50 mg/kg的白藜蘆醇提取物。生理鹽水和D-半乳糖注射劑量均為100 mg/kg,所有試驗動物均食用全價混合飼料,自由攝取和取水,連續給藥、灌胃10周。
1.2.5 白藜蘆醇提取物對衰老小鼠肝MDA水平、SOD活性、GSH-PX活性的影響 小鼠猝死后,取肝研磨后,參照試劑盒要求,測定組織研磨液中MDA水平、SOD活性、GSH-PX活性等相關氧化損傷的指標[11-13]。
1.2.6 白藜蘆醇的純化及質譜檢測 通過硅膠柱層析法對白藜蘆醇提取物進一步分離純化,硅膠與上樣量比為50∶1,流動向為甲醇∶氯仿,梯度洗脫后將目標組分濃縮并溶解于色譜甲醇,0.22 μm濾膜過濾后進行質譜檢測。
1.2.7 統計學處理及方法 應用SPSS統計軟件包進行數據統計學處理。采用ANOVA方差分析并行方差齊性檢驗;結果以x-±s表示。
2 結果
2.1 葡萄籽中白藜蘆醇的提取及含量計算
對乙醇浸提法、熱回流提取、超聲波輔助提取、超聲波輔助雙水相提取等方法對葡萄籽中的白藜蘆醇進行提取,并通過檢測白藜蘆醇的含量計算白藜蘆醇提取率。
比較幾種提取白藜蘆醇的方法,超聲輔助雙水相提取的方法葡萄籽中白藜蘆醇的提取率較高,提取效果較好。達到2.408 ±0. 088 mg/g采用超聲波集成乙醇-硫酸銨雙水相體系萃取分離葡萄籽中的白藜蘆醇,同時具有超聲與雙水相提取的優點。具有較好的提取純化效果(圖1)。
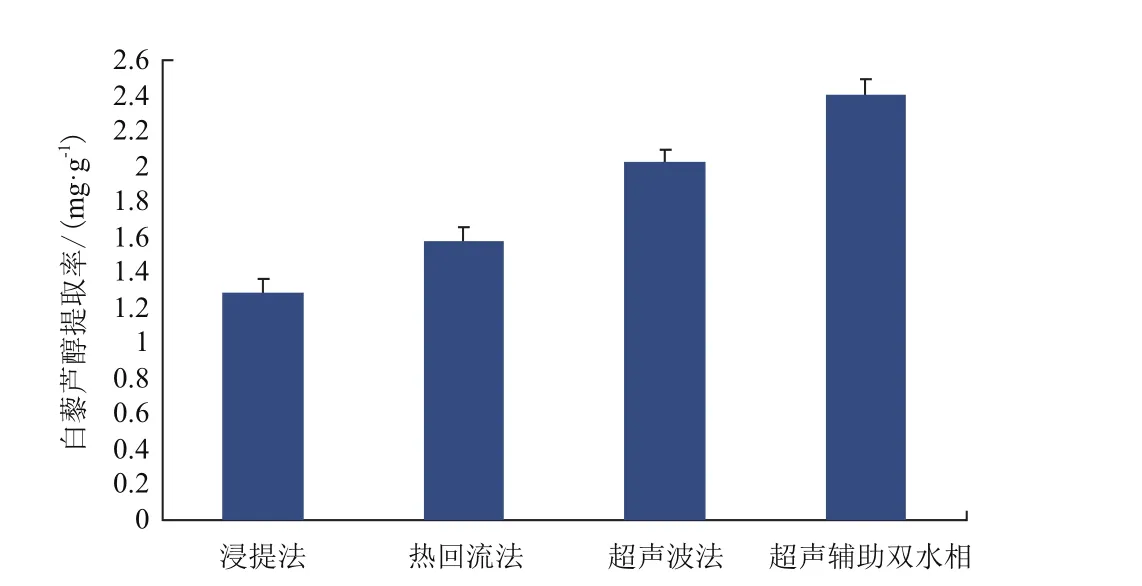
圖1 不同提取方法下的白藜蘆醇提取率
2.2 MTT法測定白藜蘆醇提取物對LO2細胞的抑制作用
通過MTT法測定了葡萄籽中白藜蘆醇提取物對LO2細胞的抑制作用,與空白對照組相比白藜蘆醇提取物濃度(0、5、10、20、40 μg/mL)保護組表現為對細胞無明顯抑制作用。如圖2所示,在0-40 μg/mL濃度的白藜蘆醇提取物作用下,細胞的抑制率≤10%,說明在0-40 μg/mL濃度下對白藜蘆醇提取物對LO2細胞無明顯抑制作用。
2.3 白藜蘆醇提取物對乙醇誘導LO2細胞抗氧化酶活力等指標的影響
與空白對照組比較,乙醇誘導模型組細胞裂解液中SOD活性明顯降低,GSH-Px活性明顯下降,MDA水平明顯升高。白藜蘆醇提取物作用于LO2細胞后,能夠降低乙醇誘導損傷引起的丙二醛(MDA)含量的升高,MDA含量由5.26 nmol/mg 蛋白下降為3.44 nmol/mg 蛋白。提高SOD和GSH-Px活性,SOD活性由15.38 U/mg蛋白升高至16.91 U/mg蛋白,GSH-Px活性由6.45U/mg蛋白升高至8.58 U/mg蛋白。且變化趨勢均呈明顯的劑量依賴性,如圖3所示。與陽性對照維生素C(0-40 μg/mL)結果呈現一致性,維生素C作用LO2細胞后,MDA含量下降2.38 nmol/mg蛋白,SOD活性上升3.48 U/mg蛋白,GSHPx活性上升3.83 U/mg蛋白。
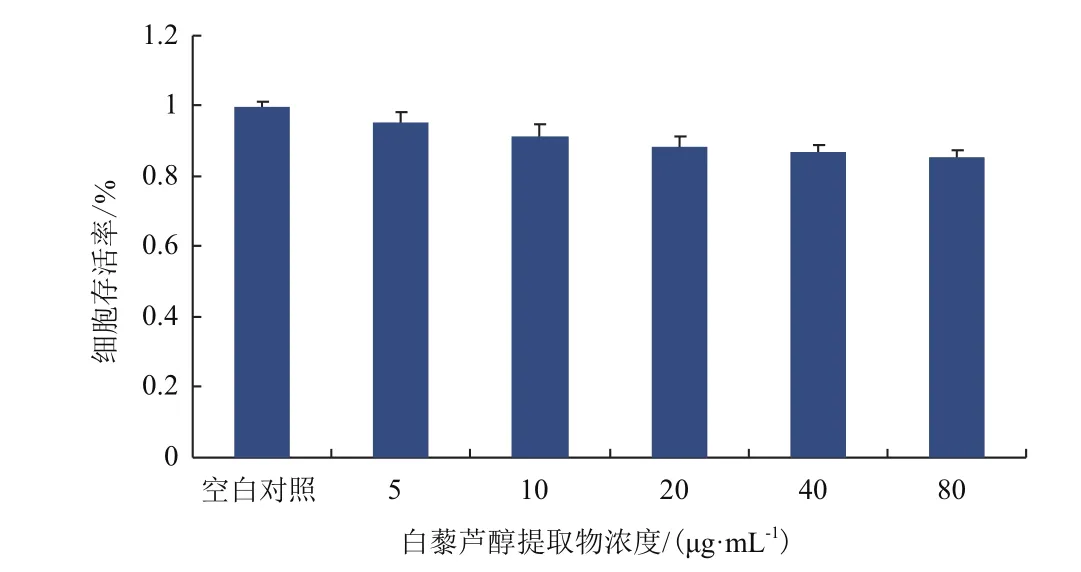
圖 2 白藜蘆醇提取物對LO2細胞存活率的影響
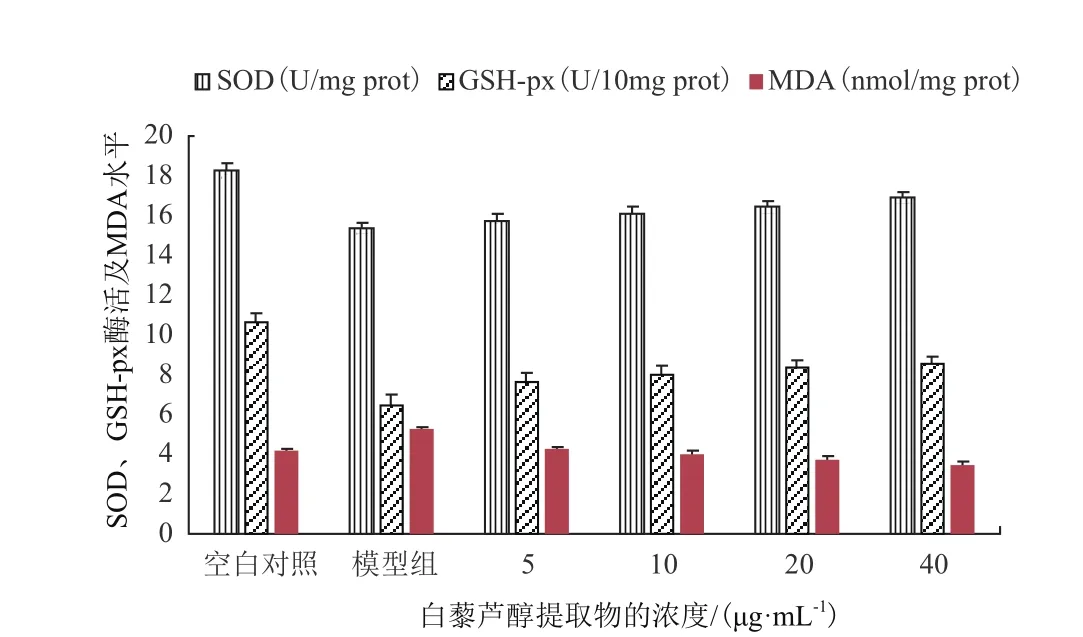
圖 3 白藜蘆醇提取物對SOD、GSH-Px活力及MDA水平的影響
2.4 白藜蘆醇提取物對衰老小鼠肝MDA含量、GSH-Px和SOD活力的影響
本研究發現白藜蘆醇提取物灌胃D-半乳糖致衰小鼠一段時間后,與衰老模型相比,小鼠肝內GSH-Px酶活性略有升高,由905.50±30.85升高到940.25±25.73(U/mg prot)。白藜蘆醇提取物對小鼠肝中MPA的產生有輕微的抑制作用,與衰老模型組小鼠相比,提取物抑制MDA產生,由8.65±2.98降至 7.96±3.98(nmol/mg prot),3個劑量組MDA含量差異不明顯。同衰老模型組小鼠相比,白藜蘆醇提取物能顯著增強衰老小鼠肝中SOD活性,且隨著提取物濃度的增大,SOD活性增強,由112.24±19.85升高至142.38±18.85(U/mg prot),高劑量組飼喂小鼠肝臟中SOD活性的增強較顯著(表1)。
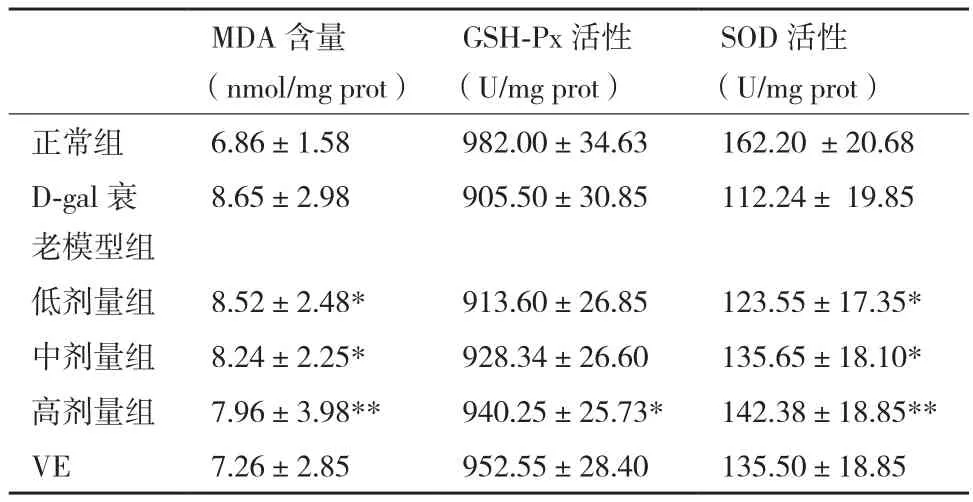
表1 白藜蘆醇提取物灌胃后衰老小鼠肝MDA含量及GSH-Px和SOD活性
2.5 白藜蘆醇的純化及質譜檢測
通過硅膠柱層析法對白藜蘆醇提取物進一步分離純化,洗脫下來富含白藜蘆醇的組分。通過質譜檢測發現,白藜蘆醇純化組分中含有m/z=226.9的色譜峰,與白藜蘆醇標準品一致,說明該組分中富含白藜蘆醇。
3 討論
葡萄籽作為一種葡萄酒產業的廢棄物,如果能充分利用葡萄籽資源提取白藜蘆醇等多酚類成分,可節約資源、變廢為寶、保護環境。雙水相萃取技術已廣泛應用于天然產物的提取分離等領域,乙醇-硫酸銨雙水相體系具有黏度小、價格低、分相清晰、綠色環保等特點,而超聲波輔助提取具有節省時間和溶劑、提取效率高等特點。超聲波輔助雙水相提取葡萄籽中白藜蘆醇的研究較少。卜曉英等[14]在研究雙水相萃取虎杖白藜蘆醇提純工藝中,白藜蘆醇含量為0.694%,李一凡等[15]在研究超聲波輔助提取葡萄芪化物工藝條件中,芪化物提取量可達104.97 μg/g,張喜峰等[16]在研究乙醇 - 硫酸銨雙水相體系分離純化葡萄籽總黃酮時發現,雙水相體系具有良好的黃酮類化合物萃取能力,總黃酮萃取率達到98.8%。本研究結合超聲波和雙水相的優勢,白藜蘆醇的提取率達到了2.408±0.088 mg/g,由于葡萄籽中本身白藜蘆醇的含量與虎杖也有所差別,所以與卜曉英的研究相比提取率略低,但與李一凡的研究相比,提取率較高。對于葡萄籽提取物對酒精誘導的LO2細胞以及衰老小鼠模型中SOD、GSH-px和MDA含量的影響可反應出葡萄籽提取物的抗氧化及保護細胞與機體防御氧化應激損傷的能力。對于這部分的研究目前也較少,周曉云等[17]研究發現白藜蘆醇對小鼠酒精性肝損傷有抑制作用,因而對肝細胞起保護作用,與本研究結果一致。白藜蘆醇的功能目前已經受到了人們的廣泛認可。本課題組也將對白藜蘆醇的保護細胞氧化損傷機理及延緩衰老功能機理進一步深入研究。
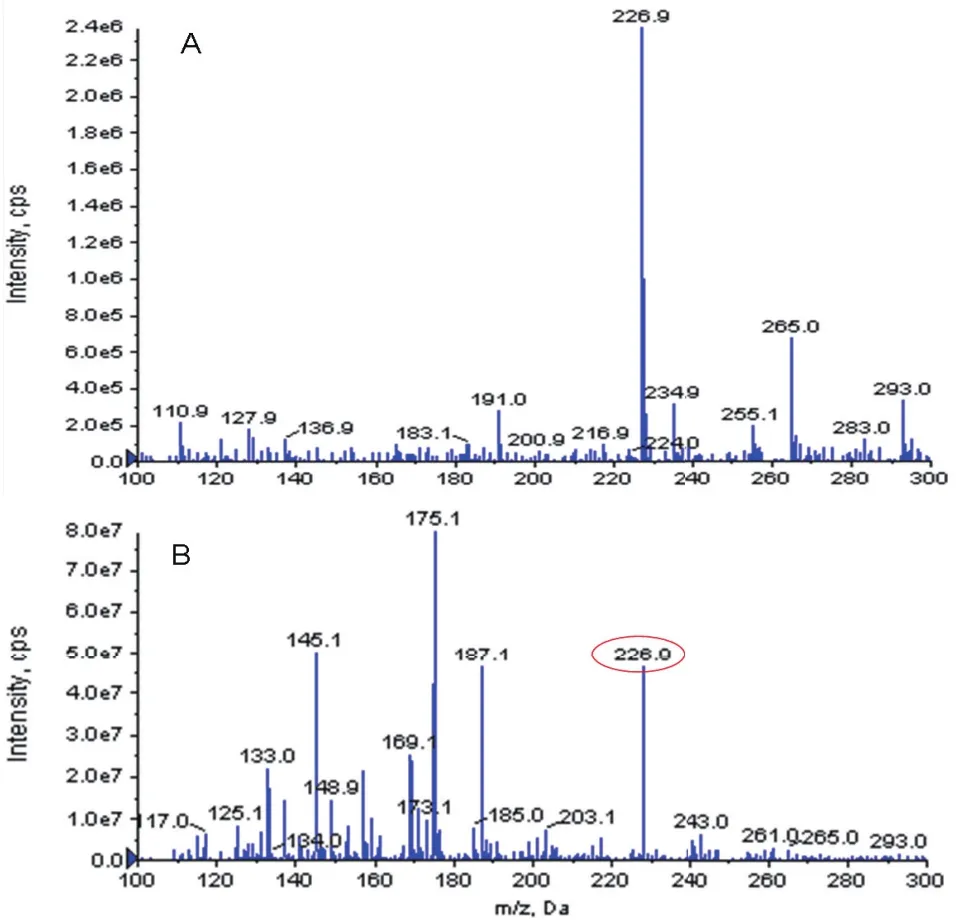
圖 4 白藜蘆醇及白藜蘆醇純化組分的質譜圖
4 結論
本研究通過超聲波輔助雙水相法對葡萄酒產業廢棄物葡萄籽進行白藜蘆醇的提取純化,白藜蘆醇提取率達到2.408±0.088 mg/g。白藜蘆醇提取物降低了乙醇誘導引起的丙二醛含量升高,且能顯著提高SOD和GSH-px的活性。白藜蘆醇提取物對衰老模型小鼠肝中丙二醛的產生有一定的抑制作用,且能夠提升SOD和GSH-px的活性。
[1]賈榮. 山葡萄籽提取物及抗氧化活性的研究[D]. 長春:吉林大學, 2010.
[2]夏蘭蘭, 張雅麗, 朱磊, 等. 葡萄籽多酚化合物抗氧化能力與抗癌細胞增殖活性的評價[J]. 食品科技, 2011(11):174-178.
[3]劉以娟, 范方輝, 王芳兵, 等. 葡萄籽提取物體外抗氧化活性的研究[J]. 食品工業科技, 2012(18):143-151.
[4]張喜峰, 李彩霞, 張瑾, 等. 超聲集成雙水相體系提取葡萄籽中的原花青素[J]. 天然產物研究與開發, 2013, 25:444-449.
[5]胡佳欽, 向福, 石長萍, 等. 金銀花中綠原酸的雙水相萃取及抗氧化能力研究[J]. 中國釀造, 2014, 34(12):109-112.
[6]陳姍姍, 王丹, 張超, 等. 紫甘薯花色苷在雙水相萃取體系中的分配特性[J]. 食品科學, 2013, 34(19):76-79.
[7]李超, 等. 超聲強化亞臨界水提取脫脂葡萄籽中原花青素的工藝及其抗氧化研究[J]. 中國中藥雜志, 2010(8):967-972.
[8]曹雪杰, 高明波, 樸晶晶. 雙水相萃取雙優紅葡萄籽中的白藜蘆醇[J]. 廣州化工 , 2015, 43(11):65-67.
[9]黃娜娜. 柑橘精油抗氧化特性及對皮膚細胞氧化損傷的保護作用研究[D]. 武漢:華中農業大學, 2016.
[10]徐叔云, 卞如鐮, 陳修. 藥理實驗方法學[M]. 第2版. 北京:人民衛生出版社, 2008:1465-1466.
[11] 王玉嬌. 草蓯蓉多糖對肝細胞氧化損傷的保護作用[D]. 延邊:延邊大學, 2014.
[12] 周玲芝. 白藜蘆醇酒劑對老齡小鼠MDA、SOD和GSH-PX的影響[J]. 湖南中醫藥大學學報, 2010, 30(7):45-46.
[13]趙旭, 劉壽榮, 馮仙菊, 等. 從氧化應激談白藜蘆醇對高尿酸介導的非酒精性脂肪肝大鼠的影響[J]. 中華中醫藥學刊,2016, 34(5):1193-1195.
[14]卜曉英, 姚姝鳳, 許新軍. 微波程序控溫控壓輔助雙水相萃取虎杖果實中白藜蘆醇與大黃素的研究[J]. 林產業化學與工業,2016, 36(5):113-119.
[15]李一凡, 等. 響應面法優化超聲波輔助提取玫瑰香葡萄中芪化物的工藝條件[J]. 食品工業科技, 2016(20):258-262.
[16]張喜峰, 楊春慧, 等. 乙醇/硫酸銨雙水相體系分離純化葡萄籽總黃酮[J]. 食品與發酵工業, 2013(10):254-258.
[17]周曉云, 崔曉明, 崔國金, 等. 白藜蘆醇對小鼠酒精性肝損傷的抑制作用[J]. 河北聯合大學學報:醫學版 , 2014, 16(1):3-5.

