溶氧對耶氏解脂酵母油脂積累和檸檬酸分泌的影響
亢新鑫,楊俊換,張懷淵,宋元達
(山東理工大學農(nóng)業(yè)工程與食品科學學院,山東淄博 255000)
產(chǎn)油微生物是指在特定條件下能將碳水化合物轉化為油脂并以脂滴的形式儲存在細胞內(nèi)的一些微生物,主要用來生產(chǎn)特殊用途的油脂或者是附加值較高的功能性油脂[13]。微生物油脂與傳統(tǒng)的動植物油脂相比較具有眾多優(yōu)勢[46]:微生物細胞生長迅速,發(fā)酵周期短;生長所需原料來源廣泛,不占用耕地;有利于保護環(huán)境等。產(chǎn)油微生物中研究最多的物種是耶氏解脂酵母(Yarrowialipolytica),在一定的培養(yǎng)條件下可以利用碳源發(fā)酵生產(chǎn)脂肪酸和有機酸等[78]。耶氏解脂酵母的產(chǎn)油量可以達到細胞干重的36%以上,其脂肪酸組成與一般的植物油相類似,以C16和C18為主[910],同時耶氏解脂酵母發(fā)酵過程中會產(chǎn)生大量的有機酸,以檸檬酸為主[1112]。目前大量的研究集中于耶氏解脂酵母的油脂積累和檸檬酸分泌的代謝調(diào)控,耶氏解脂酵母發(fā)酵過程中的碳源經(jīng)糖酵解途徑和三羧酸循環(huán)產(chǎn)生檸檬酸,產(chǎn)生的檸檬酸一部分參與油脂的合成,另一部分轉運出細胞外(圖1)。Tai等[13]同時過表達了二酰基甘油酰基轉移酶(DGA1)和乙酰輔酶A羧化酶(ACC1),使得耶氏解脂酵母細胞內(nèi)的油脂含量達到細胞干重的61.7%,油脂含量增加了5倍,而產(chǎn)生的檸檬酸減少到5 g/L。Liu等[14]以玉米漿代替酵母提取物作為唯一的有機氮源時,耶氏解脂酵母SWJ1b丙酮酸脫羧酶的活性增加,使得檸檬酸的產(chǎn)量增加了1.24倍。
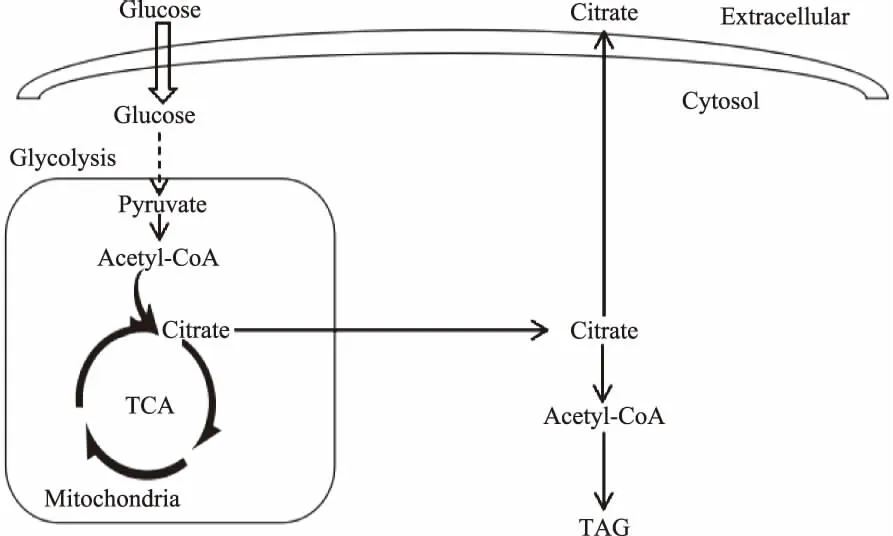
圖1 耶氏解脂酵母油脂積累和檸檬酸分泌的代謝途徑Fig.1 Metabolic pathway of lipid accumulation and citrate secretion in Yarrowia lipolytica
好氧性微生物在發(fā)酵過程中溶氧對菌體生長和代謝產(chǎn)物的產(chǎn)量影響極大[15],李佳偉[16]等將黑曲霉發(fā)酵前期攪拌轉速控制為600 r/min,發(fā)酵中后期攪拌轉速控制為500 r/min,檸檬酸產(chǎn)量達到141 g/L,比恒定轉速500 r/min提高了8.5%;李小鑫等[17]將地衣芽孢桿菌發(fā)酵培養(yǎng)基中溶氧含量控制在30%時,γ聚谷氨酸的產(chǎn)量達到了39.9 g/L。耶氏解脂酵母在生長和油脂積累過程中是需要氧氣的參與,溶氧是油脂積累和檸檬酸分泌發(fā)酵過程中的一個重要參數(shù)。
本文將耶氏解脂酵母在5 L發(fā)酵罐中培養(yǎng),并通過攪拌轉速和通氣量關聯(lián)來控制發(fā)酵過程中培養(yǎng)基的溶氧含量,分別研究溶氧含量為5%、10%、20%、30%和不控制時對耶氏解脂酵母的生長、油脂含量和檸檬酸產(chǎn)量的影響,以期為耶氏解脂酵母發(fā)酵過程的溶氧含量的優(yōu)化提供一定的實驗基礎。
1 材料與方法
1.1 材料與儀器
耶氏解脂酵母CICC 1778(=ATCC 20460) 購于中國工業(yè)微生物菌株保藏中心;正己烷(色譜純) 國藥集團化學試劑有限公司;脂肪酸標準品、檸檬酸標準品 Sigma公司;葡萄糖測定試劑盒 型號:361510,上海榮盛生物藥業(yè)有限公司;檸檬酸含量測定試劑盒 型號:QS2101,上海索橋生物科技有限公司;試劑A(苯酚10 g/L,硝普鈉50 mg/L)、試劑B(氫氧化鈉5 g/L,次氯酸鈉420 mg/L)、葡萄糖、硫酸銨、甲醇等 均為分析純。
Bioflo310 5 L全自動發(fā)酵罐 德國Eppendorf公司;6890N氣相色譜儀 美國Agilent Technologies公司;5424R臺式冷凍離心機 德國Eppendorf公司;SX500高壓蒸汽滅菌鍋 日本TOMY公司;真空冷凍干燥機 美國Labconco公司;UV2450紫外分光光度計 日本島津公司。
1.2 實驗方法
1.2.1 培養(yǎng)基的配制 種子培養(yǎng)基YNBD(g/L):葡萄糖10.0,無氨基酸和硫酸銨的酵母氮源1.7,硫酸銨5.0,121 ℃滅菌20 min;發(fā)酵培養(yǎng)基(g/L):葡萄糖90.0,硫酸銨2.0,酵母提取物1.0,無氨基酸和硫酸銨的酵母氮源1.5,121 ℃滅菌20 min[13]。
1.2.2 耶氏解脂酵母發(fā)酵培養(yǎng) 耶氏解脂酵母的發(fā)酵培養(yǎng)參考Mitchell的培養(yǎng)方法[13],從凍存管中(80 ℃)吸取100 μL菌液接種至含有5 mL YNBD液體培養(yǎng)基的試管中,于200 r/min,28 ℃振蕩培養(yǎng)48 h。以體積比為10%的接種量接入含有300 mL YNBD培養(yǎng)基的1 L錐形瓶中,200 r/min,28 ℃恒溫于搖床中培養(yǎng)48 h,制得種子液。
整個發(fā)酵過程在常壓下進行,將種子液以10%的接種量接入裝有3 L發(fā)酵培養(yǎng)基的發(fā)酵罐(5 L)中,初始發(fā)酵條件:轉速為300 r/min,通氣量6.0 vvm,恒溫28 ℃,恒定pH(6.8±0.05)(0.1 mol/L HCl和0.2 mol/L NaOH調(diào)控),發(fā)酵時間120 h。發(fā)酵初始階段標定溶氧為100%,發(fā)酵14 h后通過溶氧含量與攪拌轉速、通氣量的關聯(lián),調(diào)整發(fā)酵罐溶氧含量(DO)分別為5%,10%,20%,30%和不控制(DOC)。不控制溶氧是發(fā)酵過程中轉速恒為300 r/min,通氣量恒為6.0 vvm。
1.2.3 生物量的測定 準確吸取4 mL菌液于準確稱量的離心管(m1)中,4000 r/min離心10 min,收集菌體,蒸餾水洗滌2次,冷凍干燥后準確稱量(m2),二者重量的差別(m2m1)的250倍即生物量(單位,g/L)。
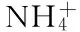
1.2.5 檸檬酸產(chǎn)量的測定 發(fā)酵過程中檸檬酸的測定按照檸檬酸含量測定試劑盒操作,具體如下:試劑一置于30 ℃水浴中預熱30 min。取EP管,依次加入100 μL不同濃度的檸檬酸標準液、700 μL試劑一、100 μL試劑四、100 μL試劑五,混勻后室溫靜置30 min,于545 nm測定吸光度,制備標準曲線(y=0.0009x0.0007,R2=0.9995)。樣品的測定根據(jù)需要進行稀釋,充分混勻,11000 r/min,4 ℃離心10 min,取上清液按上述方法進行測定,重復3次。糖酸轉化率(%)=發(fā)酵上清液中檸檬酸產(chǎn)量/葡萄糖總消耗量×100。
1.2.6 油脂的提取與含量的測定 油脂的提取參考Folch等的提取方法[19],準確吸取1 mL菌液放于提脂瓶中,4000 r/min離心10 min,收集菌體,用蒸餾水洗滌2次,盡量去掉上清。加入6 mol/L的鹽酸2 mL,充分混勻,80 ℃水浴3 h,加入2 mL氯仿、1 mL甲醇,同時加入100 μL脂肪酸標準品C15∶0作為內(nèi)參,充分混勻后離心,吸取下層液體至新的提脂瓶中,氮氣吹干,加入1 mL 10%的鹽酸甲醇(w/w),充分混勻,60 ℃水浴3 h,加入2 mL正己烷和1 mL飽和NaCl溶液,充分混勻后離心,吸取1 mL上層液體至氣相瓶中,通過氣相色譜法測定油脂含量及其脂肪酸組成,重復3次。通過比較各個脂肪酸和脂肪酸標準品C15∶0的峰面積,計算油脂總量及各脂肪酸組成。計算糖油轉化率(%)=油脂產(chǎn)量/葡萄糖總消耗量×100。
氣相色譜條件:不分流進樣,色譜柱是DM-FFAP(30 m×0.32 mm,0.22 μm),氫離子火焰檢測器,載氣為氮氣,氣化室溫度和檢測器溫度均為250 ℃,進樣量1 μL。升溫程序:初溫80 ℃,先以8 ℃/min的升溫速率升至200 ℃,再以1 ℃/min升溫速率升至205 ℃,最后以4 ℃/min的升溫速率升至240 ℃,保持5 min。
1.3 數(shù)據(jù)處理
實驗中每個數(shù)據(jù)測定均重復3次,采用SPSS 13.0進行統(tǒng)計學分析,應用GraphPad Prism 5軟件作圖。
2 結果與分析
2.1 溶氧含量對耶氏解脂酵母生物量的影響
由圖2可知,耶氏解脂酵母在不同溶氧含量的發(fā)酵培養(yǎng)基中生長,酵母菌的生長趨勢基本一致,種子液接入發(fā)酵培養(yǎng)基后快速進入對數(shù)期,并在24 h左右進入穩(wěn)定期。整個發(fā)酵過程溶氧含量對生物量的影響不明顯。由圖2可看出,溶氧含量控制在10%以上時,耶氏解脂酵母的生物量隨著溶氧含量的增加而增加,且不控制溶氧含量時,生物量達到最大,基本穩(wěn)定在16 g/L左右。而發(fā)酵后期(96~120 h)生物量均有下降,可能是因為培養(yǎng)基中的碳源耗盡后,酵母消耗了自身儲存的物質(zhì)來維持細胞正常的代謝活動。
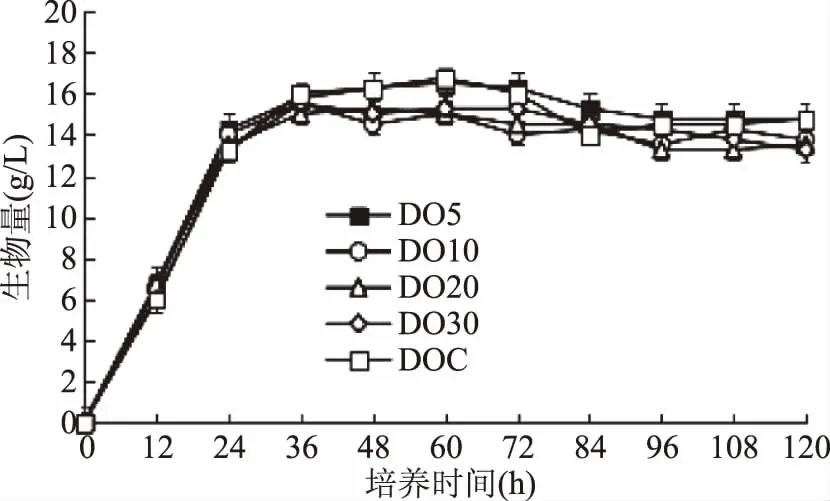
圖2 不同溶氧含量下耶氏解脂酵母生物量的變化Fig.2 Biomass of Y. lipolytica cultivated under different DO levels
2.2 溶氧含量對葡萄糖濃度和濃度的影響
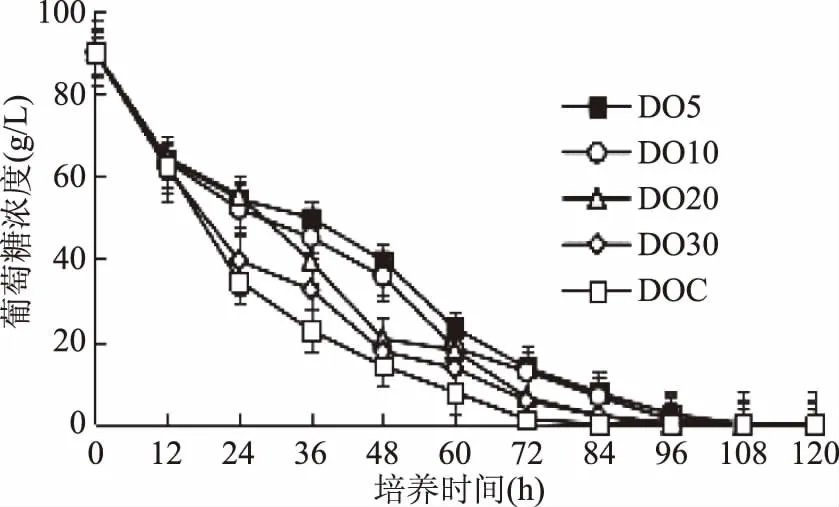
圖3 不同溶氧含量下發(fā)酵培養(yǎng)基中葡萄糖濃度的變化Fig.3 Residual glucose concentration in the culture medium under different DO levels
2.3 溶氧含量對耶氏解脂酵母檸檬酸分泌的影響
當耶氏解脂酵母發(fā)酵培養(yǎng)過程中的氮源耗盡且碳源充足時,酵母會將過量的碳源轉變?yōu)闄幟仕?而積累的檸檬酸會被轉運出細胞外。由圖4可以看出,發(fā)酵時間在24~96 h時,檸檬酸的積累速度加快。而且檸檬酸的產(chǎn)量隨著發(fā)酵培養(yǎng)基中溶氧含量的增大而增加,而不控制溶氧含量且發(fā)酵時間為120 h時檸檬酸的積累量達到最大,為21.00 g/L,糖酸轉化率為23.33%。

圖4 不同溶氧含量下發(fā)酵過程中檸檬酸產(chǎn)量的變化Fig.4 Citric acid concentration in the medium of Y. lipolytica cultivated under different DO levels
2.4 溶氧含量對耶氏解脂酵母油脂積累和脂肪酸組成的影響
耶氏解脂酵母細胞內(nèi)油脂的積累主要是通過限制培養(yǎng)基中的氮源,當?shù)春谋M且碳源充足時會在細胞內(nèi)積累大量的油脂。在5種溶氧含量發(fā)酵條件下,酵母細胞逐漸利用培養(yǎng)基中葡萄糖并轉化為油脂儲存在細胞內(nèi),且在發(fā)酵時間為96 h時,細胞內(nèi)油脂含量達到最大。如圖5所示,耶氏解脂酵母細胞內(nèi)的油脂含量隨著發(fā)酵培養(yǎng)基中溶氧含量的增大而增加,在不控制溶氧時,耶氏解脂酵母細胞的產(chǎn)油量達到最大,占細胞干重的11.62%(96 h),糖油轉化率為1.87%。而隨著發(fā)酵培養(yǎng)基中葡萄糖的耗盡,油脂的含量略有下降,這是由于當培養(yǎng)基中的碳源消耗完全時,酵母可以利用細胞內(nèi)儲存的油脂作為碳源,維持自身的生長,這與Bellou[21]和Makril[22]等的研究相符。
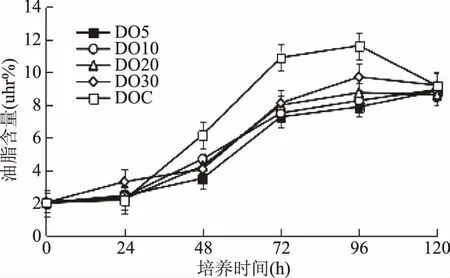
圖5 不同溶氧含量下耶氏解脂酵母細胞內(nèi)油脂含量的變化Fig.5 Lipid contents of Y. lipolytica cultivated under different DO levels
所提取油脂氣相色譜分析結果如表1所示,耶氏解脂酵母發(fā)酵產(chǎn)生的脂肪酸主要有軟脂酸(C16∶0)、棕櫚油酸(C16∶1)、硬脂酸(C18∶0)、油酸(C18∶1)和亞油酸(C18∶2),并且發(fā)酵過程中溶氧含量對耶氏解脂酵母細胞內(nèi)的脂肪酸組成影響較大。發(fā)酵時間為96 h時,軟脂酸(C16∶0)的含量隨著溶氧的增大而減少,油酸(C18∶1)的含量隨著溶氧的增大而增加。在不控制培養(yǎng)基溶氧含量時,軟脂酸和油酸的含量分別為20.13%和48.62%,與溶氧含量為5%時相比,軟脂酸的含量減少了14.31%,油酸的含量提高了12.31%。細胞內(nèi)多不飽和脂肪酸的形成需要分子氧作為電子受體參與反應,因此,耶氏解脂酵母發(fā)酵過程中溶氧含量的增加可能會促使多不飽和脂肪酸含量的增加。
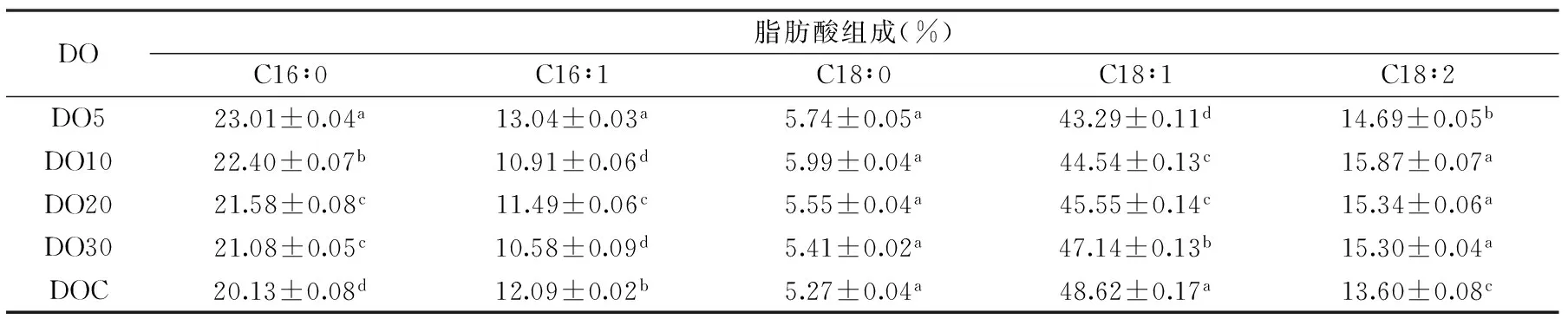
表1 不同溶氧含量下耶氏解脂酵母細胞內(nèi)脂肪酸組成Table 1 The fatty acid profile in Yarrowia lipolytica under different DO levels
3 討論
關于耶氏解脂酵母的研究主要集中在油脂積累和檸檬酸分泌調(diào)控等方面,研究表明發(fā)酵培養(yǎng)基中溶氧含量的增加可有效提高耶氏解脂酵母發(fā)酵產(chǎn)物的含量。Lopes發(fā)現(xiàn)提高耶氏解脂酵母發(fā)酵培養(yǎng)基中的氧傳遞速率,可使產(chǎn)物脂肪酶的產(chǎn)量從96.6 U/L提高到533.5 U/L[23];控制耶氏解脂酵母發(fā)酵過程中的轉速在400~900 r/min之間,通氣量在0.18~0.6 vvm之間,可使檸檬酸產(chǎn)量達到92.8 g/L[24]。本研究結果符合上述結論,隨著培養(yǎng)基中溶氧含量的增大耶氏解脂酵母的發(fā)酵產(chǎn)物油脂含量和檸檬酸分泌量均有所增加,油脂含量和檸檬酸的產(chǎn)量分別提高了47.84%和172%(表2)。葡萄糖經(jīng)過糖酵解途徑和三羧酸循環(huán)產(chǎn)生NADH和FADH2,需要經(jīng)過電子呼吸鏈將氫離子傳遞給氧氣,并產(chǎn)生大量的ATP,其中糖酵解途徑的部分反應需要ATP的參與。細胞在缺氧的條件下,NADH和FADH2不能徹底被轉化為ATP,提供給糖酵解的ATP減少,葡萄糖的消耗速率也降低(圖3),而三羧酸循環(huán)產(chǎn)生的檸檬酸也會減少,所以檸檬酸的分泌量降低(圖4)。而檸檬酸裂解產(chǎn)物乙酰輔酶A還是油脂合成的底物之一,油脂合成途徑中需要消耗大量的ATP,而且,不飽和脂肪酸的合成需要氧氣的參與,因此培養(yǎng)基中氧氣的限制會降低細胞內(nèi)油脂的合成(圖5)。耶氏解脂酵母發(fā)酵過程中油脂和檸檬酸積累速度不同步,發(fā)酵時間在48~72 h時,細胞內(nèi)的油脂快速積累;發(fā)酵時間在72~96 h時,檸檬酸也快速積累并分泌到細胞外,這與Carlos的研究一致[25]。同時,隨著培養(yǎng)基中溶氧含量的增加,軟脂酸(C16∶0)的含量減少,油酸(C18∶1)的含量增多。因此,可以通過控制發(fā)酵過程中的溶氧,微調(diào)脂肪酸代謝流向,得到產(chǎn)率更高的不飽和脂肪酸。
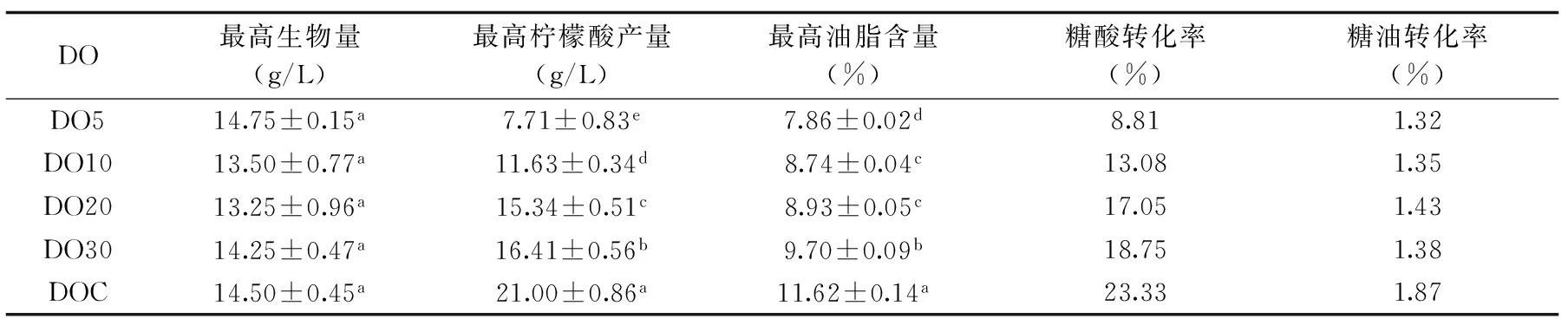
表2 不同溶氧含量下耶氏解脂酵母檸檬酸分泌量和油脂含量的比較Table 2 Citric acid and lipid content under different DO levels
4 結論
在發(fā)酵罐中培養(yǎng)耶氏解脂酵母,并通過轉速和通氣量的關聯(lián)來控制發(fā)酵過程中的溶氧含量,實驗結果顯示培養(yǎng)基中溶氧含量越高耶氏解脂酵母的產(chǎn)油量和檸檬酸分泌量越大,同時溶氧含量還會影響油脂的脂肪酸組成,導致油脂的不飽和脂肪酸含量增加。本研究為耶氏解脂酵母產(chǎn)脂發(fā)酵過程的溶氧含量的控制提供了一定的實驗基礎。
[1]Xin Meng,Yang Jianming,Xu Xin,et al.Biodiesel production from oleaginous microorganisms[J].Renewable Energy,2009,34(1):15.
[2]顏治,陳晶.微生物油脂及其開發(fā)利用研究進展[J].糧食與油脂,2003,16(7):1315.
[3]Ratledge C.Regulation of lipid accumulation in oleaginous microorganisms[J].Biochemical Society Transactions,2002,30(6):10471050.
[4]Chen Y,Ding Y,Yang L,et al.Integrated omics study delineates the dynamics of lipid droplets inRhodococcusopacusPD630[J].Nucleic Acids Research,2014,42(2):10521064.
[5]相光明,劉建軍,趙祥穎,等.微生物油脂研究進展[J].糧油加工,2008,9(9):5660.
[6]陳文娜,陳慧,彭寬.微生物油脂發(fā)酵技術研究現(xiàn)狀[J].糧食與油脂,2014,27(1):1821.
[7]Liu HuHu,Madzak C,Sun MeiLi,et al.EngineeringYarrowialipolyticafor arachidonic acid production through rapid assembly of metabolic pathway[J].Biochemical Engineering Journal,2017,119(7):5258.
[8]LedesmaAmaro R,Nicaud J M.Metabolic Engineering for expanding the substrate range ofYarrowialipolytica[J].Trends in Biotechnology,2016,34(10):798809.
[9]Cristiano E,Zhang Jianguo,Hu Bo.Lipid accumulation by pelletized culture ofMucorcircinelloideson corn stover hydrolysate[J].Applied Biochemistry Biotechnology,2014,174(1):411423.
[10]Gitte S,Dennis V,Anna K,et al.Microbial growth studies in biodiesel blends[J].Bioresource Technology,2011,102(8):52595264.
[11]Ferreira P,Lopes M,Mota M,et al.Oxygen mass transfer impact on citric acid production byYarrowialipolyticafrom crude glycerol[J].Biochemical Engineering Journal,2016,110(7):3542.
[12]Liu Huhu,Ji Xiaojun,Huang He.Biotechnological applications ofYarrowialipolytica:past,present and future[J]. Biotechnology Advances,2015,33(8):15221546.
[13]Tai M,Stephanopoulos G.Engineering the push and pull of lipid biosynthesis in oleaginous yeastYarrowialipolyticafor biofuel production[J].Metabolic Engineering,2013,15(1):19.
[14]Liu Xiaoyan,Wang Xinfeng,Xue Jiaxing,et al.Citric acid production byYarrowialipolyticaSWJ1b using corn steep liquor as a source of organic nitrogen and vitamins[J].Industrial Crops and Products,2015,78(19):154160.
[15]秦晴.溶氧對木薯為原料發(fā)酵生產(chǎn)檸檬酸的影響[J].甘肅農(nóng)業(yè)科技,2016,44(12):3536.
[16]李佳偉,劉龍,李江華,等. 兩階段攪拌轉速控制策略發(fā)酵生產(chǎn)檸檬酸[J]. 食品與生物技術學報,2014,33(2):131136.
[17]李小鑫,高明昊,張苗苗,等.溶氧對γ聚谷氨酸合成的影響[J].中國生物工程雜志,2015,35(3):4248.
[18]Wu S,Hu C,Zhao Xin,et al.Phosphatelimitation mediated lipid production byRhodosporidiumtoruloides[J].Bioresource Technology,2010,101(15):61246129.
[19]Folch J,Lees M,SloaneStanley G,et al.A simple method for the isolation and purification of total lipids from animal tissues[J].Biol Chem,1957,226(1):497509.
[20]Timoumi A,Bideaux C,Guillouet SE,et al. Influence of oxygen availability on the metabolism and morphology ofYarrowialipolytica:insights into the impact of glucose levels on dimorphism[J].Applied Microbiology and Biotechnology,2017,101(19):73177333.
[21]Bellou S,Makri A,Sarris D,et al.The olive mill waste water as substrate for single cell oil production byZygomycetes[J]. Journal of Biotechnology,2014,170(8):5059.
[22]Makri a,Fakas S,Aggelis G.Metabolic activities of biotechnological interest inYarrowialipolyticagrown on glycerol in repeated batch cultures[J].Bioresource Technology,2010,101(7):23512358.
[23]Lopes M,Gomes N,Gon?alves C,et al.Yarrowialipolyticalipase production enhanced by increased air pressure[J].Lett Appl Microbiol,2008,46(2):255260.
[24]Rywińska A,MusiaI,Zarowska B,et al.Effect of agitation and aeration on the citric acid production byYarrowialipolyticagrown on glycerol[J].Biochemistry Biotechnology,2012,42(3):279291.
[25]Carlos E R,Carine B,Stéphane E,et al.Dynamic metabolic modeling of lipid accumulation and citric acid production byYarrowialipolytica[J].Computers and Chemical Engineering,2017,100(10):139152.

