環(huán)介導(dǎo)等溫擴增-無電加熱法檢測乳中阪崎克羅諾桿菌
付世騫,曲艷艷,馮曉涵,滿朝新,姜毓君
(東北農(nóng)業(yè)大學(xué),乳品科學(xué)教育部重點實驗室,黑龍江 哈爾濱,150030)
阪崎克羅諾桿菌(Cronobactersakazakii),原名阪崎腸桿菌(Enterobactersakazakii)[1],隸屬于腸桿菌科,氧化酶呈陰性,兼性厭氧,革蘭氏陰性,周生鞭毛可運動[2-3]。它是一種能夠引起新生兒腦膜炎、壞死性小腸結(jié)腸炎和敗血癥的條件性致病菌[4-5],其主要污染來源為嬰兒配方粉,對嬰幼兒的致死率高達80%[6-7]。我國食品安全國家標(biāo)準(zhǔn)規(guī)定,阪崎克羅諾桿菌在嬰兒配方粉中不得檢出,這使得建立一種能夠快速有效的阪崎腸桿菌的檢測方法具有重大意義。
當(dāng)前現(xiàn)有的檢測阪崎克羅諾桿菌的方法包括傳統(tǒng)微生物培養(yǎng)法、分子生物學(xué)檢測方法[8]。傳統(tǒng)的微生物培養(yǎng)法具有較長的檢測時間和復(fù)雜的檢測過程。分子生物學(xué)檢測方法靈敏度高、特異性強、檢測速度快,然而卻需要電、技術(shù)人員、冷藏等條件,因此使用受限[9]。
環(huán)介導(dǎo)等溫擴增(Loop-mediated isothermal amplification, LAMP)是一種新型的核酸恒溫擴增方法,它的特點是快速、簡單、靈敏度高、特異性強,并且在恒溫條件下就可以完成擴增反應(yīng),LAMP產(chǎn)物可通過肉眼觀察或瓊脂糖凝膠電泳法完成對檢測結(jié)果的判定[10-12]。基于LAMP的這些特點,特別適用于在資源環(huán)境有限的條件下完成對嬰兒配方奶粉中阪崎克羅諾桿菌的現(xiàn)場檢測,但LAMP擴增需要熱源。
本研究利用氧化鈣和水反應(yīng)放熱結(jié)合特定熔點的相變材料設(shè)計一種無電加熱器,它與環(huán)介導(dǎo)等溫擴增技術(shù)相結(jié)合,能夠滿足LAMP對時間和溫度的要求,最終通過瓊脂糖凝膠電泳法檢測擴增結(jié)果[13-15]。本實驗所建立的檢測方法,靈敏度較高,檢測時間短,整個檢測過程中操作不需復(fù)雜的儀器且不需要電,沒有經(jīng)過培訓(xùn)的非專業(yè)人員也可以操作[16-17],能夠應(yīng)用在資源條件有限的環(huán)境中實現(xiàn)嬰兒配方奶粉中阪崎克羅諾桿菌的檢測。
1 材料與方法
1.1 材料與試劑
1.1.1菌株
本實驗使用菌株如表1所示。
1.1.2主要生化試劑
引物,英濰捷基(上海)貿(mào)易有限公司;甜菜堿,Sigma公司;瓊脂糖,美國Amresco公司;DL 2000 DNA marker,北京百泰克生物技術(shù)有限公司;Bst2.0 DNA Polymerase,New England Biolabs 公司;dNTP,寶生物工程(大連)有限公司;TSA瓊脂培養(yǎng)基,青島海博生物有限公司;氧化鈣,天津市致遠(yuǎn)化學(xué)試劑有限公司;相變材料,杭州魯爾能源科技有限公司。
1.2 儀器與設(shè)備
Bcn136O型生物超凈工作臺,上海佳勝儀器制造有限公司;DYY-10C 型電泳儀,北京市六一儀器廠;UVP凝膠成像系統(tǒng),美國UVP公司;GL-21M高速冷凍離心機,上海市離心機機械研究廠;快速混勻器,姜堰市新康醫(yī)療器械有限公司;微量臺式離心機,上海安亭科學(xué)儀器廠;高壓滅菌器,上海三申醫(yī)療器械有限公司;電熱恒溫水浴鍋,天津泰斯特儀器有限公司;ZHWY200B型全溫度恒溫培養(yǎng)搖床,上海智城分析儀器制造有限公司;保溫飯盒、溫度記錄器、K型熱偶線,超市購買。
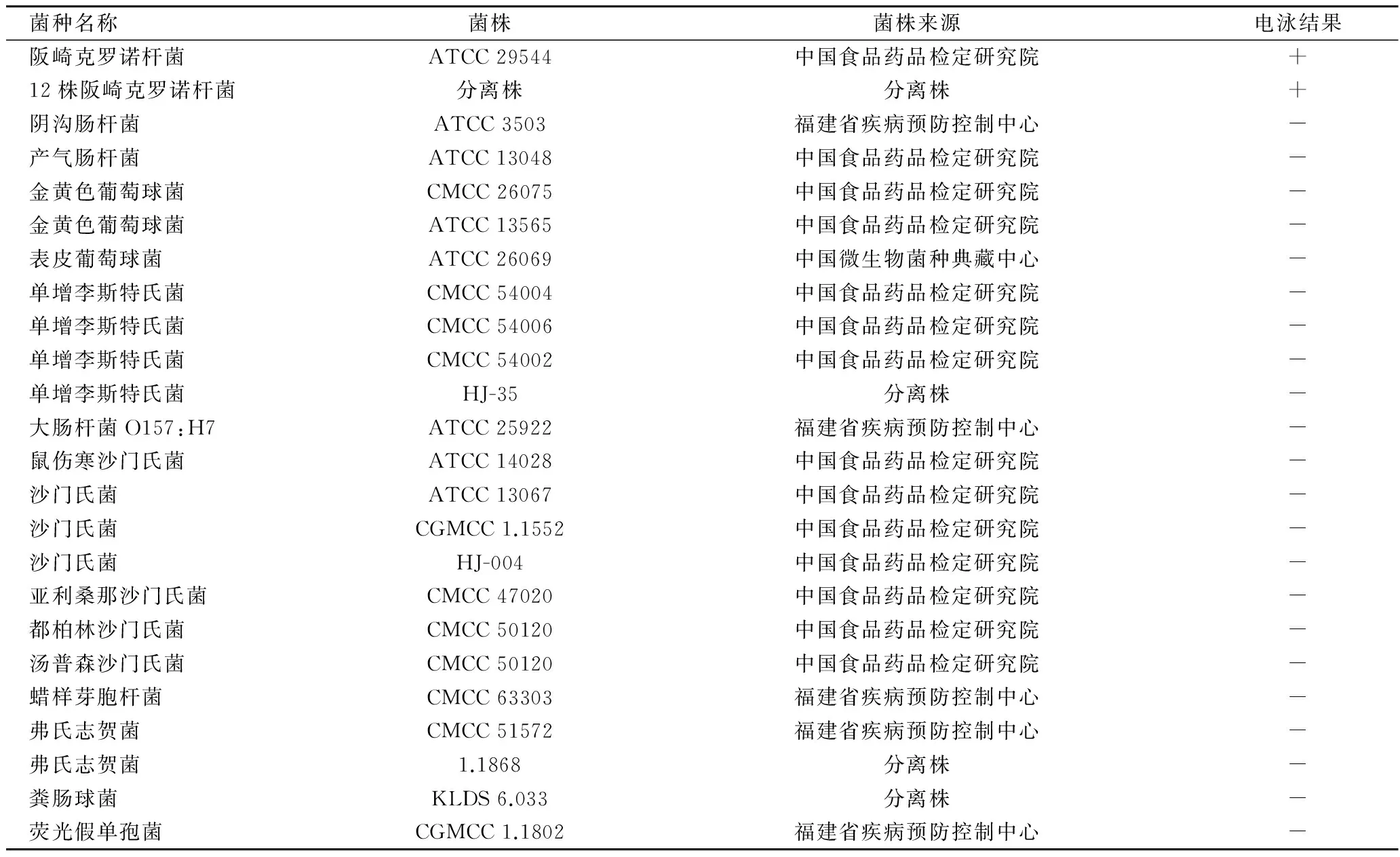
表1 主要菌株及其來源和LAMP電泳結(jié)果Table 1 Main strains and sources and the electrophoresis results of LAMP
注:“+”為陽性結(jié)果;“-”為陰性結(jié)果。
1.3 方法
1.3.1菌株的活化與保藏
在20 mL NB培養(yǎng)基中以2%的接種量接種已純化的ATCC 29544菌液,于37 ℃、200 r/min的條件下培養(yǎng)8 h,使菌體處于對數(shù)生長期,用于后續(xù)菌體DNA的提取和菌種保藏。取培養(yǎng)8 h左右的阪崎克羅諾桿菌培養(yǎng)液250 μL加到750 μL含有80%甘油的凍存管中,混勻后密封。在-20 ℃冰箱中保存。
其他細(xì)菌培養(yǎng)方法與上述培養(yǎng)方法基本一致,所用的固體和液體培養(yǎng)基分別是NA和NB培養(yǎng)基,按照細(xì)菌的最適生長條件進行培養(yǎng)。
1.3.2細(xì)菌計數(shù)方法
利用經(jīng)過滅菌的0.85%的生理鹽水進行稀釋,對阪崎克羅諾桿菌細(xì)菌培養(yǎng)液進行連續(xù)10倍梯度稀釋。然后分別取稀釋倍數(shù)為10-6、10-7、10-8的3個梯度進行平板涂布。將涂布好的平板放置在37 ℃下培養(yǎng)24 h,使其長出單菌落并進行計數(shù)。平板計數(shù)選取的菌落范圍在30~300之間,菌落平均數(shù)乘以稀釋倍數(shù)再乘10即為原菌液的活菌濃度(CFU/mL)。
1.3.3細(xì)菌DNA的提取
本研究采用試劑盒法快速提取細(xì)菌基因組DNA,于-20 ℃保存?zhèn)溆谩?/p>
1.3.4引物的設(shè)計與合成
本研究選取了目的基因為阪崎腸桿菌ITS基因,對其設(shè)計引物用于環(huán)介導(dǎo)等溫擴增。運用引物在線設(shè)計軟件(http://primerexplorer.jp/elamp4.0.0/index.html)進行引物設(shè)計。最終設(shè)計出6條引物:外引物B3、F3,內(nèi)引物FIP、BIP和環(huán)引物L(fēng)F、LB。引物序列為:
F3-AAATGCGCGGTGTGTCAG;
B3-GGTTTCCCCATTCGGACAT;
FIP-ACCGTGTACGCTTGTTCGCTTTCTCTCAAACTCGCAG CAC;
BIP-GGCAGTCAGAGGCGATGCGCCGGTTATAACGGTTCA;
LF-AACCTCACAACCCGAAGA;
LB-AGCGCCGGTAAGGTGATA
1.3.5無電加熱器
加熱器的結(jié)構(gòu)如圖1。首先將一定量的氧化鈣放到市售的保溫飯盒內(nèi),添加一定量的水將其和氧化鈣攪拌均勻,將稱取好的相變材料放到小鋁盒內(nèi),再將小鋁盒放到氧化鈣和水的混合物中并被包埋。小鋁盒上帶有適合尺寸為200 μL PCR管的孔。將連有溫度記錄器的熱偶線插入到相變材料中測定其溫度。
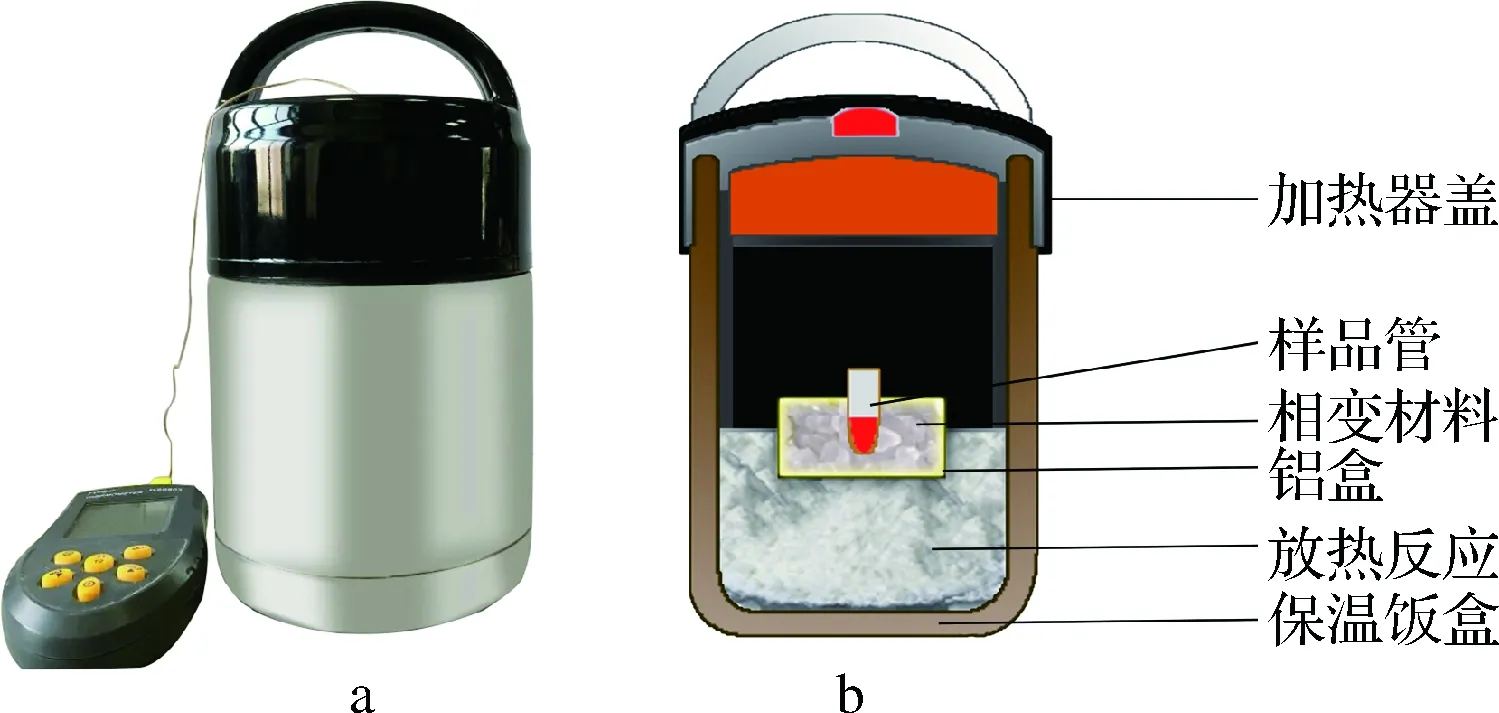
a-無電加熱器的外觀圖;b-無電加熱器的切面圖圖1 無電加熱器的結(jié)構(gòu)圖Fig.1 The structure of the electricity-free heater
1.3.6氧化鈣與水的比例的優(yōu)化
針對65 ℃的相變材料,固定相變材料及氧化鈣的質(zhì)量是10 g和30 g,水的添加量分別是4、5、6、7 mL。將連有溫度記錄器的熱偶插入到相變材料中測定其溫度。
1.3.7在無電加熱器中進行LAMP擴增的特異性研究
選取13株阪崎克羅諾桿菌和22株非阪崎克羅諾桿菌,提取基因組DNA作為模板并在無電加熱器中進行LAMP反應(yīng),利用2%的瓊脂糖凝膠電泳法進行檢測,用以驗證所設(shè)計引物的特異性,同時檢驗在無電加熱器中是否發(fā)生非特異性擴增。
1.3.8LAMP無電檢測體系的建立
配置25 μL的環(huán)介導(dǎo)等溫擴增反應(yīng)體系,分別將優(yōu)化到最佳配比的內(nèi)引物、外引物、環(huán)引物、10×ThermoPol Buffer、MgSO4、脫氧核糖核苷酸(dNTPs) 、Bst2.0 DNA 聚合酶及DNA模板混勻,最后加入滅菌水至25 μL。整個恒溫反應(yīng)為64 ℃持續(xù)45 min,然后于80 ℃保持5 min結(jié)束反應(yīng)。利用無電加熱器和傳統(tǒng)的用電加熱器分別進行LAMP反應(yīng),最終利用2%的瓊脂糖凝膠電泳方法分別進行檢測。
1.3.9靈敏度的檢測
1.3.9.1阪崎克羅諾桿菌純培養(yǎng)物的靈敏度實驗
阪崎克羅諾桿菌三區(qū)劃線于TSA培養(yǎng)基,培養(yǎng)18~24 h后長出單菌落,挑取單菌落加入到NB培養(yǎng)基中,培養(yǎng)8 h后進行10倍梯度稀釋并涂布計數(shù),確定其活菌的濃度。然后采用試劑盒法提取細(xì)菌基因組DNA,利用LAMP方法確定克羅諾桿菌純培養(yǎng)物的檢測限,其檢測結(jié)果通過瓊脂糖凝膠電泳法進行觀察。
1.3.9.2人工污染的嬰兒配方奶粉中阪崎克羅諾桿菌的靈敏度實驗
在人工污染嬰兒配方奶粉前,利用國標(biāo)的方法檢驗,確定不含阪崎克羅諾桿菌。將1 g嬰兒配方奶粉加入8 mL生理鹽水使其全部溶解,分別取1.3.9.1所述的1 mL進行梯度稀釋的菌液加入溶解的嬰兒配方奶粉中,并以不污染阪崎克羅諾桿菌的嬰兒配方奶粉作為陰性對照。采用試劑盒法提取DNA,并作為LAMP反應(yīng)的模板。利用LAMP法確定污染阪崎克羅諾桿菌的嬰兒配方奶粉的檢測限,其中檢測結(jié)果通過瓊脂糖凝膠電泳法進行觀察。
1.3.9.3不同環(huán)境溫度下乳中阪崎克羅諾桿菌靈敏度的檢測
嬰兒配方奶粉的污染、DNA的提取和LAMP反應(yīng)及結(jié)果的觀察如1.3.9.2所述,與其不同的是利用無電加熱器進行靈敏度的測定,分別在4、25和37 ℃的環(huán)境溫度條件下進行。
2 結(jié)果與分析
2.1 氧化鈣與水的比例優(yōu)化
LAMP反應(yīng)溫度為65 ℃左右,通過計算溫度的平均值和標(biāo)準(zhǔn)偏差得出相變材料的溫度譜線如圖2所示,藍色線代表相變材料的溫度,隨著氧化鈣和水的比例的降低,相變材料的溫度逐漸升高。如圖2-B所示,當(dāng)氧化鈣和水的量分別為30 g和5 mL時,無電加熱器能滿足LAMP反應(yīng)的溫度和時間。在進行LAMP反應(yīng)的過程中,200 μL的離心管大約45 min后從加熱器中取出來。
2.2 在無電加熱器中進行LAMP擴增的特異性研究
在無電加熱器中進行LAMP擴增后,LAMP產(chǎn)物通過觀察瓊脂糖凝膠電泳電泳條帶得出檢測結(jié)果。結(jié)果如表1所示,所有13株阪崎克羅諾桿菌均顯示陽性,所有22株非阪崎克羅諾桿菌均顯示陰性,因此證明了LAMP引物的特異性,并且證明在無電加熱器中進行LAMP未發(fā)生非特異性擴增。
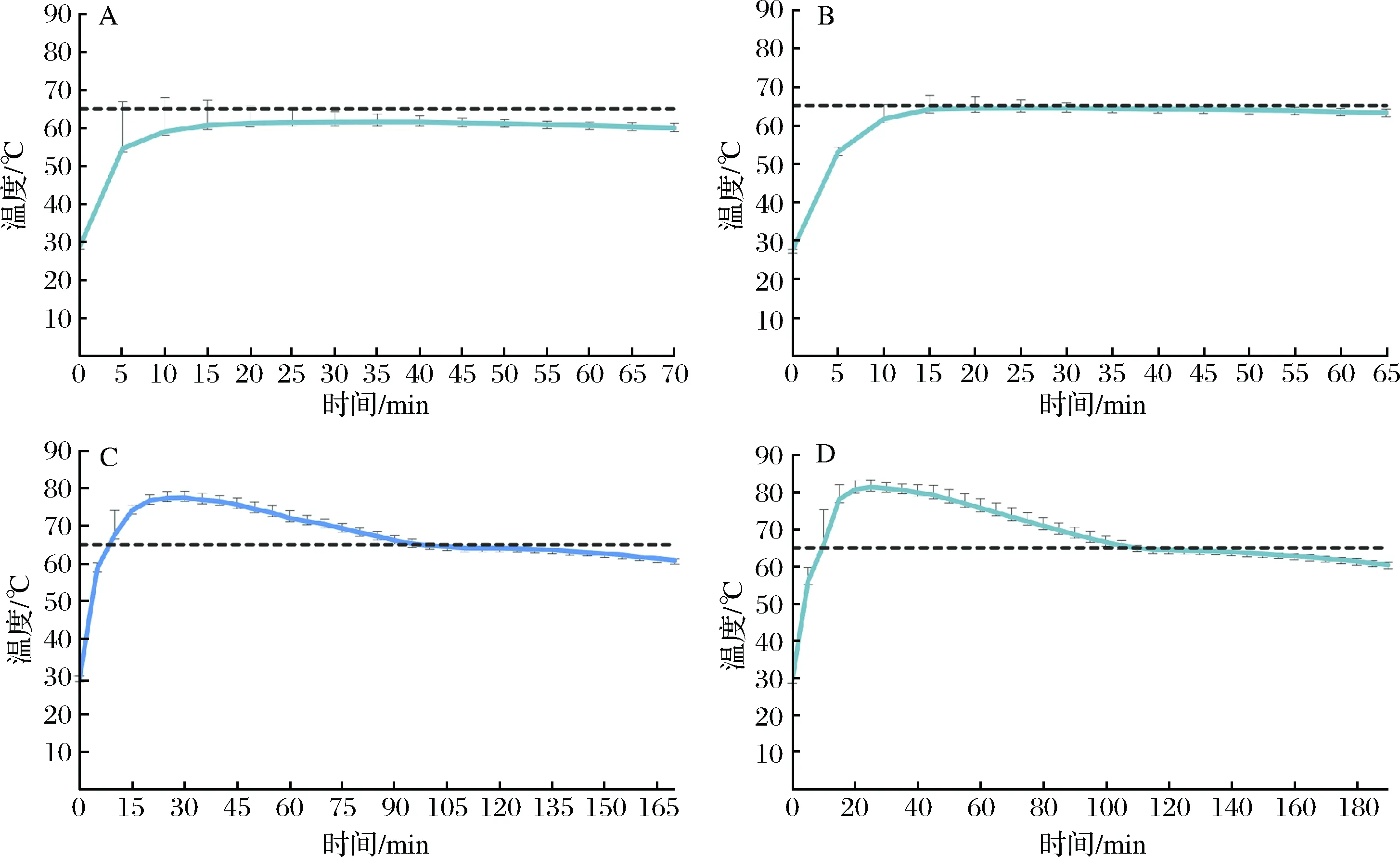
圖2 氧化鈣與水的比例的優(yōu)化(65 ℃)Fig.2 Optimization of the proportion calcium oxide and water(65 ℃)(注:1. 固定相變材料及氧化鈣的質(zhì)量為10 g和30 g;2. 水的添加量A-D分別為: 4、5、6、7 mL。)
2.3 LAMP無電檢測體系的建立
經(jīng)過優(yōu)化,最佳的LAMP體系見表2。

表2 LAMP的最優(yōu)體系Table 2 The optimal LAMP reaction system
上述LAMP體系在65 ℃條件下反應(yīng)45 min, 80 ℃條件下終止反應(yīng)5 min。
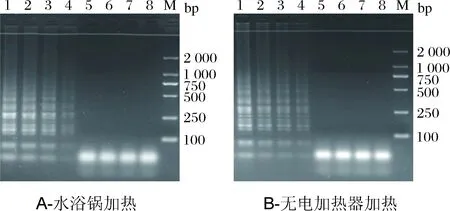
利用無電加熱器和傳統(tǒng)用電加熱器分別進行LAMP反應(yīng),通過觀察電泳條帶得出檢測結(jié)果如圖3。結(jié)果表明,利用無電加熱器能夠完成LAMP反應(yīng)的過程,與傳統(tǒng)的帶電加熱器沒有產(chǎn)生顯著性差異。
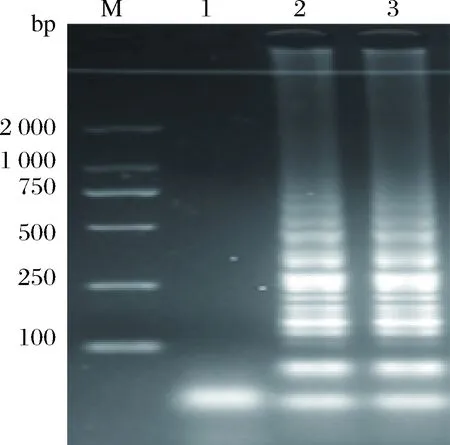
M-Marker;1-陰性;2-用電加熱器;3-無電加熱器。圖3 無電加熱器和傳統(tǒng)用電加熱器檢測結(jié)果的電泳圖Fig.3 The electrophoregram of detection in the portableelectricity-free heater and conventional electric heater
2.4 靈敏度的檢測
2.4.1阪崎克羅諾桿菌純培養(yǎng)物的靈敏度實驗
原始菌液濃度為2.6×109CFU/mL,進行梯度稀釋后泳道1~7的菌液濃度依次為2.6×105~2.6×10-1CFU/mL。從圖4可知,1~4泳道都有典型的LAMP擴增條帶,而5~7未見LAMP擴增。由此可見,利用無電加熱器和有電加熱器對阪崎克羅諾桿菌純培養(yǎng)物的檢測靈敏度均為2.6×102CFU/mL。
2.4.2人工污染的嬰兒配方奶粉中阪崎克羅諾桿菌的靈敏度實驗
泳道1~7的菌液濃度依次為從4.2×105~4.2×10-1CFU/mL。從圖5可見,泳道1~4的LAMP反應(yīng)都發(fā)生擴增,而5~7未見LAMP擴增,由此可知,利用傳統(tǒng)用電加熱器和無電加熱器檢測嬰兒配方奶粉中阪崎克羅諾桿菌的靈敏度均為4.2×102CFU/mL。
M-DNA marker;1~7-分別對應(yīng)菌液濃度為2.6×105、2.6×104、2.6×103、2.6×102、2.6×101、2.6×100、2.6×10-1 CFU/mL; 8-陰性對照圖4 阪崎克羅諾桿菌純培養(yǎng)物的靈敏度Fig.4 The detection sensitivity of C. sakazakii in the pure cultures
2.4.3環(huán)境溫度對檢測靈敏度的影響
在不同的環(huán)境溫度下,對嬰兒配方奶粉中阪崎克羅諾桿菌的檢測靈敏度見表3,結(jié)果表明在4、25 ℃和37 ℃的環(huán)境條件下,其檢測靈敏度均能達到102CFU/mL,因此證明在操作環(huán)境溫度4~37 ℃的條件下,利用無電加熱器檢測嬰兒配方奶粉中阪崎克羅諾桿菌的靈敏度是穩(wěn)定的。

表3 不同環(huán)境溫度下檢測嬰兒配方奶粉中阪崎克羅諾桿菌的靈敏度Table 3 The sensitivity of the C. sakazakiiin powderedinfant formula in different ambient temperature
3 結(jié)論
在核酸擴增技術(shù)中環(huán)介導(dǎo)等溫擴增法具有較高的靈敏度、特異性、簡單、快速、LAMP維持恒溫即可實現(xiàn)擴增等特點,與PCR方法相比,LAMP對一些抑制物不敏感[18],制備較簡單,而且LAMP產(chǎn)物的檢測可以通過橫向流動試紙條[19]、添加染料和觀察濁度法等進行可視化檢測,特別適用于現(xiàn)場檢測。本實驗利用設(shè)計的無電加熱器維持LAMP反應(yīng)所需要的溫度和時間,以實現(xiàn)核酸擴增的目的,整個過程操作簡單、不需要電和專業(yè)人員,在資源有限的環(huán)境即可實現(xiàn)檢測。
在無電加熱器中進行LAMP擴增的特異性檢測,通過瓊脂糖凝膠電泳圖表明,所有13株阪崎克羅諾桿菌均顯示陽性,所有22株非阪崎克羅諾桿菌均顯示陰性,因此證明了LAMP引物的特異性,和在無電加熱器中進行LAMP未發(fā)生非特異性擴增。
阪崎克羅諾桿菌檢測靈敏度的測定分別利用無電加熱器和傳統(tǒng)的帶電加熱器加熱,結(jié)果表明,2種加熱方式對克羅諾桿菌的檢測靈敏度并沒有產(chǎn)生顯著性差異。在資源有限的環(huán)境條件下,例如野外、家庭及貧窮的地區(qū)等,在檢測的過程中可能會遭受低溫或者高溫,所以需要證明無電加熱器在整個檢測過程中所得出的檢測靈敏度是可靠的,不會因為環(huán)境溫度過高或者過低影響檢測靈敏度,我們針對4、25和37 ℃ 3個環(huán)境溫度,利用無電加熱器對嬰兒配方奶粉中阪崎克羅諾桿菌進行靈敏度穩(wěn)定性的檢測。結(jié)果表明3個不同環(huán)境溫度對檢測靈敏度并沒有產(chǎn)生顯著性差異,檢測靈敏度均能達到102CFU/g。因此針對乳中克羅諾桿菌檢測設(shè)計的無電檢測體系在現(xiàn)場檢測是具有實用性的。
[1]趙貴明, 劉洋, 陳穎, 等. 克羅諾桿菌MALDI-TOF-MS數(shù)據(jù)庫的建立及應(yīng)用[J]. 食品科學(xué), 2014, 35(8): 105-110.
[2]梁安莉, 石云良, 孫貴娟, 等. 克羅諾桿菌致病性研究進展及流行現(xiàn)狀[J]. 中國熱帶醫(yī)學(xué), 2016, 16(10): 1 045-1 048.
[3]KALYANTANDA G, SHUMYAK L, ARCHIBALD L K.Cronobacterspecies contamination of powdered infant formula and the implications for neonatal health[J]. Frontiers in Pediatrics, 2015(3): 56.
[4]周文琦, 王蕊, 王喆, 等. 乳中阪崎克羅諾桿菌的快速捕獲方法的建立[J]. 中國乳品工業(yè), 2016, 44(12): 19-21.
[5]董鑫悅, 滿朝新, 盧雁, 等. 環(huán)介導(dǎo)等溫擴增法快速檢測乳中阪崎腸桿菌[J]. 食品工業(yè)科技, 2013, 34(5): 318-320.
[6]SONBOL H, JOSEPH S, MCAULEY C M, et al. Multilocus sequence typing ofCronobacterspp. from powdered infant formula and milk powder production factories[J]. International Dairy Journal, 2013, 30(1):1-7.
[7]SONG X, SHUKLA S, Lee G, et al. Detection ofCronobactergenus in powdered infant formula by Enzyme-linked Immunosorbent Assay using anti-Cronobacterantibody[J]. Frontiers in Microbiology, 2016, 7(e52091).
[8]李春梅, 陶小春. 食源性致病菌快速檢測方法研究進展[J]. 醫(yī)學(xué)理論與實踐, 2014(5): 590-592.
[9]陶光燦, 李勇, 崔廷婷, 等. 酶聯(lián)免疫吸附法檢測動物源性食品中氨苯砜殘留[J]. 食品與生物技術(shù)學(xué)報, 2013, 32(7): 778-783.
[10]YANG J, GUAN G, NIU Q, et al. Development and application of a loop-mediated isothermal amplification assay for rapid detection of Borrelia burgdorferi s. l. in Ticks[J]. Transboundary & Emerging Diseases, 2013, 60(3): 238.
[11]龐心怡, 滿朝新, 趙玥明, 等. 環(huán)介導(dǎo)等溫擴增技術(shù)快速檢測肉中沙門氏菌[J]. 中國食物與營養(yǎng), 2015, 21(8): 12-15.
[12]張勝凱, 張先舟, 王羽, 等. 環(huán)介導(dǎo)等溫擴增技術(shù)檢測沙門氏菌反應(yīng)體系的優(yōu)化[J]. 安徽農(nóng)業(yè)科學(xué), 2010, 38(22): 11 727-11 729.
[13]LIU C, MAUK M G, HART R, et al. A self-heating cartridge for molecular diagnostics [J]. Lab on A Chip, 2011, 11(16): 2 686.
[14]LIU C, GEVA E, MAUK M, et al. An isothermal amplification reactor with an integrated isolation membrane for point-of-care detection of infectious diseases[J]. Analyst, 2011, 136(10): 2 069-2 076.
[15]SEMA M, ALEMU A, BAYIH A G, et al. Evaluation of non-instrumented nucleic acid amplification by loop-mediated isothermal amplification (NINA-LAMP) for the diagnosis of malaria in Northwest Ethiopia[J]. Malaria Journal, 2015, 14(1): 44.
[16]PAI N P, VADNAIS C, DENKINGER C, et al. Point-of-care testing for infectious diseases: diversity, complexity, and barriers in low-and middle-income countries[J]. Plos Medicine, 2012, 9(9): e1001306-e1001306.
[17]NIEMZ A, FERGUSON T M, BOYLE D S. Point-of-care nucleic acid testing for infectious diseases[J]. Trends in Biotechnology, 2011, 29(5): 240.
[18]CURTIS K A, RUDOLPH D L, OWEN S M. Sequence-specific detection method for reverse transcription, loop-mediated isothermal amplification of HIV-1[J]. Journal of Medical Virology, 2009, 81(6): 966.
[19]LEE D, KIM Y T, LEE J W, et al. An integrated direct loop-mediated isothermal amplification microdevice incorporated with an immunochromatographic strip for bacteria detection in human whole blood and milk without a sample preparation step[J]. Biosensors & Bioelectronics, 2015, 79: 273.

